Konfigurasi elektron dengan energi ionisasi tertinggi itu bukan cuma angka di tabel periodik, lho. Dia itu seperti bodyguard paling tangguh yang menjaga inti atom, bikin unsur-unsurnya jadi super selektif dan enggan berinteraksi. Bayangkan, butuh energi gila-gilaan cuma untuk melepas satu elektron dari sang penguasa stabilitas ini. Kalau kamu penasaran unsur mana yang punya ‘benteng’ terkuat dan kenapa dia bisa sebegitu hebatnya, kita bakal mengupasnya sampai ke akar-akarnya.
Semua bermula dari susunan elektron yang rapi dan sempurna. Unsur-unsur dengan konfigurasi seperti kulit penuh atau setengah penuh—seperti para bangsawan gas mulia—memegang erat-e-erat elektron mereka. Inilah yang bikin energi ionisasi pertama mereka melambung tinggi, jauh di atas tetangga-tetangganya di tabel periodik. Dengan memahami polanya, kita bisa memprediksi dari mana sifat inert itu datang dan mengapa beberapa unsur begitu sulit bereaksi.
Nah, konfigurasi elektron dengan energi ionisasi tertinggi itu kayak atom yang paling “pelit” melepas elektronnya, butuh usaha ekstra banget. Prinsip fokus dan stabilitas ini mirip kayak kita lagi memilih media belajar yang tepat, lho. Coba deh simak analisis seru tentang Perbandingan Pilihan Media Bacaan Siswa SMP Sukamaju: Online vs Cetak untuk melihat bagaimana pilihan yang tepat bisa bikin pemahaman kita makin “stabil” dan sulit ‘terionisasi’.
Jadi, sama kayak atom mulia tadi, fondasi belajar yang kokoh dimulai dari memilih media yang pas.
Konsep Dasar Konfigurasi Elektron dan Energi Ionisasi
Bayangkan kamu punya sebuah atom. Di dalamnya, elektron-elektron itu nggak ngumpul sembarangan, tapi tinggal di “rumah” yang disebut kulit dan subkulit dengan aturan ketat, yaitu konfigurasi elektron. Nah, energi ionisasi pertama itu seperti usaha yang perlu kita keluarkan buat mengusir satu elektron yang paling bandel—elektron valensi—dari rumahnya itu. Hubungannya langsung banget: semakin nyaman dan kuat ikatan elektron itu dengan inti atom, semakin besar energi yang diperlukan buat melepasnya, alias energi ionisasinya makin tinggi.
Trennya di tabel periodik cukup konsisten. Dalam satu golongan dari atas ke bawah, energi ionisasi cenderung turun. Ini karena jari-jari atom membesar, elektron terluar makin jauh dari inti, sehingga gaya tarik inti melemah dan lebih mudah dilepaskan. Contohnya, dalam Golongan 1 (Alkali), Lithium (Li: [He] 2s¹) punya energi ionisasi lebih tinggi daripada Natrium (Na: [Ne] 3s¹), yang lebih tinggi lagi daripada Kalium (K: [Ar] 4s¹).
Sebaliknya, dalam satu periode dari kiri ke kanan, energi ionisasi umumnya naik. Atom makin kecil, muatan inti efektif bertambah, sehingga elektron terluar makin kenceng dipegang. Misalnya, dari Natrium (Na: [Ne] 3s¹) ke Argon (Ar: [Ne] 3s² 3p⁶), energi ionisasi meningkat signifikan.
Ciri Konfigurasi Elektron dengan Energi Ionisasi Sangat Tinggi, Konfigurasi elektron dengan energi ionisasi tertinggi
Ada beberapa konfigurasi spesial yang bikin atom jadi super sulit melepaskan elektron. Konfigurasi ini biasanya sangat stabil. Yang paling terkenal adalah konfigurasi kulit penuh (seperti s² p⁶ pada gas mulia) atau setengah penuh (seperti p³ pada Nitrogen). Kestabilan ini muncul karena simetri dan energi yang rendah. Misalnya, melepas satu elektron dari konfigurasi penuh seperti Ne ([He] 2s² 2p⁶) akan merusak kestabilan yang sempurna itu, butuh energi luar biasa besar.
Begitu juga dengan Nitrogen (N: 1s² 2s² 2p³) yang punya orbital p setengah penuh yang stabil, membuat energi ionisasinya lebih tinggi daripada Oksigen di sebelahnya, meski secara tren periode seharusnya naik terus.
Analisis Unsur dengan Energi Ionisasi Tertinggi
Kalau kita ngobrolin juara bertahan dalam hal mempertahankan elektron, maka puncak klasemennya didominasi oleh para gas mulia. Mereka adalah para bangsawan yang enggan berinteraksi, dan rahasianya ada pada konfigurasi elektron yang sempurna.
| Nama Unsur | Nomor Atom | Konfigurasi Elektron Lengkap | Energi Ionisasi Pertama (kJ/mol) |
|---|---|---|---|
| Helium (He) | 2 | 1s² | 2372 |
| Neon (Ne) | 10 | 1s² 2s² 2p⁶ | 2081 |
| Argon (Ar) | 18 | 1s² 2s² 2p⁶ 3s² 3p⁶ | 1521 |
| Krypton (Kr) | 36 | [Ar] 4s² 3d¹⁰ 4p⁶ | 1351 |
| Xenon (Xe) | 54 | [Kr] 5s² 4d¹⁰ 5p⁶ | 1170 |
Posisi Tertinggi Helium dan Pengecualian dalam Tren
Source: slidesharecdn.com
Helium itu unik. Meski cuma punya dua elektron, konfigurasi 1s²-nya itu adalah konfigurasi kulit pertama (n=1) yang sudah penuh. Orbital 1s itu sangat dekat dengan inti, sehingga elektron merasakan tarikan inti yang sangat kuat tanpa adanya efek perisai yang signifikan dari elektron lain. Inilah yang membuat Helium menjadi unsur dengan energi ionisasi tertinggi, bahkan mengalahkan Neon dan argon yang lebih berat.
Tren energi ionisasi dalam satu periode juga nggak selalu mulus naik. Ada pengecualian menarik antara Nitrogen (N, 2s² 2p³) dan Oksigen (O, 2s² 2p⁴). Secara logika, karena Oksigen ada di kanan Nitrogen, energi ionisasinya harusnya lebih tinggi. Tapi kenyataannya, energi ionisasi Nitrogen (1402 kJ/mol) lebih tinggi dari Oksigen (1314 kJ/mol). Alasannya kembali ke konfigurasi.
Kalau ngomongin konfigurasi elektron dengan energi ionisasi tertinggi, kita pasti bicara soal atom yang super sulit melepaskan elektronnya. Nah, prinsip ‘kemandirian’ ini mirip banget lho dengan konsep fisika Perpindahan kalor tanpa perpindahan zat dinamakan konduksi, di mana panas bisa merambat tanpa perlu ada materi yang ikut pindah. Jadi, sama kayak elektron yang nggak mau lepas, energi panas juga bisa bertransfer dengan cara yang lebih ‘setia’ tanpa perlu membawa-bawa zat perantaranya.
Intinya, baik di dunia atom maupun kalor, keduanya punya mekanisme unik yang efisien dan mandiri.
Orbital p Nitrogen setengah penuh (p³) yang stabil. Untuk melepas satu elektron dari konfigurasi stabil ini butuh energi ekstra. Sementara, Oksigen dengan konfigurasi p⁴ punya satu elektron berpasangan di salah satu orbital p. Elektron berpasangan itu saling tolak, sehingga sedikit lebih mudah untuk diambil, menyebabkan penurunan kecil dalam energi ionisasi.
Prosedur Penentuan dan Perhitungan Teoritis
Kita bisa memprediksi urutan energi ionisasi dengan cukup akurat hanya dengan mengamati konfigurasi elektron valensi, tanpa perlu menghafal angka pastinya. Ini seperti membaca peta kekuatan sebuah atom.
Ambil contoh unsur periode 2: Li, Be, B, C, N, O, F, Ne. Konfigurasi valensinya berturut-turut adalah 2s¹, 2s², 2s² 2p¹, 2s² 2p², 2s² 2p³, 2s² 2p⁴, 2s² 2p⁵, 2s² 2p⁶. Secara umum, energi ionisasi akan naik dari Li ke Ne karena muatan inti bertambah. Namun, perhatikan penyimpangan: Energi Be (2s² penuh) akan lebih tinggi dari B (2p¹) karena stabilitas kulit s yang penuh.
Energi N (2p³ setengah penuh) akan lebih tinggi dari O (2p⁴) karena alasan yang sudah dijelaskan. Puncaknya tentu di Ne dengan kulit valensi penuh.
Lompatan Besar Energi Ionisasi sebagai Bukti Eksperimental
Konsep kestabilan kulit dalam ini bukan cuma teori. Data eksperimen menunjukkan bukti nyata berupa lompatan besar energi ionisasi.
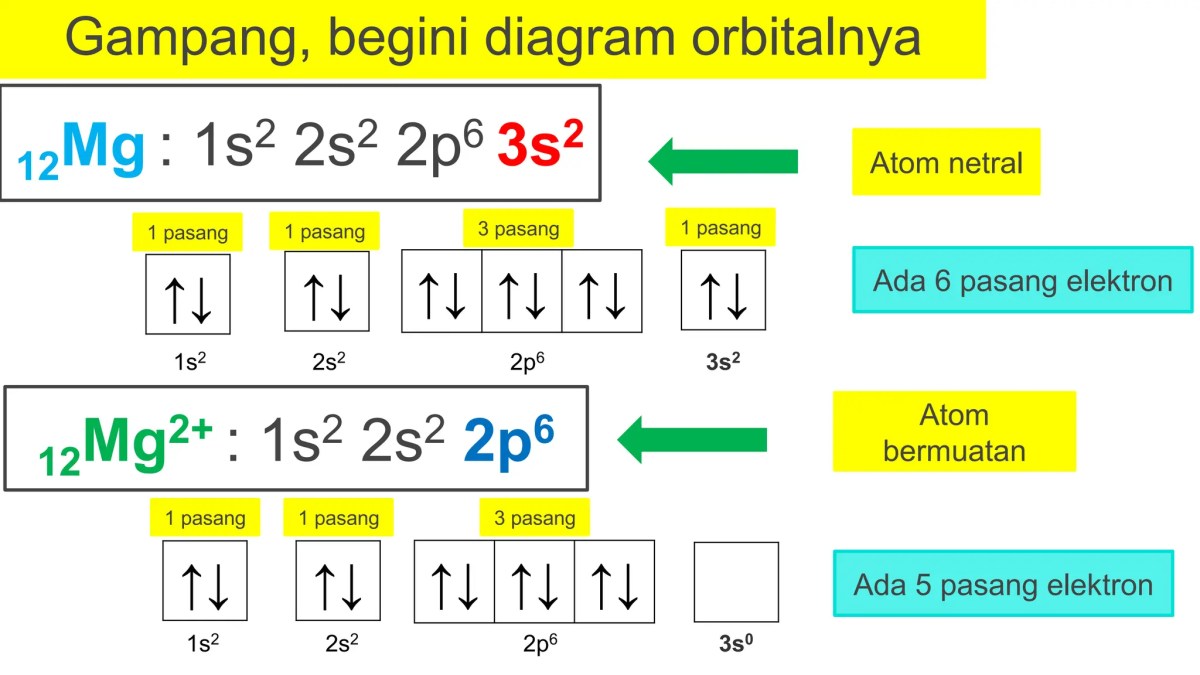
Perhatikan data energi ionisasi berturut-turut (pertama, kedua, ketiga, dst.) untuk Magnesium (Mg: [Ne] 3s²). Energi ionisasi pertama dan kedua relatif tidak terlalu tinggi. Namun, energi ionisasi ketiga melonjak drastis, mencapai nilai yang sangat besar. Lonjakan ini terjadi karena dua elektron pertama dilepas dari orbital 3s, tetapi elektron ketiga harus diambil dari konfigurasi gas mulia [Ne] yang sangat stabil. “Lompatan besar” ini adalah tanda eksperimental yang jelas bahwa kita telah berhasil menembus kulit valensi dan mulai mengusik elektron pada kulit dalam yang stabil.
Energi Ionisasi pada Logam Transisi
Logam transisi di periode yang sama umumnya memiliki energi ionisasi pertama yang relatif lebih tinggi dibandingkan logam golongan utama (seperti alkali dan alkali tanah). Alasannya kompleks, tapi bisa dianalisis secara sistematis. Pertama, setelah pengisian orbital s, elektron mulai mengisi orbital d yang lebih dalam. Elektron pada orbital d ini memberikan efek perisai (shielding) yang kurang efektif dibandingkan elektron pada orbital s atau p.
Akibatnya, muatan inti efektif yang dirasakan elektron terluar (di orbital s) lebih besar, sehingga ikatannya lebih kuat. Kedua, ukuran atom transisi lebih kecil karena kontraksi yang disebabkan oleh muatan inti yang meningkat. Kombinasi ukuran kecil dan muatan inti efektif besar inilah yang membuat melepas elektron pertama dari logam transisi (misalnya, Zink pada periode 4) lebih sulit daripada dari logam golongan utama di periode yang sama (misalnya, Kalsium).
Aplikasi dan Implikasi dalam Sifat Kimia
Konfigurasi elektron yang “enggan” melepaskan elektron punya dampak langsung yang bisa kita lihat di dunia nyata. Sifat kimia sebuah unsur sangat ditentukan oleh kemudahannya untuk memberi, menerima, atau berbagi elektron.
Gas mulia adalah contoh sempurna. Dengan energi ionisasi yang sangat tinggi dan konfigurasi stabil, mereka hampir tidak punya keinginan untuk bereaksi. Mereka inert, membuatnya ideal untuk pengisi balon (Helium) atau lampu neon (Neon, Argon). Sebaliknya, logam alkali di ujung lain spektrum, dengan energi ionisasi sangat rendah, sangat reaktif karena mudah melepaskan elektronnya.
Konsekuensi Energi Ionisasi Tinggi terhadap Sifat Lain
Energi ionisasi yang tinggi biasanya berjalan beriringan dengan sifat-sifat atomik lainnya. Berikut beberapa konsekuensinya:
- Afinitas Elektron: Unsur dengan energi ionisasi tinggi (seperti halogen) justru cenderung memiliki afinitas elektron yang tinggi pula. Mereka sulit melepas elektron, tapi sangat senang menerima elektron tambahan untuk mencapai konfigurasi stabil.
- Keelektronegatifan: Keelektronegatifan, yaitu kemampuan menarik elektron dalam ikatan, juga tinggi. Jika sebuah atom sulit melepas elektronnya sendiri, ia akan berusaha sekuat tenaga untuk menarik dan mengontrol elektron pasangan ikatannya.
- Jenis Ikatan Kimia: Pengetahuan ini menjadi kunci memprediksi ikatan. Unsur dengan energi ionisasi sangat rendah (logam) cenderung membentuk ikatan ionik dengan melepas elektron. Unsur dengan energi ionisasi tinggi dan afinitas elektron tinggi (non-logam) cenderung membentuk ikatan kovalen dengan berbagi elektron, atau menerima elektron membentuk ion negatif. Contoh, Natrium (energi ionisasi rendah) dan Klorin (energi ionisasi tinggi) bertemu, Natrium dengan mudah memberi elektron pada Klorin, terbentuklah ikatan ionik NaCl.
Visualisasi dan Representasi Data
Untuk benar-benar menghayati pola energi ionisasi, coba bayangkan sebuah grafik. Sumbu horizontal adalah nomor atom, dan sumbu vertikal adalah energi ionisasi pertama. Jika kita plot untuk unsur-unsur periode 2 (Li sampai Ne) dan periode 3 (Na sampai Ar), kita akan melihat pola bergerigi yang sangat informatif.
Grafik itu umumnya naik dari kiri ke kanan, tapi dengan beberapa “lengkungan” penting. Pada periode 2, akan ada puncak di Be (karena konfigurasi 2s²), kemudian turun sedikit di B (2p¹), naik lagi, lalu puncak tertinggi kedua di N (2p³), turun sedikit di O (2p⁴), naik lagi ke F, dan mencapai puncak absolut di Ne (2p⁶). Pola serupa terlihat di periode 3 dengan Mg (3s²), Al (3p¹), P (3p³), dan S (3p⁴).
Titik-titik penurunan kecil ini, yang dianotasi sebagai “pengecualian dari tren umum”, adalah bukti visual dari pengaruh kestabilan orbital penuh atau setengah penuh.
Perbandingan Golongan Alkali dan Gas Mulia
| Unsur (Golongan) | Konfigurasi Elektron Valensi | Jari-jari Atom (pm) | Energi Ionisasi Pertama (kJ/mol) |
|---|---|---|---|
| Lithium (Alkali) | [He] 2s¹ | 152 | 520 |
| Natrium (Alkali) | [Ne] 3s¹ | 186 | 496 |
| Kalium (Alkali) | [Ar] 4s¹ | 227 | 419 |
| Helium (Gas Mulia) | 1s² | 31 | 2372 |
| Neon (Gas Mulia) | [He] 2s² 2p⁶ | 38 | 2081 |
| Argon (Gas Mulia) | [Ne] 3s² 3p⁶ | 71 | 1521 |
Skema Konseptual Stabilitas Orbital Penuh
Bayangkan sebuah sistem yang tenang dan seimbang. Orbital penuh (s², p⁶, d¹⁰) atau setengah penuh (p³, d⁵) merepresentasikan sistem seperti itu. Elektron terdistribusi secara simetris, tolakan antar elektron minimal, dan energi sistemnya rendah. Untuk mengganggu keseimbangan ini—dengan cara mengambil satu elektron—kita harus memberikan energi ekstra yang besar untuk melawan kestabilan yang sudah mapan. Itulah sebabnya terjadi peningkatan energi ionisasi yang signifikan setelah konfigurasi stabil tercapai.
Skemanya sederhana: Kestabilan Konfigurasi → Keengganan untuk Berubah → Energi yang Diperlukan untuk Mengubah (Ionisasi) Menjadi Sangat Tinggi.
Ringkasan Terakhir: Konfigurasi Elektron Dengan Energi Ionisasi Tertinggi
Jadi, sudah jelas kan sekarang? Rahasia di balik energi ionisasi tertinggi itu terletak pada konfigurasi elektron yang sudah mencapai titik kenyamanan maksimal. Mereka itu seperti orang yang sudah menemukan zona nyaman terbaiknya, sehingga butuh usaha ekstra besar untuk mengusiknya. Pengetahuan ini bukan cuma teori belaka, tapi kunci untuk membongkar sifat kimia, meramalkan jenis ikatan, dan memahami kenapa dunia elemen bisa sedemikian beragam.
Mulailah dari sini, dan lihatlah tabel periodik dengan mata yang sama sekali baru.
Pertanyaan yang Kerap Ditanyakan
Apakah energi ionisasi tertinggi selalu dimiliki oleh gas mulia?
Secara umum, iya. Dalam setiap periode, gas mulia (Golongan 18) selalu memiliki energi ionisasi tertinggi karena konfigurasi elektron valensi ns²np⁶ yang sangat stabil. Helium, dengan konfigurasi 1s², memegang rekor energi ionisasi tertinggi absolut.
Mengapa dalam satu periode, Boron (B) memiliki energi ionisasi lebih rendah dari Berilium (Be), padahal nomor atomnya lebih besar?
Ini karena konfigurasi elektron valensi. Berilium (Be) memiliki konfigurasi penuh 2s², yang stabil. Boron (B) memiliki konfigurasi 2s²2p¹; elektron p yang pertama lebih mudah dilepas karena berada pada orbital dengan energi sedikit lebih tinggi dan terlindungi oleh elektron 2s yang lebih dalam (efek shielding).
Bagaimana konfigurasi elektron memengaruhi energi ionisasi kedua, ketiga, dan seterusnya?
Energi ionisasi berikutnya akan melonjak drastis setelah elektron dilepas dari kulit yang sudah stabil. Misalnya, Magnesium (Mg, [Ne]3s²). Energi ionisasi pertama untuk melepas satu elektron 3s relatif rendah. Namun, energi ionisasi kedua untuk melepas elektron 3s kedua jadi sangat tinggi karena akan meninggalkan konfigurasi gas mulia [Ne] yang stabil.
Apakah ada unsur non-gas mulia yang energi ionisasinya sangat tinggi mendekati gas mulia?
Ya, Nitrogen (N) adalah contohnya. Energi ionisasi pertamanya lebih tinggi daripada Oksigen (O) di sebelahnya. Ini karena Nitrogen memiliki konfigurasi setengah penuh yang stabil (2s²2p³), sementara Oksigen (2s²2p⁴) memiliki satu elektron berpasangan di orbital p yang mudah dilepas karena tolakan antar elektron.
Bagaimana aplikasi praktis pengetahuan tentang energi ionisasi tinggi dalam teknologi?
Pengetahuan ini crucial dalam desain material. Unsur dengan energi ionisasi tinggi seperti gas mulia digunakan dalam lingkungan inert untuk mencegah reaksi yang tidak diinginkan, seperti dalam pengelasan, pembuatan semikonduktor, atau bola lampu. Sifatnya yang sulit terionisasi juga dimanfaatkan dalam tabung discharge dan lampu neon.