Hitung mol zat terlarut pada larutan a dan b, terdengar seperti ritual rahasia para ahli kimia? Tenang, kita bongkar bersama-sama biar nggak bikin pusing. Bayangkan mol itu kayak ‘lusin’-nya dunia partikel, cuma skalanya gila-gilaan—sekitar 602 miliar triliun butir! Nah, kalau udah ngerti konsep dasarnya, menghitung mol di larutan A yang isinya garam atau larutan B yang manis-manis gula itu bakal semudah ngitung uang kembalian belanja.
Topik ini intinya adalah kunci utama buat menguasai segala hal di lab, dari bikin larutan sampai titrasi yang akurat. Kita akan jelajahi mulai dari pengertian mol yang nggak seseram namanya, bedain peran pelarut dan zat terlarut, sampai langkah detil ngitung mol di dua larutan contoh. Semua dikemas dengan contoh nyata dan analogi yang relate sama kehidupan sehari-hari, biar kamu makin pede ngadepin soal-soal kimia.
Pengertian Dasar dan Konsep Mol
Sebelum kita terjun ke perhitungan untuk larutan A dan B, ada baiknya kita sepakati dulu bahasanya. Dalam dunia kimia, ketika kita bicara tentang jumlah partikel—entah itu atom, molekul, atau ion—kita butuh satuan yang praktis. Bayangkan jika kamu harus menghitung butiran gula satu per satu untuk membuat segelas teh manis, pasti ribet banget. Nah, di sinilah peran si “mol” sebagai pahlawan penyelamat.
Mol adalah satuan jumlah zat, sama seperti lusin untuk telur atau rim untuk kertas. Bedanya, satu mol mewakili jumlah partikel yang sangat-sangat banyak, yaitu tepat 6.022 x 10²³ partikel. Angka sakti ini dikenal sebagai Bilangan Avogadro.
Untuk membuat konsep ini lebih nyata, mari kita bandingkan mol dengan satuan jumlah yang lebih familiar dalam kehidupan sehari-hari.
| Satuan | Benda yang Dihitung | Jumlah | Analog dalam Kimia |
|---|---|---|---|
| Lusin | Telur, Donat | 12 buah | Satuan untuk benda makroskopis. |
| Rim | Kertas | 500 lembar | Satuan untuk benda yang jumlahnya banyak. |
| Gross | Pensil, Bolpoin | 144 buah | Satuan khusus untuk barang dagang. |
| Mol | Atom, Molekul, Ion | 6.022 x 10²³ partikel | Satuan jumlah zat (untuk partikel mikroskopis). |
Contoh konkretnya, satu mol butiran beras (asumsi satu butir 0.025 gram) beratnya akan sekitar 1.5 x 10²² kilogram—jauh lebih berat dari seluruh populasi manusia di Bumi! Ini menunjukkan betapa mol digunakan untuk hal yang super kecil tapi jumlahnya luar biasa banyak. Untuk menghubungkan konsep abstrak ini dengan sesuatu yang bisa kita ukur di lab, kita gunakan massa molar. Massa molar adalah massa satu mol zat, satuannya gram per mol (g/mol), yang secara numerik sama dengan massa atom relatif (Ar) atau massa molekul relatif (Mr).
Rumus dasarnya: Jumlah mol (n) = Massa zat (gram) / Massa Molar (g/mol)
Jadi, jika kamu punya 58.5 gram garam dapur (NaCl, Mr=58.5), artinya kamu punya tepat satu mol senyawa NaCl, yang berisi 6.022 x 10²³ pasangan ion Na⁺ dan Cl⁻.
Komponen Larutan: Pelarut dan Zat Terlarut
Larutan itu seperti tim yang solid, terdiri dari dua pemain utama: pelarut (solvent) dan zat terlarut (solute). Pelarut adalah sang pahlawan yang jumlahnya lebih banyak, bertugas melarutkan dan menjadi ‘rumah’ bagi zat terlarut. Sementara zat terlarut adalah tamu yang terdispersi secara merata di dalam pelarut. Dalam kebanyakan percobaan di lab, air menjadi pelarut universal favorit, tapi tentu saja bukan satu-satunya.
Pemilihan pelarut dan sifat zat terlarut sangat memengaruhi karakter larutan. Berikut perbandingan beberapa pelarut dan zat terlarut umum.
| Pelarut Umum | Jenis Zat Terlarut | Contoh Larutan | Keterangan |
|---|---|---|---|
| Air (H₂O) | Garam (Ionik, seperti NaCl) | Air laut, larutan infus | Pelarut polar, melarutkan banyak zat ionik dan polar. |
| Etanol (C₂H₅OH) | Gula (Kovalen polar, seperti C₁₂H₂₂O₁₁) | Sirup obat, minuman beralkohol | Pelarut organik polar, baik untuk senyawa organik. |
| Aseton ((CH₃)₂CO) | Lemak/Lilin (Kovalen nonpolar) | Pembersih kutek, penghilang lemak | Pelarut organik nonpolar atau kurang polar. |
Kelarutan suatu zat tidak terjadi begitu saja. Faktor seperti sifat “like dissolves like” (polar larut dalam polar, nonpolar larut dalam nonpolar), suhu, dan tekanan sangat berpengaruh. Gula mudah larut dalam air panas, tapi minyak tidak, kan? Nah, setelah kita punya larutan, kita perlu tahu seberapa “kuat” atau “pekat” larutan itu. Di sinilah konsep konsentrasi, khususnya Molaritas (M), muncul.
Molaritas didefinisikan sebagai jumlah mol zat terlarut per liter larutan.
Molaritas (M) = Mol zat terlarut (n) / Volume larutan (V dalam Liter)
Konsep ini langsung mengaitkan jumlah mol zat terlarut dengan sesuatu yang mudah kita ukur di lab: volume larutan. Jadi, molaritas adalah jembatan antara dunia mikroskopis (mol) dan dunia makroskopis (liter).
Prosedur Perhitungan Mol Zat Terlarut: Hitung Mol Zat Terlarut Pada Larutan A Dan B
Setelah paham konsep dasarnya, sekarang kita masuk ke teknisnya: bagaimana sih cara menghitung mol zat terlarut itu? Tenang, nggak serumit yang dibayangkan. Prosedurnya bisa berbeda-beda tergantung data apa yang kamu punya di soal. Yang penting, kamu tahu jalan utamanya.
Menghitung Mol dari Massa dan Rumus Kimia
Ini adalah cara paling fundamental. Jika kamu diketahui massa suatu zat dan rumus kimianya, langkah-langkahnya sistematis dan jelas.
- Langkah 1: Tentukan massa molar (Mr) zat terlarut. Jumlahkan massa atom relatif (Ar) dari semua atom dalam rumus kimianya.
- Langkah 2: Catat massa zat yang diberikan dalam satuan gram (g).
- Langkah 3: Gunakan rumus dasar mol: n = massa (g) / Mr (g/mol).
- Langkah 4: Hitung dan nyatakan hasilnya dalam satuan mol (mol).
Menghitung Mol dari Volume dan Molaritas Larutan, Hitung mol zat terlarut pada larutan a dan b
Seringkali dalam soal, yang diketahui adalah konsentrasi larutan (Molaritas) dan volumenya. Ini justru lebih langsung karena rumus molaritas sudah melibatkan mol. Dari rumus M = n/V, kita bisa turunkan menjadi: n = M x V. Pastikan volume (V) dalam satuan liter! Misalnya, kamu punya 250 mL larutan HCl 0.1 M. Maka, V = 0.25 L, sehingga n(HCl) = 0.1 mol/L x 0.25 L = 0.025 mol.
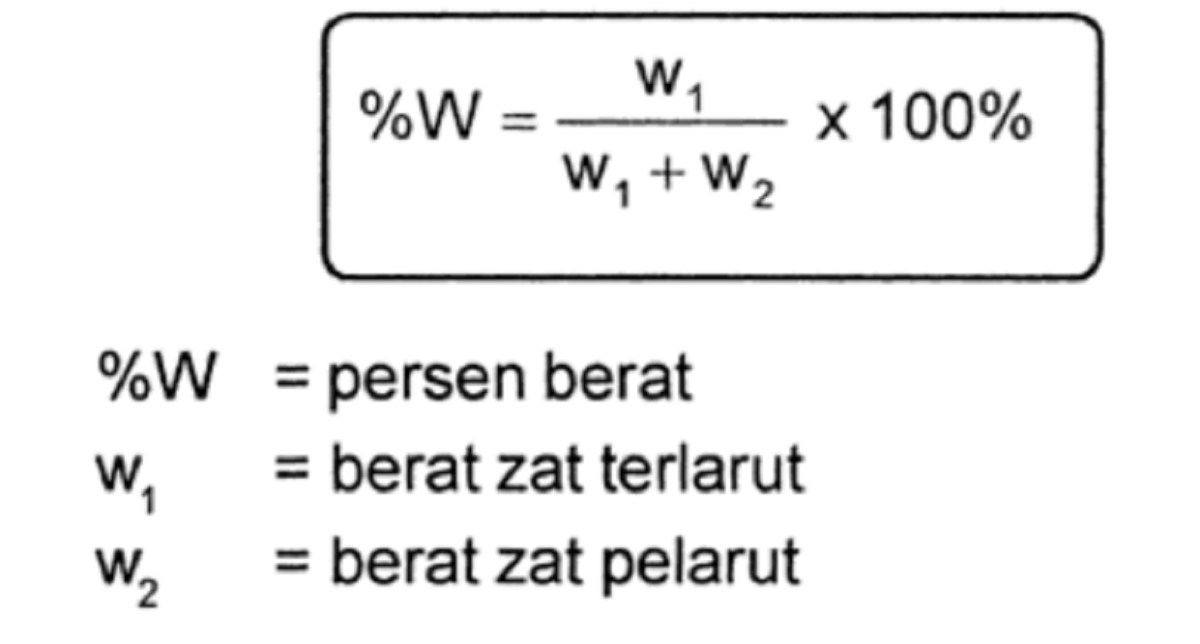
Menangani Data Persen Massa dan Densitas
Kadang soal memberikan data berupa persen massa (% m/m) dan densitas (massa jenis, ρ) larutan. Jangan panik. Misal: larutan H₂SO₄ 98% dengan densitas 1.84 g/mL. Untuk menghitung mol dalam volume tertentu (misal 1 L), ikuti alur ini: Hitung massa larutan (ρ x V = 1.84 g/mL x 1000 mL = 1840 g). Lalu, hitung massa H₂SO₄ murni (98% x 1840 g = 1803.2 g).
Terakhir, hitung mol H₂SO₄ dengan membagi massa tersebut dengan Mr H₂SO₄ (98 g/mol), hasilnya sekitar 18.4 mol. Intinya, konversi semua data ke massa zat murni terlebih dahulu, baru cari mol.
Studi Kasus: Analisis Larutan A dan B
Source: co.id
Sekarang, mari kita praktikkan ilmu kita untuk menganalisis dua larutan hipotetis. Bayangkan ini adalah dua sampel yang harus kamu analisis di laboratorium. Data lengkapnya dirangkum dalam tabel berikut.
| Parameter | Larutan A (NaCl) | Larutan B (C₆H₁₂O₆/Glukosa) |
|---|---|---|
| Rumus Kimia Zat Terlarut | NaCl | C₆H₁₂O₆ |
| Massa Molar (Mr) | 58.5 g/mol | 180 g/mol |
| Massa Zat Terlarut | 11.7 gram | 36 gram |
| Volume Larutan Akhir | 500 mL (0.5 L) | 2 L |
| Konsentrasi (Molaritas) | ? M | 0.1 M |
Mari kita hitung mol zat terlarut pada masing-masing larutan. Untuk Larutan A, kita gunakan data massa. n(NaCl) = massa / Mr = 11.7 g / 58.5 g/mol = 0.2 mol. Untuk Larutan B, kita gunakan data molaritas dan volume. n(Glukosa) = M x V = 0.1 mol/L x 2 L = 0.2 mol.
Ternyata menarik, meskipun massa, volume, dan jenis zatnya berbeda, jumlah mol zat terlarutnya sama. Perbedaan mendasarnya terletak pada bagaimana konsentrasi itu dicapai.
Larutan A mencapai 0.2 mol dalam volume yang lebih kecil (0.5 L) karena massa molar NaCl yang relatif kecil, sehingga untuk massa 11.7 gram sudah menghasilkan mol yang signifikan. Sementara Larutan B membutuhkan volume yang lebih besar (2 L) dengan konsentrasi yang lebih encer (0.1 M) untuk mencapai jumlah mol yang sama, karena massa molar glukosa yang lebih besar. Ini menunjukkan bahwa mol adalah ukuran jumlah partikel yang independen terhadap sifat fisik larutan seperti volume total.
Bagaimana jika datanya divariasi? Misal, volume Larutan B diubah menjadi 500 mL (0.5 L) sementara molaritas tetap 0.1 M. Maka, mol glukosa yang baru adalah n = 0.1 M x 0.5 L = 0.05 mol. Atau, jika massa Larutan A dilipatgandakan menjadi 23.4 gram, maka mol NaCl-nya menjadi 0.4 mol. Coba kamu hitung ulang molaritas Larutan A dari data awal, pasti hasilnya 0.4 M (n=0.2 mol, V=0.5 L).
Visualisasi dan Aplikasi dalam Percobaan
Teori tanpa praktek ibarat kopi tanpa gula, kurang greget. Dalam praktek lab, perhitungan mol ini diwujudkan dalam tindakan nyata. Bayangkan sebuah ilustrasi: Seorang praktikan berdiri di depan timbangan analitis. Dia menempatkan kaca arloji bersih, lalu menaruh kristal NaCl putih di atasnya hingga tepat terbaca 5.85 gram. Kristal itu kemudian dituang secara hati-hati melalui corong kaca ke dalam labu ukur 1 liter yang setengahnya terisi air destilasi.
Setelah dibilas, labu diisi air hingga garis tanda (meniskus bawah tepat sejajar dengan garis). Proses pengocokan yang lembut dilakukan hingga semua kristal larut sempurna. Hasilnya adalah 1 liter larutan NaCl 0.1 M. Setiap 1 mL larutan ini mengandung 5.85 x 10⁻⁴ gram NaCl, atau setara dengan 0.00001 mol.
Untuk ritual sakral ini, beberapa alat laboratorium adalah wajib hukumnya:
- Timbangan Analitis: Sang penentu kepastian massa dengan ketelitian hingga 0.0001 gram.
- Labu Ukur (Volumetric Flask): Sang penjamin volume akhir yang presisi, dilengkapi garis tanda dan tutup.
- Gelas Kimia dan Corong: Untuk membantu proses pelarutan awal dan transfer.
- Pipet Volumetrik dan Buret: Untuk mengambil dan mengeluarkan volume larutan dengan tepat, terutama dalam titrasi.
Ketepatan perhitungan mol bukan sekadar masalah nilai di kertas. Ini urusan keselamatan dan keberhasilan. Kesalahan menghitung mol asam kuat, misalnya, bisa menghasilkan larutan yang jauh lebih korosif dari yang direncanakan, berisiko merusak alat dan membahayakan diri. Dalam sintesis kimia, kesalahan mol bisa menyebabkan bahan berharga terbuang karena reaksi tidak sempurna atau menghasilkan produk samping yang tidak diinginkan.
Aplikasi langsung yang paling klasik adalah dalam titrasi asam-basa. Di sini, kita menggunakan pengetahuan tentang mol untuk mencari konsentrasi suatu larutan yang tidak diketahui. Prinsipnya sederhana: pada titik ekuivalen, mol asam sama dengan mol basa (untuk reaksi 1:1). Jika kita tahu konsentrasi dan volume larutan standar (misal NaOH) yang digunakan untuk mentitrasi asam (misal HCl) sampai habis, kita bisa menghitung mol NaOH yang dipakai (n = M x V).
Mol HCl pasti sama, sehingga konsentrasi HCl yang awalnya misterius pun terungkap. Semua bermuara dari pemahaman yang kuat tentang si “mol” ini.
Penutup
Jadi, gimana? Sudah terbayang kan betapa menghitung mol zat terlarut itu bukan cuma sekadar angka di kertas, tapi fondasi untuk eksperimen yang sukses dan aman. Dari larutan A ke larutan B, dari garam dapur sampai glukosa, kemampuan ini bakal bikin kamu lebih jago ‘memasak’ di laboratorium. Ingat, ketelitian sedikit saja bisa bedakan antara hasil yang valid dan larutan yang harus dibuang.
Yuk, langsung praktikkan dan rasakan sendiri sensasi jadi master konsentrasi!
FAQ Lengkap
Apa bedanya mol dengan molaritas?
Mol adalah satuan jumlah zat (seperti lusin), sedangkan molaritas (M) adalah konsentrasi yang menyatakan berapa mol zat terlarut dalam setiap liter larutan. Mol itu jumlahnya, molaritas itu kerapatannya dalam larutan.
Bagaimana jika zat terlarutnya berupa campuran, bukan senyawa murni?
Perhitungan mol untuk campuran lebih kompleks. Biasanya yang dihitung adalah mol dari masing-masing komponen murni. Untuk campuran, data yang dibutuhkan bisa komposisi persen massa masing-masing zat dan massa molar masing-masing.
Apakah perhitungan mol sama untuk zat padat, cair, dan gas dalam larutan?
Oke, ngitung mol zat terlarut di larutan A dan B itu sebenarnya kunci biar kita paham konsentrasi. Tapi, kayak memahami budaya, kita butuh contoh konkret untuk bisa mengapresiasi kompleksitasnya. Nah, kalau mau lihat bagaimana unsur-unsur itu berpadu, cek aja Contoh Unsur Kebudayaan yang lengkap banget. Mirip kayak ngulik mol, memahami unsur budaya juga butuh ketelitian dan data yang akurat biar analisisnya nggak meleset.
Jadi, fokus lagi ke perhitunganmu, ya!
Prinsip dasarnya sama: mol = massa / massa molar. Namun, untuk zat terlarut cair, kadang lebih mudah menggunakan data densitas (massa jenis) dan volume untuk mencari massanya terlebih dahulu sebelum menghitung mol.
Kenapa harus pakai labu ukur, tidak bisa gelas beker saja untuk membuat larutan?
Labu ukur memiliki leher yang ramping dan tanda batas yang sangat presisi, sehingga volume larutan bisa diatur tepat sampai garis tanda. Gelas beker memiliki ketelitian volume yang rendah, sehingga tidak akurat untuk membuat larutan dengan konsentrasi pasti.
Nah, ngitung mol zat terlarut di larutan A dan B itu dasarnya paham konsep konsentrasi dan volume, guys. Sama kayak pentingnya paham beda satuan luas dan volume, misalnya saat kamu perlu Konversi 80 meter persegi ke meter kubik buat proyek tertentu. Pemahaman konversi satuan yang bener itu ngebantu banget, lho, biar perhitungan mol dan molaritas kamu nggak salah kaprah dan hasilnya akurat.
Bagaimana cara mengetahui massa molar suatu senyawa yang rumusnya belum hafal?
Massa molar dihitung dari penjumlahan massa atom relatif (Ar) setiap unsur dalam rumus kimia, yang bisa dilihat di Tabel Periodik. Misal, H2O: (2xAr H) + (1xAr O) = (2×1) + 16 = 18 g/mol.


