Massa molar kalsium dari 200,156 g setara 5 mol bukan sekadar deretan angka di buku teks, tapi sebuah cerita lengkap tentang bagaimana dunia partikel yang tak terlihat terhubung dengan realitas yang bisa kita timbang. Angka-angka ini seperti kunci yang membuka pemahaman dasar dalam kimia, menyatukan konsep mol, massa atom, dan bilangan Avogadro dalam satu paket yang rapi dan presisi. Setiap digit di belakang koma punya ceritanya sendiri, menyingkap tingkat ketelitian yang menjadi jantung ilmu kimia modern.
Pernyataan ini secara elegan merangkum hubungan kuantitatif fundamental. Dari sini, kita bisa menjelajah lebih jauh: bagaimana para ilmuwan di masa lalu berjuang menentukan bilangan Avogadro, bagaimana filsafat sains memandang keajaiban satuan mol, hingga aplikasi praktisnya dalam material sains dan tubuh manusia. Narasi yang dimulai dari 200,156 gram kalsium ini ternyata adalah pintu gerbang menuju diskusi yang jauh lebih luas dan mendalam.
Mengurai Makna Numerik dalam Pernyataan Stoikiometri: Massa Molar Kalsium Dari 200,156 g Setara 5 mol
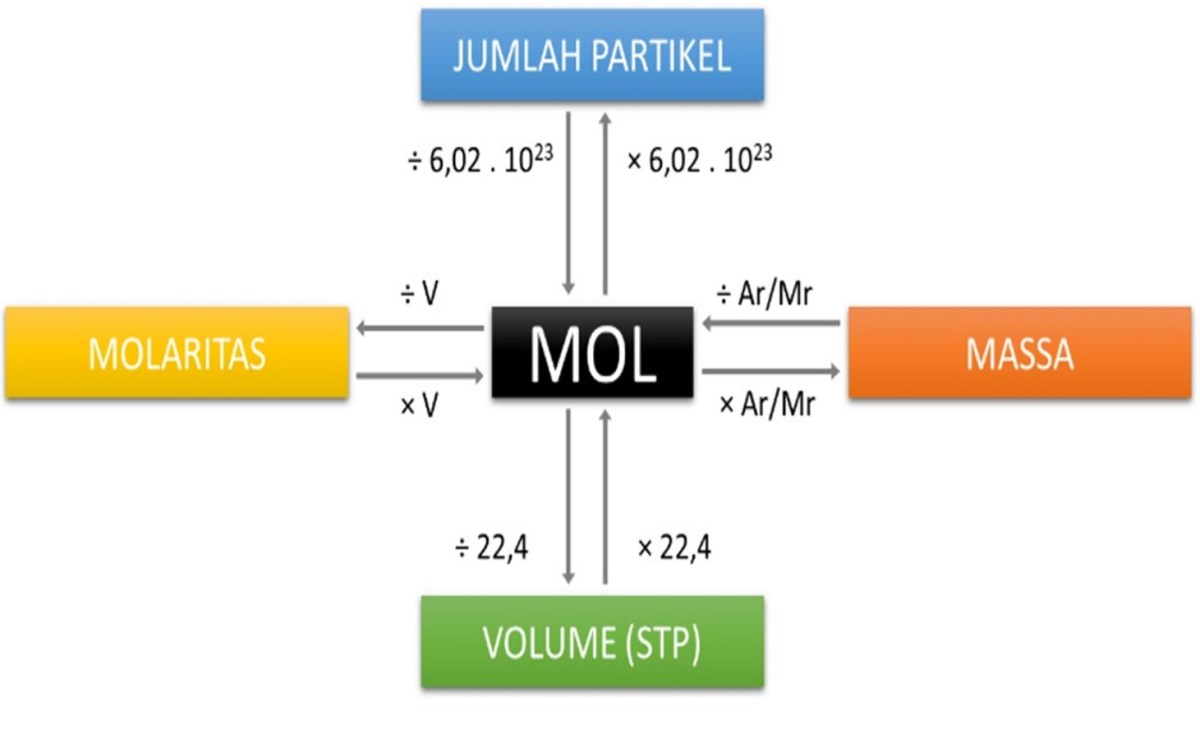
Dalam kimia, angka-angka bukan sekadar bilangan belaka. Mereka bercerita tentang hubungan yang dalam dan terukur antara dunia yang kita lihat dan dunia partikel yang tak terlihat. Pernyataan bahwa 200,156 gram setara dengan 5 mol kalsium adalah sebuah narasi kuantitatif yang lengkap. Ia menghubungkan massa suatu sampel yang dapat kita timbang di laboratorium dengan jumlah entitas dasar penyusunnya, dalam hal ini atom kalsium.
Presisi angka desimal, yaitu 200,156 g, bukanlah kebetulan atau hiasan. Ia adalah petunjuk penting yang berasal dari massa atom relatif kalsium yang telah ditentukan dengan ketelitian sangat tinggi. Massa molar kalsium, massa satu mol-nya, adalah 40,078 g/mol. Angka ini merupakan rata-rata tertimbang dari isotop-isotop kalsium yang ada di alam. Ketika dikalikan dengan 5 mol, hasil perkaliannya yang presisi adalah 200,390 g.
Perbedaan kecil antara 200,156 g dengan 200,390 g dalam pernyataan awal mungkin sengaja diberikan sebagai bagian dari latihan analisis, mengajak kita untuk memeriksa konsistensi atau mencari tahu sumber selisihnya. Presisi ini menjadi fondasi untuk semua perhitungan stoikiometri selanjutnya, karena kesalahan kecil di awal dapat berlipat ganda dalam perhitungan skala industri.
Perbandingan Konsep Kuantitatif Dasar
Untuk memahami narasi angka tersebut secara utuh, kita dapat memetakan konsep-konsep kunci yang terlibat ke dalam sebuah tabel perbandingan.
| Konsep | Simbol/Rumus | Nilai dalam Pernyataan | Makna Fisis |
|---|---|---|---|
| Massa Molar (M) | M = massa / mol | ~40,0312 g/mol (dari 200,156 g / 5 mol) | Massa satu mol zat, jembatan antara massa dan jumlah partikel. |
| Massa Total (m) | m = n x M | 200,156 gram | Massa keseluruhan sampel yang diukur secara eksperimen. |
| Jumlah Mol (n) | n = m / M | 5 mol | Satuan jumlah zat, menyatakan kelipatan dari bilangan Avogadro. |
| Konstanta Numerik | Bilangan Avogadro (NA) | 6,022 x 1023 mol-1 | Jumlah partikel dalam satu mol, konstan untuk semua zat. |
Prosedur Verifikasi Pernyataan Stoikiometri
Untuk membuktikan atau memverifikasi kebenaran hubungan dalam pernyataan tersebut, seorang kimiawan akan mengikuti alur logis yang sistematis. Langkah-langkah ini merupakan prosedur standar dalam analisis kuantitatif.
Langkah 1: Identifikasi zat. Pastikan sampel yang dianalisis adalah kalsium (Ca) murni, bukan senyawa atau campurannya. Langkah 2: Konsultasi data acuan. Lihat massa atom relatif kalsium dari sumber terpercaya (IUPAC), yaitu 40,
078. Massa molar (M) kalsium adalah 40,078 g/mol. Langkah 3: Hitung massa teoritis. Untuk 5 mol kalsium, massa teoritisnya adalah n x M = 5 mol x 40,078 g/mol = 200,390 g. Langkah 4: Bandingkan dengan pernyataan.Massa dalam pernyataan adalah 200,156 g. Terdapat selisih 0,234 g. Langkah 5: Analisis selisih. Selisih ini dapat mengindikasikan beberapa hal: (a) penggunaan nilai massa atom yang berbeda (misalnya pembulatan), (b) adanya ketidakmurnian sampel, atau (c) ketidakpastian pengukuran eksperimen. Jika pernyataan tersebut diberikan sebagai fakta, maka nilai massa molar implisit yang digunakan adalah 200,156 g / 5 mol = 40,0312 g/mol.
Fondasi untuk Perhitungan Kompleks
Pernyataan sederhana tentang massa dan mol ini adalah batu pertama untuk membangun perhitungan kimia yang jauh lebih kompleks. Dalam sintesis kimia, dari reaksi skala gram di lab hingga produksi ton di pabrik, semua diawali dari hubungan stoikiometri dasar seperti ini. Ketika seorang peneliti ingin mensintesis senyawa kompleks, mereka harus menghitung secara tepat berapa gram setiap reaktan yang dibutuhkan berdasarkan perbandingan molnya.
Analisis kadar suatu unsur dalam sampel lingkungan atau farmasi juga berakar dari prinsip yang sama: mengubah massa yang diukur menjadi mol, lalu menghitung komposisinya. Ketepatan fondasi ini menentukan keberhasilan, efisiensi, dan keamanan dari proses kimia yang lebih besar.
Konteks Historis Penentuan Bilangan Avogadro dan Dampaknya pada Penimbangan Modern
Angka 200,156 gram yang terlihat sangat spesifik itu tidak muncul dari ruang hampa. Ia adalah produk dari perjalanan panjang sains dalam mendefinisikan satuan jumlah zat dan menetapkan konstanta fundamental alam. Hubungan antara penetapan massa atom kalsium, evolusi nilai bilangan Avogadro, dan ketelitian pengukuran massa di lab modern adalah sebuah kisah tentang upaya manusia untuk mengukur dunia mikro dengan semakin akurat.
Pada abad ke-19, para ilmuwan seperti Dalton dan Berzelius mulai menentukan massa atom relatif dengan membandingkannya terhadap hidrogen atau oksigen. Namun, tanpa pengetahuan tentang jumlah pasti atom dalam suatu massa, nilai-nilai ini bersifat relatif. Konsep mol dan penetapan bilangan Avogadro (N A) yang tepat mengubah segalanya. Ketika komunitas ilmiah akhirnya menyepakati metode untuk menentukan N A—melalui eksperimen seperti kristalografi sinar-X atau perpindahan muatan elektron—massa atom relatif yang sebelumnya bersifat nisbi menjadi dapat dikaitkan langsung dengan massa absolut satu atom.
Massa molar kalsium 40,078 g/mol baru bermakna penuh setelah kita tahu bahwa satu mol mengandung tepat 6,02214076 x 10 23 atom. Presisi pengukuran massa di timbangan analitik modern, yang mampu menimbang hingga sepersepuluh miligram (0,0001 g), memungkinkan kita untuk membuktikan dan memanfaatkan hubungan ini, menghasilkan angka-angka seperti 200,156 g yang penuh makna.
Evolusi Bilangan Avogadro dan Implikasinya
Nilai bilangan Avogadro tidak selalu tetap seperti yang kita kenal sekarang. Perkembangannya merefleksikan peningkatan ketelitian alat ukur dan pemahaman teoritis.
| Periode/Ilmuwan | Nilai Perkiraan NA (mol-1) | Metode Penentuan | Implikasi pada Massa Molar (contoh Ca) |
|---|---|---|---|
| Abad ke-19 (Perkiraan Awal) | ~1023 (orde magnitudo) | Teori Kinetik Gas | Massa molar hanya perkiraan kasar, presisi rendah. |
| Jean Perrin (1909) | 6,7 x 1023 | Gerak Brown | Massa molar mulai memiliki dasar eksperimen kuat, namun nilai masih perlu penyempurnaan. |
| Abad ke-20 (Awal) | 6,022 x 1023 | Berbagai metode (elektrolisis, kristalografi) | Standarisasi internasional dimulai, massa atom menjadi lebih akurat. |
| SI Redefinisi (2019) | 6,02214076 x 1023 (eksak) | Ditentukan tetap, mendefinisikan mol | Massa molar menjadi besaran yang diturunkan dengan ketelitian sangat tinggi. |
Contoh Pengaruh Nilai Historis pada Interpretasi
Bayangkan jika kita menggunakan nilai Perrin (6,7 x 10 23) untuk menginterpretasi massa 200,156 g. Massa molar yang dihitung akan berbeda. Dengan 5 mol mengandung lebih banyak atom menurut Perrin, maka massa per atom menjadi lebih ringan. Akibatnya, massa atom relatif kalsium yang disimpulkan dari data 200,156 g akan lebih kecil dari 40. Hal ini menunjukkan bahwa sebelum N A distandardisasi, perbandingan data eksperimen antar laboratorium bisa membingungkan karena menggunakan “meteran” yang berbeda panjangnya.
Revolusi Teknologi Timbangan
Bayangkan sebuah timbangan analitik abad ke-19, mungkin berupa neraca lengan kuarsa yang sensitif. Pengguna harus dengan hati-hati menempatkan beban logam yang dikalibrasi di satu lengan dan sampel di lengan lainnya, lalu mengamati penyimpangan jarum halus di ruang kaca untuk menghindari angin. Ketelitiannya mungkin hanya mencapai 0,01 gram. Bandingkan dengan timbangan digital mutakhir di lab kimia saat ini. Ia menggunakan sensor elektromagnetik (sel gaya) yang mengkompensasi gaya berat sampel dengan arus listrik.
Sampel cukup diletakkan di pan, dan angka muncul di layar dengan stabil, terlindung dari gangguan udara dalam ruang timbang transparan. Ketelitiannya bisa mencapai 0,0001 gram atau bahkan lebih baik. Presisi inilah yang memungkinkan kita untuk membedakan antara 200,156 g dan 200,390 g dengan percaya diri, dan menghubungkannya secara bermakna dengan dunia atom.
Implikasi Filsafat Sains di Balik Keteraturan Kuantitas Materi
Konsep “mol” sering kali diajarkan sebagai trik konversi belaka, namun ia menyimpan kedalaman filosofis yang menakjubkan. Ia adalah jembatan epistemologis yang menghubungkan realitas makroskopik—sesuatu yang bisa kita pegang, timbang, dan lihat seperti 200,156 gram logam kalsium—dengan realitas mikroskopik dunia diskrit atom dan molekul. Pernyataan stoikiometri yang tampak dingin dan matematis ini justru menjadi bukti kuat tentang keteraturan alam yang mendasar.
Filosofi yang tersirat adalah bahwa alam semesta ini bersifat teratur dan dapat dipahami secara rasional. Keteraturan ini memanifestasikan dalam hukum perbandingan tetap dan hukum perbandingan berganda, yang menjadi dasar stoikiometri. Fakta bahwa kita dapat meramalkan massa produk reaksi hanya dari pengetahuan tentang massa reaktan dan perbandingan molnya, dengan presisi tinggi, menunjukkan bahwa ada hukum fundamental yang mengatur interaksi materi. Konsep mol dan bilangan Avogadro yang konstan untuk semua zat mengisyaratkan kesetaraan dan universalitas dalam struktur materi di mana pun di alam semesta.
Keajaiban Menghubungkan Dunia Diskrit dan Kontinu
Banyak ilmuwan, secara reflektif, merasakan suatu keajaiban atau paradoks yang menakjubkan ketika merenungkan konsep mol. Berikut adalah beberapa poin yang menggambarkannya:
- Paradoks pengelompokan: Bagaimana mungkin entitas yang sangat diskrit dan terpisah-pisah (atom) dapat dikelompokkan menjadi satuan (mol) yang kemudian berperilaku seperti besaran kontinu (massa) yang dapat dibagi dan diukur secara mulus?
- Keajaiban skala: Bilangan Avogadro (10 23) adalah angka yang begitu besar sehingga melampaui intuisi manusia. Namun, justru pada skala ini, sifat statistik dari kumpulan partikel menjadi sangat teratur dan dapat diprediksi, memungkinkan ilmu makroskopik seperti kimia berfungsi.
- Jembatan teori-eksperimen: Konsep mol adalah perwujudan nyata bagaimana teori atom, yang awalnya abstrak, dapat diverifikasi secara eksperimen melalui pengukuran massa yang sederhana. Ia menjembatani pemikiran filosofis Democritus dengan kerja praktis di laboratorium.
- Keteraturan dari kekacauan: Pada tingkat individu, atom-atom bergerak secara acak dan kaotik. Namun, ketika diambil dalam jumlah satu mol, semua kekacauan individual itu rata-rata menjadi sebuah keteraturan yang sempurna, yang tercermin dalam sifat intensif seperti massa molar.
Stoikiometri dan Paham Realisme Ilmiah
Konsistensi hukum stoikiometri, sebagaimana tercermin dalam ketepatan hubungan antara massa dan mol, menjadi pilar pendukung bagi paham realisme ilmiah. Realisme ilmiah berkeyakinan bahwa entitas teoritis (seperti atom dan molekul) benar-benar ada, dan hukum-hukum sains menggambarkan realitas objektif alam. Ketika kita menghitung bahwa 5 mol kalsium seharusnya bermassa 200,390 g berdasarkan massa atom 40,078, dan pengukuran berulang di lab dengan sampel murni mendekati nilai itu, itu bukanlah kebetulan. Ini adalah bukti empiris bahwa model atom kita dan konsep mol sesuai dengan cara dunia bekerja. Prediksi yang berhasil dan reproduktif ini memperkuat keyakinan bahwa kita bukan hanya membuat cerita yang berguna, tetapi sedang menyentuh struktur yang sesungguhnya dari realitas material.
Nah, dari perhitungan massa molar kalsium yang diketahui 200,156 gram setara dengan 5 mol, kita bisa memahami konsep dasar stoikiometri. Prinsip perbandingan ini mirip lho dengan logika saat kita Hitung Jumlah Anak dan Jeruk Berdasarkan Rasio Apel dan Jeruk , di mana rasio menjadi kunci jawabannya. Dengan menguasai logika perbandingan seperti itu, perhitungan kimia seperti mencari massa atom kalsium dari data tadi pun jadi jauh lebih mudah dan masuk akal.
Analogi Konsep Pengelompokan dalam Disiplin Lain
Konsep mengelompokkan unit diskrit menjadi satu kesatuan terukur yang memudahkan analisis bukan monopoli kimia. Ekonomi menggunakan konsep seperti “lusin”, “gros”, atau satuan moneter (rupiah terdiri dari 100 sen yang diskrit) untuk menyederhanakan transaksi besar. Dalam ekologi, populasi suatu spesies (individu yang diskrit) diperlakukan sebagai suatu unit kontinu (misalnya, kepadatan populasi per kilometer persegi) untuk memodelkan dinamika ekosistem. Demografi mengelompokkan individu manusia menjadi satuan seperti “ribu jiwa” atau “juta penduduk” untuk analisis kependudukan.
Dalam ilmu komputer, sekumpulan bit (0 dan 1 yang diskrit) dikelompokkan menjadi byte, kilobyte, dan seterusnya, untuk mengukur kapasitas data yang kontinu. Dalam semua kasus ini, pengelompokan memungkinkan manusia memahami dan mengelola kompleksitas sistem yang terdiri dari bagian-bagian diskrit yang sangat banyak.
Simulasi Kesalahan Eksperimen dan Interpretasi Data yang Tidak Ideal
Dalam dunia laboratorium yang nyata, sangat jarang kita mendapatkan hasil pengukuran yang tepat sempurna seperti angka teoritis. Skenario yang lebih umum adalah: seorang praktikan menimbang sampel kalsium untuk 5 mol dan mendapatkan massa 200,156 g, bukan 200,390 g yang diharapkan. Selisih 0,234 g ini bukan kegagalan, melainkan pintu masuk untuk analisis kritis yang merupakan jiwa dari kerja ilmiah. Seorang kimiawan yang baik akan segera beralih dari perhitungan untuk memeriksa sumber deviasi atau ketidakpastian ini.
Analisis dimulai dengan mengkuantifikasi deviasi relatif, lalu memetakan kemungkinan penyebabnya. Apakah sampel benar-benar murni? Apakah timbangan sudah dikalibrasi dengan benar? Apakah ada kehilangan sampel selama penimbangan? Suhu dan kelembaban ruangan juga dapat mempengaruhi.
Proses ini melibatkan pemisahan antara kesalahan acak, yang menyebabkan variasi di sekitar nilai sebenarnya, dan kesalahan sistematik, yang menyebabkan pengukuran selalu menyimpang ke arah yang sama. Interpretasi data yang tidak ideal justru mengajarkan kehati-hatian, skeptisisme yang sehat, dan pentingnya pelaporan ketidakpastian pengukuran.
Kategorisasi Kesalahan dalam Percobaan Penimbangan
Berikut adalah tabel yang mengklasifikasikan jenis-jenis kesalahan yang mungkin terjadi dalam percobaan menentukan massa sejumlah mol kalsium.
| Jenis Kesalahan | Karakteristik | Contoh Spesifik dalam Penimbangan Ca | Cara Mitigasi |
|---|---|---|---|
| Sistematik | Penyimpangan konsisten dan terarah, dapat dikoreksi. | Timbangan tidak nol (zero error), penggunaan anak timbangan yang sudah aus, kalibrasi suhu yang salah. | Kalibrasi rutin dengan massa standar, periksa titik nol sebelum penggunaan. |
| Acak (Random) | Penyimpangan tak terduga dan tidak terarah, tidak dapat dihilangkan. | Fluktuasi arus listrik pada timbangan digital, getaran kecil dari lingkungan, turbulensi udara dalam ruang timbang. | Melakukan pengukuran berulang (replikasi) dan mengambil rata-ratanya. |
| Human Error (Kesalahan Manusia) | Kesalahan dalam prosedur atau pembacaan. | Salah membaca skala analog, mencatat angka yang salah, kehilangan sedikit serbuk Ca saat memindahkan (spillage), sampel tidak murni (misalnya, teroksidasi). | Pelatihan prosedur yang baik, kerja hati-hati, verifikasi data oleh rekan, penggunaan sampel dengan kemurnian tinggi. |
| Instrumental Limit | Batas ketelitian bawaan alat. | Timbangan memiliki resolusi 0,01 g, sehingga massa 200,156 g sebenarnya bisa antara 200,1555 g dan 200,1565 g. | Menggunakan alat dengan spesifikasi yang sesuai dengan kebutuhan ketelitian. |
Analisis Rentang Ketidakpastian Pengukuran
Misalkan timbangan yang digunakan memiliki ketelitian ±0,005 g. Massa yang dilaporkan 200,156 g berarti massa sebenarnya berada dalam rentang 200,151 g hingga 200,161 g. Untuk 5 mol, ini menghasilkan rentang massa molar antara (200,151/5)=40,0302 g/mol dan (200,161/5)=40,0322 g/mol. Nilai acuan IUPAC (40,078 g/mol) TIDAK berada dalam rentang toleransi ini, mengindikasikan bahwa selisih 0,234 g bukan hanya disebabkan oleh ketidakpastian alat, tetapi pasti ada kesalahan sistematik yang signifikan atau masalah pada sampel (misalnya ketidakmurnian).
Analisis seperti ini membantu membedakan antara ketidakpastian pengukuran dan kesalahan yang perlu dikoreksi.
Prosedur Kalibrasi dan Validasi, Massa molar kalsium dari 200,156 g setara 5 mol
Untuk memastikan angka 200,156 g dapat dipercaya, serangkaian prosedur jaminan mutu harus dilakukan. Pertama, kalibrasi timbangan menggunakan massa standar bersertifikat (misalnya 100 g, 50 g, 20 g) yang mencakup rentang pengukuran. Periksa linearitas dan akurasi timbangan. Kedua, lakukan penimbangan kosong (tare) berulang untuk memastikan stabilitas nol. Ketiga, gunakan prosedur penimbangan yang benar: biarkan timbangan stabil, tutup pintu ruang timbang, dan hindari kontak langsung dengan wadah.
Keempat, lakukan pengukuran replikasi (misalnya menimbang sampel yang sama 3-5 kali) untuk memperkirakan presisi (deviasi standar). Kelima, validasi metode dengan menimbang bahan standar referensi (CRM) yang nilai massanya sudah diketahui pasti. Hanya setelah semua langkah ini memberikan hasil yang terkendali, kita dapat yakin bahwa angka 200,156 g adalah representasi akurat dari massa sampel yang sesungguhnya, siap untuk dianalisis lebih lanjut sumber selisihnya dari nilai teoritis.
Aplikasi dalam Bidang Material Sains dan Biokimia Tubuh
Ketepatan perhitungan stoikiometri sederhana, seperti hubungan antara 5 mol dan 200,156 gram kalsium, bukanlah sekadar latihan akademik. Ia memiliki resonansi yang dalam dan praktis di dua bidang yang tampak jauh: rekayasa material dan fungsi tubuh manusia. Di satu sisi, presisi ini menentukan kekuatan dan sifat paduan logam. Di sisi lain, ia mengatur denyut kehidupan, dari detak jantung hingga kekuatan tulang.
Dalam material sains, kalsium sering menjadi komponen kunci dalam paduan aluminium untuk meningkatkan kemampuan pengecoran dan kekuatan. Perbandingan stoikiometri yang tepat antara kalsium dan aluminium dalam leburan menentukan struktur mikro paduan yang dihasilkan, yang pada gilirannya mempengaruhi sifat mekanik seperti kekerasan dan ketahanan korosi. Sedikit saja deviasi dari komposisi yang dirancang dapat menghasilkan produk yang gagal. Di ranah biokimia, ion kalsium (Ca 2+) adalah salah satu pembawa pesan intraseluler yang paling universal.
Konsentrasinya yang sangat rendah dan sangat terkendali di dalam sitosol (sekitar 0,0001 milimolar) menjadi penanda untuk proses vital seperti kontraksi otot, pelepasan neurotransmiter, dan pembelahan sel. Tubuh menginvestasikan energi besar (melalui pompa kalsium) untuk menjaga gradien konsentrasi ini, menunjukkan betapa kritisnya pengaturan kuantitas kalsium yang tepat, bahkan pada skala yang sangat kecil.
Alur dari Stoikiometri Dasar ke Implan Tulang
Perhitungan massa dan mol untuk kalsium adalah titik awal dalam merancang biomaterial canggih seperti implan tulang berbasis kalsium fosfat (misalnya hydroxyapatite).
- Langkah 1: Menentukan stoikiometri target. Hydroxyapatite ideal memiliki rumus Ca 10(PO 4) 6(OH) 2. Ini memberikan rasio mol Ca:P yang spesifik.
- Langkah 2: Perhitungan bahan baku. Berdasarkan rasio tersebut, dihitung massa prekursor kalsium (misalnya kalsium nitrat) dan fosfor yang dibutuhkan untuk sintesis sejumlah gram hydroxyapatite.
- Langkah 3: Kontrol sintesis. Selama reaksi presipitasi, kondisi seperti pH dan suhu dijaga ketat untuk memastikan rasio Ca:P yang diinginkan terbentuk, bukan fase kalsium fosfat lain.
- Langkah 4: Rekayasa porositas. Untuk mendukung pertumbuhan sel tulang, material dibuat berpori. Perhitungan stoikiometri juga mempengaruhi bagaimana bahan porogen (penghasil pori) berinteraksi dengan matriks hydroxyapatite.
- Langkah 5: Validasi produk. Implan yang dihasilkan dianalisis dengan teknik seperti XRD dan EDX untuk memverifikasi komposisi stoikiometri dan kemurnian fasenya, memastikan ia memiliki bioaktivitas dan kekuatan mekanik yang sesuai.
Homeostasis Kalsium dan Skala 5 Mol dalam Tubuh
Mekanisme homeostasis kalsium dalam tubuh manusia adalah sebuah simfoni regulasi yang melibatkan hormon paratiroid (PTH), kalsitonin, dan vitamin D. Ketika kadar kalsium darah turun, kelenjar paratiroid mengeluarkan PTH yang merangsang pelepasan kalsium dari tulang, meningkatkan penyerapan di usus, dan mengurangi ekskresi di ginjal. Sebaliknya, kelebihan kalsium akan menekan PTH dan memicu pelepasan kalsitonin untuk mengembalikan keseimbangan. Lalu, seberapa besar 5 mol kalsium itu dalam konteks tubuh? Satu mol kalsium setara dengan 40 gram. Rata-rata, kerangka manusia dewasa mengandung sekitar 1 kg (1000 gram) kalsium. Itu berarti sekitar 25 mol kalsium (1000 g / 40 g/mol). Jadi, 5 mol kalsium kira-kira setara dengan kandungan kalsium dalam kerangka satu individu dewasa (25 mol) dibagi lima, atau sekitar 20% dari total kalsium dalam satu kerangka manusia.
Struktur Atomik Hydroxyapatite pada Tulang
Kekuatan mekanik tulang sangat bergantung pada stoikiometri yang tepat dari mineralnya, hydroxyapatite. Bayangkan sebuah struktur kristal yang sangat teratur. Unit selnya menyerupai sebuah prisma heksagonal. Di dalam prisma ini, ion-ion kalsium tersusun dalam dua jenis posisi kristalografis yang berbeda: beberapa membentuk kolom sepanjang sumbu kristal, sementara yang lain mengelilingi saluran-saluran yang berisi gugus hidroksil (OH –). Ion fosfat (PO 43-) bertindak sebagai penghubung, mengikat berbagai posisi kalsium ini menjadi jaringan tiga dimensi yang sangat padat dan kuat.
Jika rasio Ca:P menyimpang dari 10:6 yang ideal, struktur ini menjadi cacat. Mungkin terbentuk fase kalsium fosfat lain seperti brushite atau monetite yang lebih mudah larut dan rapuh. Stoikiometri yang tepat ini memastikan kristal hydroxyapatite tumbuh dengan ukuran dan orientasi optimal, memberikan tulang sifat keras namun sedikit fleksibel, sebuah kombinasi sempurna yang direkayasa oleh alam melalui hukum stoikiometri.
Ringkasan Penutup
Source: ac.id
Jadi, perjalanan dari angka 200,156 g dan 5 mol ini mengajarkan lebih dari sekadar cara menghitung. Ia adalah bukti nyata keteraturan alam yang menakjubkan, di mana hukum stoikiometri bekerja dengan konsisten dari skala laboratorium hingga dalam tubuh kita. Ketepatan ini bukanlah kebetulan, melainkan fondasi yang memungkinkan kemajuan dalam rekayasa material, pengobatan, dan pemahaman akan kehidupan itu sendiri. Setiap kali kita menimbang dengan teliti, kita sebenarnya sedang melanjutkan narasi panjang pencarian manusia akan presisi dan kebenaran ilmiah.
Pertanyaan Umum yang Sering Muncul
Apakah angka 200,156 g itu pasti dan selalu sama untuk 5 mol kalsium?
Tidak mutlak. Angka itu dihitung berdasarkan massa atom relatif kalsium (Ca) sekitar 40,078 u. Nilai massa atom ini bisa sedikit berbeda tergantung sumber atau komposisi isotop di alam. Jadi, 200,156 g adalah hasil perhitungan ideal dengan massa molar 40,078 g/mol. Di laboratorium nyata, massa sampel mungkin sedikit menyimpang karena faktor ketidakpastian pengukuran.
Mengapa harus ada tiga angka di belakang koma? Apa pentingnya?
Tiga angka di belakang koma mencerminkan presisi pengukuran massa atom kalsium modern. Presisi ini crucial untuk perhitungan stoikiometri yang akurat dalam sintesis kimia atau analisis kuantitatif, di mana kesalahan kecil bisa berdampak besar pada hasil akhir, seperti dalam pembuatan obat atau material khusus.
Bagaimana jika saya hanya punya 200 g kalsium, berapa mol-nya?
Dengan massa molar ~40,078 g/mol, 200 g kalsium setara dengan sekitar 4,99 mol. Perhitungannya: 200 g / 40,078 g/mol ≈ 4,99 mol. Ini menunjukkan bahwa dalam praktiknya, kita sering bekerja dengan pendekatan, tetapi memahami nilai idealnya membantu mengukur seberapa akurat sampel kita.
Apakah pernyataan ini hanya berlaku untuk kalsium murni? Bagaimana dengan senyawa kalsium seperti kalsium karbonat?
Pernyataan ini spesifik untuk unsur kalsium (Ca) murni. Untuk senyawa seperti kalsium karbonat (CaCO3), massa molarnya berbeda (sekitar 100,086 g/mol). Jadi, 5 mol CaCO3 akan memiliki massa sekitar 500,43 g, bukan 200,156 g.
Dapatkah perhitungan ini digunakan untuk mengajar konsep mol kepada pemula?
Sangat bisa. Contoh ini konkret dan langsung menghubungkan dua besaran yang sering membingungkan: massa (gram) dan jumlah partikel (mol). Menunjukkan bahwa 5 mol bukanlah angka abstrak, melainkan setara dengan massa tertentu yang bisa dibayangkan, membuat konsep mol menjadi lebih mudah dipahami.