Perbedaan Ikatan Air Secara Fisik dan Kimia itu bukan cuma teori di buku pelajaran yang bikin pusing, tapi kunci untuk memahami kenapa air bisa jadi begitu spesial dalam hidup kita. Bayangin aja, dari secangkir kopi hangat yang nyaman sampai proses rumit di dalam sel tubuh kita, semuanya digerakkan oleh dua jenis “hubungan” antara molekul air yang sama sekali berbeda karakternya.
Nah, sebelum kita nyelam lebih dalam, yuk kenalan dulu dengan si molekul H2O yang sederhana tapi penuh kejutan ini.
Di satu sisi, ada ikatan kimia kovalen yang super kuat, menyatukan atom oksigen dan hidrogen dalam satu keluarga molekul. Di sisi lain, ada ikatan fisik berupa gaya tarik-menarik antarmolekul, terutama ikatan hidrogen, yang bikin molekul-molekul air itu rukun dan bersatu-padu. Dua jenis ikatan inilah yang kemudian jadi dalang di balik segala sifat air yang kita lihat sehari-hari, mulai dari kemampuannya melarutkan hampir segala sesuatu sampai fenomena unik seperti tegangan permukaan dan mengapungnya es di atas air.
Pendahuluan dan Konsep Dasar Ikatan Air
Air adalah pahlawan tanpa tanda jasa di planet ini. Bayangkan, dari reaksi kimia dalam sel tubuh kita hingga proses cucian di mesin, semuanya melibatkan air. Kemampuan luar biasa ini, yang membuatnya dijuluki “pelarut universal”, bersumber dari cara molekul-molekul air saling berinteraksi. Interaksi ini terbagi dalam dua kategori besar: ikatan kimia dan ikatan fisik.
Ikatan kimia adalah “janji setia” yang kuat, terjadi di dalam satu molekul itu sendiri. Dalam konteks air, ini adalah ikatan kovalen yang menyatukan atom oksigen dan hidrogen. Sementara itu, ikatan fisik lebih seperti “sapaan ramah” atau “genggaman lemah” antara molekul air yang berbeda. Ikatan ini, terutama ikatan hidrogen, meski lebih lemah, justru bertanggung jawab atas sebagian besar sifat unik air yang kita amati sehari-hari.
Struktur molekul air (H2O) adalah kunci segalanya. Atom oksigen yang lebih elektronegatif menarik elektron lebih kuat, membuat sisi molekul di sekitar oksigen bermuatan negatif parsial. Sebaliknya, dua atom hidrogen di sisi lain membawa muatan positif parsial. Bentuk seperti huruf ‘V’ dengan sudut sekitar 104.5 derajat ini menciptakan molekul yang sangat polar, sebuah magnet kecil yang siap menarik dan diattrak oleh sesamanya atau zat lain.
Ikatan Kimia dalam Molekul Air: Ikatan Kovalen
Ikatan kovalen dalam molekul air adalah fondasi yang tak tergoyahkan. Bayangkan dua atom hidrogen dan satu atom oksigen berbagi elektron untuk mencapai kestabilan. Oksigen, dengan sifat elektronegatifnya yang tinggi, menarik pasangan elektron ikatan lebih dekat ke dirinya. Pembagian yang tidak adil inilah yang menciptakan ikatan kovalen polar.
Polaritas ini menyebabkan molekul air memiliki “kutub”: ujung oksigen yang sedikit negatif (δ-) dan ujung hidrogen yang sedikit positif (δ+). Sifat polar inilah yang membuat air bisa melarutkan begitu banyak zat, terutama senyawa ionik dan polar lainnya. Ia seperti mediator ulung yang bisa memisahkan dan mengelilingi partikel-partikel zat terlarut.
Perbandingan ikatan kovalen pada air dengan senyawa lain menunjukkan keunikan polaritasnya.
| Karakteristik | Air (H₂O) | Oksigen (O₂) | Metana (CH₄) |
|---|---|---|---|
| Jenis Ikatan Kovalen | Polar | Nonpolar | Nonpolar (hampir) |
| Keelektronegatifan | Beda tinggi (O vs H) | Sama (O vs O) | Beda kecil (C vs H) |
| Distribusi Muatan | Tidak merata, bersifat dipol | Merata | Hampir merata |
| Pengaruh pada Sifat | Membentuk ikatan hidrogen, pelarut polar baik | Sukar larut dalam air, titik didih sangat rendah | Gas pada suhu ruang, sukar larut dalam air |
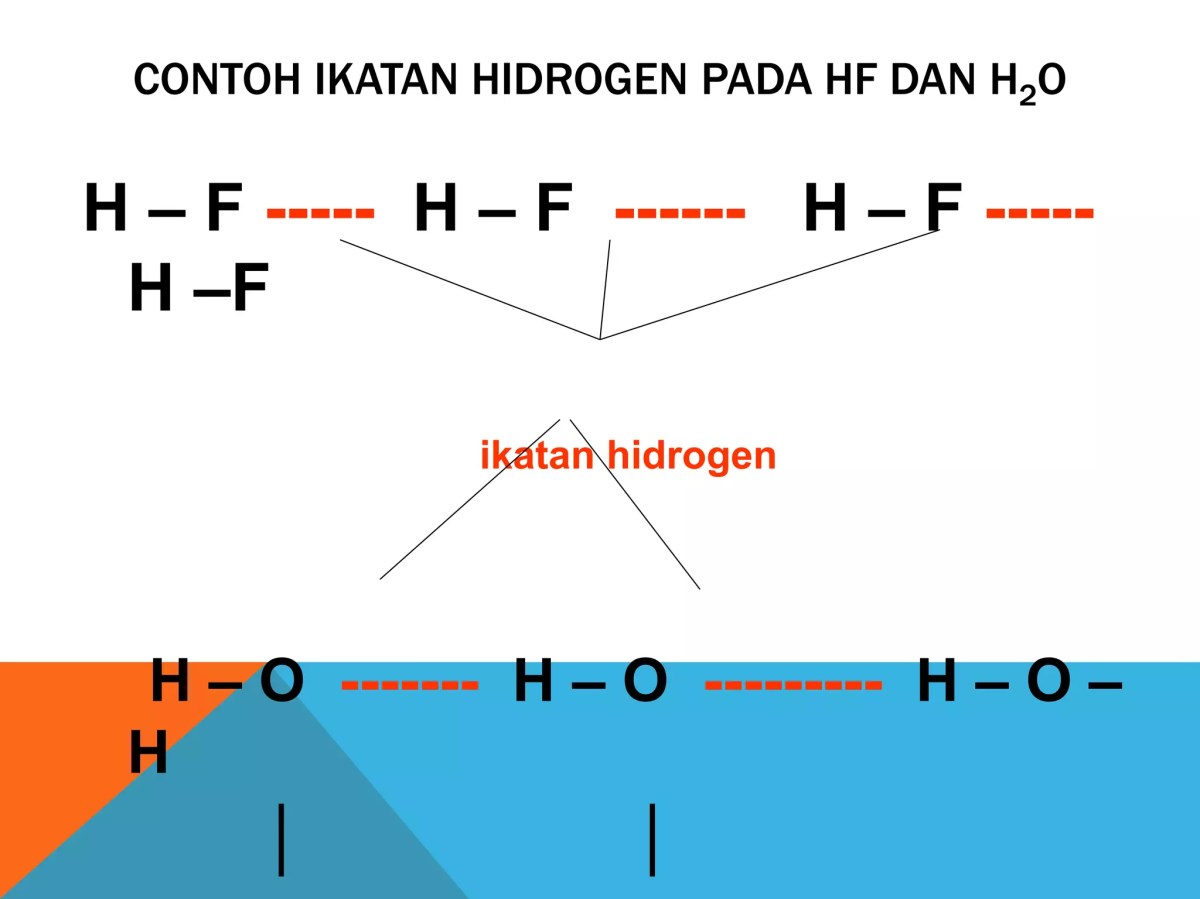
Ikatan Fisik Antarmolekul Air: Ikatan Hidrogen
Di sinilah keajaiban air benar-benar terlihat. Ikatan hidrogen adalah gaya tarik antarmolekul spesial yang terjadi ketika atom hidrogen dari satu molekul air, yang sudah terikat kovalen dengan oksigen (δ+), tertarik kuat ke atom oksigen (δ-) dari molekul air tetangganya. Ini seperti sebuah jaringan sosial yang luas dan dinamis, di mana setiap molekul bisa terhubung hingga empat molekul lain.
Meski disebut “ikatan”, kekuatannya hanya sekitar sepersepuluh dari ikatan kovalen. Namun, dibandingkan gaya antarmolekul lain seperti gaya London (yang menjaga O₂ tetap cair pada suhu sangat rendah) atau gaya dipol-dipol (pada HCl), ikatan hidrogen adalah yang terkuat dalam kelompoknya. Kekuatan inilah yang membuat air memiliki titik didih (100°C) jauh lebih tinggi daripada senyawa seukuran seperti H₂S (-60°C), yang hanya mengandalkan gaya dipol-dipol yang lebih lemah.
Jaringan ikatan hidrogen yang luas ini menghasilkan konsekuensi fisik yang langsung bisa kita amati.
- Titik Didih dan Beku yang Tinggi: Diperlukan energi panas lebih banyak untuk memutus banyak ikatan hidrogen sebelum air menguap, atau sebelum molekul-molekulnya mengatur ulang menjadi es.
- Tegangan Permukaan yang Kuat: Molekul air di permukaan ditarik ke dalam oleh ikatan hidrogen dengan molekul di bawahnya, membentuk “kulit” elastis yang memungkinkan serangga air berjalan dan tetesan air berbentuk bulat.
- Kapasitas Panas yang Besar: Air bisa menyerap banyak panas tanpa kenaikan suhu yang drastis, berkat energi yang dipakai untuk meregangkan dan memutus ikatan hidrogen. Ini yang membuat iklim di dekat laut lebih stabil.
- Viskositas dan Kohesi: Air “lengket” pada dirinya sendiri, sehingga bisa membentuk aliran yang kontinu dan naik melawan gravitasi di pembuluh tumbuhan yang kecil (kapilaritas).
Perbandingan Mendasar antara Ikatan Kovalen dan Ikatan Hidrogen: Perbedaan Ikatan Air Secara Fisik Dan Kimia
Memahami perbedaan antara ikatan kovalen (intramolekul) dan ikatan hidrogen (intermolekul) adalah kunci untuk mengerti mengapa air berperilaku seperti itu. Perbedaan ini bukan sekadar soal nama, tetapi menyangkut kekuatan, sifat, dan peran yang benar-benar berbeda dalam menentukan nasib molekul air.
| Aspek | Ikatan Kovalen (dalam H₂O) | Ikatan Hidrogen (antar H₂O) |
|---|---|---|
| Jenis & Kekuatan | Ikatan kimia primer, sangat kuat (~460 kJ/mol). | Gaya antarmolekul sekunder, relatif lemah (~10-40 kJ/mol). |
| Sifat | Menentukan identitas kimia molekul air (H₂O). | Menentukan sifat fisik fase air (cair, padat, gas). |
| Panjang Ikatan | Pendek (~0.096 nm antara O-H). | Lebih panjang (~0.177 nm antara O…H). |
| Energi Pemutusan | Memerlukan reaksi kimia (elektrolisis, fotolisis). | Cukup dengan pemanasan fisik biasa (mendidih, menguap). |
Ikatan kovalen jauh lebih kuat karena melibatkan pembagian atau transfer elektron di tingkat orbital, menciptakan ikatan yang fundamental. Memutuskannya berarti mengubah molekul air menjadi unsur-unsur penyusunnya (hidrogen dan oksigen). Sementara ikatan hidrogen hanyalah gaya tarik elektrostatik antara muatan parsial, mudah terbentuk dan putus hanya dengan perubahan energi termal biasa.
Dalam kehidupan sehari-hari, kita mengalami pemutusan ikatan hidrogen setiap kali merebus air atau mengeringkan pakaian. Molekul air memperoleh energi panas cukup untuk lepas dari jaringan ikatan hidrogen dan menjadi uap. Sebaliknya, contoh pemutusan ikatan kovalen air terjadi dalam proses elektrolisis, di mana arus listrik dialirkan ke dalam air untuk menguraikannya menjadi gas hidrogen dan oksigen—sebuah perubahan kimia yang permanen.
Manifestasi Sifat Air Akibat Ikatan Kimia dan Fisik
Source: slidesharecdn.com
Dari dua jenis ikatan ini, lahir sifat-sifat air yang tampak biasa tetapi sebenarnya luar biasa. Kohesi (tarik-menarik antar molekul air) dan adhesi (tarik-menarik antara air dengan permukaan lain) adalah anak kandung dari ikatan hidrogen. Kohesi yang kuat menyebabkan tegangan permukaan, sedangkan adhesi yang baik—misalnya ke dinding gelas atau dinding sel tumbuhan—memungkinkan air “merayap” naik melalui kapiler, melawan gravitasi.
Fenomena unik lainnya adalah mengapa es mengapung. Saat air membeku, molekul-molekulnya mengatur diri dalam struktur kristal heksagonal yang kaku dan teratur. Dalam struktur ini, ikatan hidrogen memaksa molekul untuk berjarak lebih jauh dibandingkan ketika dalam fase cair yang lebih padat dan acak. Akibatnya, volume es lebih besar untuk massa yang sama, sehingga massa jenisnya lebih rendah daripada air cair. Ini adalah anomali yang menyelamatkan kehidupan akuatik, karena es yang mengapung menjadi insulator yang melindungi air di bawahnya dari pembekuan total.
Deskripsi tekstual tentang bagaimana molekul air berikatan dalam tiga fase mengilustrasikan dinamika ini. Dalam fase gas (uap), molekul air benar-benar bebas, hampir tidak ada ikatan hidrogen yang bertahan, mereka bergerak acak dan saling berjauhan. Dalam fase cair, terjadi tarian yang dinamis: ikatan hidrogen terus-menerus terbentuk dan putus dalam waktu pikodetik. Setiap molekul air dikelilingi oleh tetangganya dalam jaringan yang selalu berubah, memungkinkan fluiditas.
Dalam fase padat (es), tarian berhenti. Molekul air mengunci diri dalam posisi tetap, setiap molekul terikat secara hidrogen pada empat molekul lain membentuk struktur kristal yang luas, berongga, dan stabil.
Aplikasi dan Implikasi dalam Kehidupan dan Sains
Pengaruh ikatan kimia dan fisik air merambah jauh ke dalam sendi-sendi kehidupan dan sains. Dalam biologi, ikatan hidrogen adalah penjaga kode kehidupan. Ia menyatukan dua untai DNA dalam bentuk heliks ganda melalui ikatan hidrogen antara basa nitrogen. Tanpa ikatan yang spesifik namun mudah dilepas ini, replikasi dan transkripsi DNA tidak mungkin terjadi. Ikatan hidrogen juga menentukan bentuk tiga dimensi protein dan enzim, yang langsung memengaruhi fungsinya.
Dalam kimia larutan, sifat fisikokimia suatu larutan sangat dipengaruhi oleh bagaimana molekul air berinteraksi dengan zat terlarut. Pelarutan garam dapur (NaCl), misalnya, melibatkan pemutusan ikatan ionik yang kuat oleh molekul air polar, di mana ujung δ- mengelilingi Na⁺ dan ujung δ+ mengelilingi Cl⁻. Proses ini, yang disebut hidrasi, dimungkinkan oleh kemampuan air membentuk ikatan hidrogen dengan dirinya sendiri dan berinteraksi dengan ion.
Nah, kalau kita ngomongin Perbedaan Ikatan Air Secara Fisik dan Kimia, itu kayak bedain kolaborasi spontan dengan kerja tim yang solid. Sama kayak riset, butuh formulasi yang pas. Soalnya, bikin tim riset yang efektif itu ada seninya, lho. Kamu bisa pelajari strateginya lewat panduan Menghitung Cara Membentuk Tim Penelitian dengan Minimal 1 Dosen per Proyek. Dengan tim yang kompak, analisis mendalam tentang ikatan hidrogen dan van der Waals dalam air pun bisa lebih tajam dan berbobot.
Pemahaman mendalam tentang kedua ikatan ini bukan hanya teori, tetapi fondasi aplikasi praktis.
Nah, dalam memahami perbedaan ikatan air secara fisik dan kimia, kita perlu ketelitian seperti saat menghitung anggota himpunan. Coba lihat contoh soal Banyaknya Elemen T = x | -4 < x < 4, x Bulat, di mana presisi angka sangat krusial. Sama halnya dengan air, membedakan gaya tarik antarmolekul (fisik) dan pembentukan ikatan kovalen O-H (kimia) butuh fokus yang sama detailnya agar tidak keliru memahami sifat unik molekul kehidupan ini.
Dalam kimia pangan, pengetahuan tentang ikatan hidrogen membantu insinyur makanan mengontrol tekstur, kekenyalan, dan stabilitas produk. Misalnya, dalam pembuatan permen atau pengawetan daging, pengaturan aktivitas air—yang berkaitan dengan ketersediaan molekul air untuk membentuk ikatan hidrogen—adalah kunci mencegah pertumbuhan mikroba atau menjaga kelembaban. Di ilmu material, desain hidrogel superabsorben atau membran untuk desalinasi air laut berawal dari rekayasa bagaimana polimer dalam material tersebut berinteraksi dengan air melalui ikatan hidrogen.
Kesimpulan Akhir
Jadi, gimana? Sudah lebih jelas kan sekarang bedanya “hubungan resmi” ikatan kovalen dalam molekul air dengan “hubungan sosial” ikatan hidrogen antar molekulnya? Pemahaman ini nggak cuma buat ngejawab soal ujian, tapi bener-bener membuka mata kita tentang bagaimana hal sederhana seperti seteguk air punya cerita sains yang kompleks dan menakjubkan. Intinya, dua jenis ikatan yang berbeda kekuatan dan sifat ini bekerja sama menciptakan harmoni, menjadikan air sebagai fondasi kehidupan yang tak tergantikan.
Pertanyaan yang Sering Diajukan
Apakah ikatan hidrogen hanya ada di air?
Tidak. Ikatan hidrogen juga terjadi pada senyawa lain yang memiliki atom hidrogen terikat pada atom yang sangat elektronegatif seperti nitrogen (N), oksigen (O), atau fluor (F), misalnya pada amonia (NH3) atau DNA. Namun, ikatan hidrogen dalam air sangat kuat dan banyak, sehingga memberikan sifat yang unik.
Mengapa memahami perbedaan ini penting dalam memasak?
Karena proses memasak sering melibatkan pemutusan ikatan. Merebus air memutus ikatan hidrogen (fisik), sementara elektrolisis air memutus ikatan kovalen (kimia). Memahami mana yang lebih kuat membantu mengontrol tekstur makanan, seperti mencegah sayuran lembek berlebihan atau memahami proses penguapan.
Bisakah kita melihat ikatan-ikatan ini secara langsung?
Tidak bisa dengan mata telanjang karena ukurannya yang sangat kecil (tingkat atom). Namun, kita bisa melihat dan merasakan manifestasi atau akibat dari ikatan-ikatan tersebut, seperti tetesan air yang bulat (tegangan permukaan), es yang mengapung, atau butiran garam yang larut.
Manakah yang lebih dulu terbentuk, ikatan kimia atau fisik pada air?
Ikatan kimia (kovalen) terbentuk lebih dulu saat atom oksigen dan hidrogen menyatu membentuk satu molekul air (H2O). Setelah molekul air terbentuk, barulah ikatan fisik (seperti ikatan hidrogen) antar molekul-molekul air tersebut dapat terjadi.


