Konfigurasi Elektron Vanadium bukan sekadar deretan angka dan huruf dalam buku pelajaran, melainkan kode rahasia yang membuka pintu memahami keunikan logam transisi satu ini. Bayangkan, dari susunan elektron yang teratur itulah lahir sifat-sifat menakjubkan vanadium, mulai dari kemampuannya berubah warna layaknya bunglon dalam berbagai bilangan oksidasi, hingga perannya sebagai pahlawan di balik material canggih penyimpan data dan katalis industri. Mari kita selami lebih dalam, karena memahami konfigurasinya berarti menguak cerita di balik logam serba bisa ini.
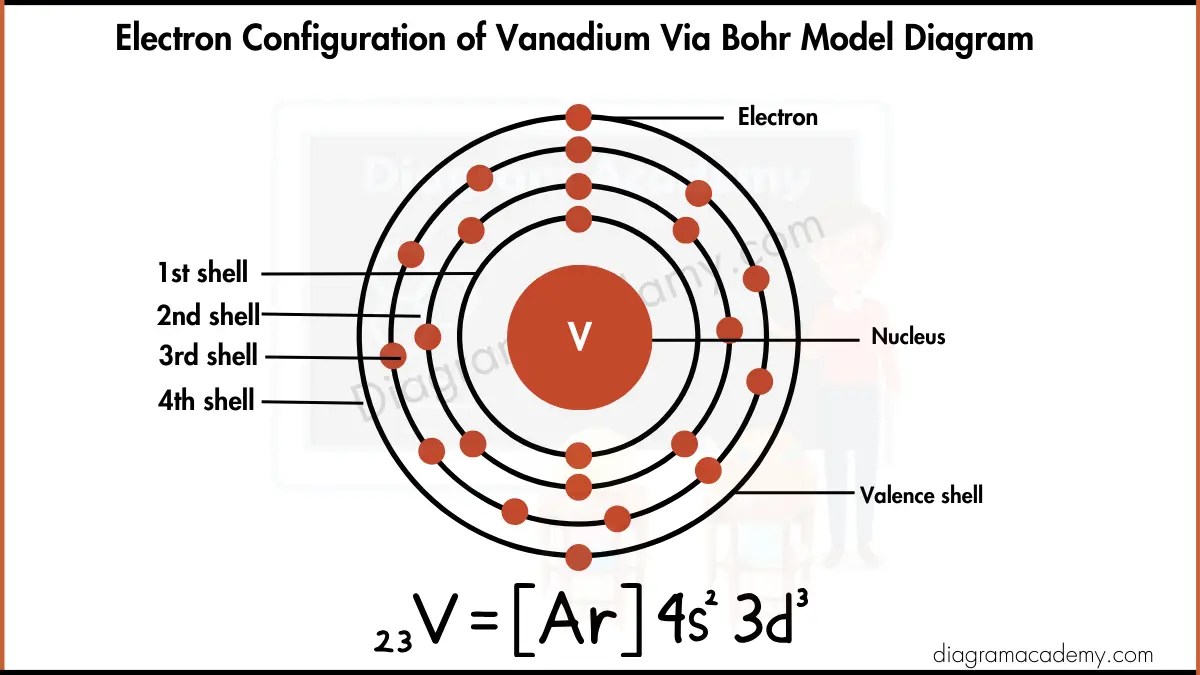
Secara mendasar, atom vanadium netral (V) dengan nomor atom 23 mengisi orbitalnya menurut aturan Aufbau, Pauli, dan Hund, menghasilkan konfigurasi [Ar] 4s² 3d³. Pola pengisian ini, di mana elektron terakhir menghuni orbital 3d daripada menyempurnakan 4s, menjadi ciri khas unsur transisi dan landasan bagi variasi sifatnya. Perbandingan dengan tetangganya seperti titanium dan kromium menunjukkan bagaimana sedikit perbedaan jumlah elektron di subkulit d dapat mengakibatkan perubahan dramatis pada sifat magnetik dan kestabilan, membuktikan bahwa detail konfigurasi elektron adalah penentu utama karakter suatu unsur.
Dasar-Dasar Konfigurasi Elektron Vanadium
Memahami konfigurasi elektron vanadium adalah kunci untuk membuka semua sifat uniknya, mulai dari warna ionnya yang beragam hingga kemampuannya sebagai katalis. Konfigurasi ini menggambarkan bagaimana 23 elektron vanadium tersusun di sekitar inti atomnya, mengikuti aturan-aturan kuantum yang elegan. Mari kita telusuri dasar-dasarnya sebelum menyelami kompleksitas yang lebih menarik.
Prinsip Pengisian Orbital dan Konfigurasi Vanadium
Pengisian elektron pada atom netral mengikuti tiga aturan utama: Aturan Aufbau (mengisi dari tingkat energi terendah), Prinsip Larangan Pauli (tidak ada dua elektron dengan keempat bilangan kuantum yang sama), dan Kaidah Hund (elektron akan mengisi orbital kosong dalam subkulit yang sama secara sendiri-sendiri terlebih dahulu sebelum berpasangan). Untuk vanadium (nomor atom 23), urutan pengisiannya adalah 1s², 2s², 2p⁶, 3s², 3p⁶, 4s², dan kemudian 3d³.
Perhatikan bahwa setelah 3p⁶ terisi, orbital 4s memiliki energi yang sedikit lebih rendah daripada 3d, sehingga diisi terlebih dahulu. Konfigurasi lengkapnya adalah [Ar] 4s² 3d³.
Perbandingan dengan Unsur Transisi Lainnya
Pola konfigurasi elektron menjadi sangat menarik ketika kita membandingkan vanadium dengan tetangganya di periode keempat. Titanium (Ti, nomor atom 22) memiliki konfigurasi [Ar] 4s² 3d², mengikuti pola yang diharapkan. Vanadium, dengan satu elektron tambahan, mengisi orbital 3d menjadi tiga. Namun, kromium (Cr, nomor atom 24) menunjukkan penyimpangan: konfigurasinya adalah [Ar] 4s¹ 3d⁵. Hal ini terjadi karena kestabilan ekstra yang diperoleh dari subkulit 3d yang setengah penuh dan 4s yang terisi sebagian.
Mangan (Mn, nomor atom 25) kembali ke pola normal dengan [Ar] 4s² 3d⁵.
| Unsur | Elektron Valensi (4s+3d) | Elektron di Subkulit 3d | Sifat Magnetik |
|---|---|---|---|
| Titanium (Ti) | 4 | 2 | Paramagnetik |
| Vanadium (V) | 5 | 3 | Paramagnetik (kuat) |
| Kromium (Cr) | 6 | 5 | Paramagnetik |
| Mangan (Mn) | 7 | 5 | Paramagnetik (sangat kuat) |
Keadaan Oksidasi dan Ion Vanadium
Salah satu hal paling memukau dari vanadium adalah kemampuannya untuk eksis dalam berbagai keadaan oksidasi, mulai dari +2 hingga +5. Setiap perubahan keadaan oksidasi ini berarti melepas elektron dari orbital terluarnya, yang secara dramatis mengubah konfigurasi elektron dan, akibatnya, sifat fisik serta kimia ion tersebut. Fenomena inilah yang menjadi dalang di balik palet warna larutan vanadium yang menakjubkan.
Konfigurasi Elektron Ion Vanadium Umum
Ketika vanadium kehilangan elektron untuk membentuk ion positif, elektron selalu dilepaskan dari orbital 4s terlebih dahulu, baru kemudian dari orbital 3d. Berikut konfigurasi elektron untuk ion-ion umumnya:
- V²⁺: [Ar] 3d³. Kehilangan dua elektron 4s.
- V³⁺: [Ar] 3d². Kehilangan dua elektron 4s dan satu elektron 3d.
- V⁴⁺ (ion vanadil, VO²⁺): [Ar] 3d¹. Konfigurasi yang umum dalam senyawa okso.
- V⁵⁺: [Ar] 3d⁰. Semua elektron valensi telah hilang.
Kestabilan relatif suatu keadaan oksidasi sering dikaitkan dengan konfigurasi elektron yang setengah penuh atau penuh. V³⁺ (3d²) dan V⁴⁺ (3d¹) kurang stabil secara relatif dibandingkan V²⁺ (3d³, setengah penuh dari orbital d yang mungkin terisi lima elektron) dan V⁵⁺ (3d⁰, kulit penuh berupa gas mulia Argon). Namun, dalam larutan air, V⁵⁺ dan V⁴⁺ justru lebih stabil karena membentuk oksokation seperti VO₂⁺ dan VO²⁺ yang sangat stabil.
Warna Ion Vanadium dalam Larutan
Transisi elektron di dalam orbital d yang tidak terisi penuh menyerap cahaya tampak, memberikan warna khas pada setiap ion vanadium. Perubahan warna ini sering digunakan sebagai indikator visual dalam eksperimen redoks.
- V²⁺: Ion ini memberikan larutan berwarna ungu atau lembayung.
- V³⁺: Larutan ion V³⁺ berwarna hijau.
- V⁴⁺ (VO²⁺): Warna biru yang khas, sering ditemukan dalam ion vanadil.
- V⁵⁺ (VO₂⁺): Biasanya tidak berwarna atau kuning pucat, karena tidak ada elektron d yang dapat mengalami transisi (konfigurasi d⁰).
Ion V⁵⁺ bersifat diamagnetik karena konfigurasi elektronnya adalah [Ar] 3d⁰. Tidak ada elektron yang tidak berpasangan dalam orbitalnya. Saat ditempatkan dalam medan magnet, ion ini sedikit ditolak karena semua elektronnya berpasangan dan spinnya saling meniadakan.
Aplikasi dan Signifikansi dalam Kimia Material
Konfigurasi elektron vanadium bukan sekadar teori di buku pelajaran; ia adalah arsitek di balik sifat-sifat canggih material berbasis vanadium. Elektron-elektron di orbital 3d yang mudah bergerak ini memberikannya kemampuan untuk berubah-ubah, sebuah sifat yang dimanfaatkan dalam teknologi switchable, katalisis, dan media penyimpanan magnetik.
Peran dalam Konduktivitas dan Katalisis
Source: diagramacademy.com
Vanadium oksida (VO₂) adalah contoh klasik. Pada suhu sekitar 68°C, VO₂ mengalami transisi fase dari insulator ke konduktor logam. Perubahan drastis ini terjadi karena perubahan konfigurasi elektronik yang mengatur bagaimana elektron 3d vanadium terlokalisasi (isolator) atau terdelokalisasi (konduktor). Dalam dunia katalisis, kemampuan vanadium untuk dengan mudah berganti antara keadaan oksidasi +4 dan +5, berkat kemudahan kehilangan atau mendapatkan satu elektron dari orbital 3d-nya, membuatnya menjadi katalis ideal.
Proses kontak dalam pembuatan asam sulfat menggunakan V₂O₅ adalah bukti keampuhannya, di mana vanadium dengan efisien mengangkut oksigen.
Pengaruh pada Sifat Magnetik Paduan
Elektron yang tidak berpasangan dalam orbital 3d vanadium memberikan momen magnetik yang besar. Dalam paduan, seperti paduan vanadium-besi, interaksi antara momen magnetik atom-atom ini dapat diatur untuk menciptakan material dengan sifat magnetik yang diinginkan. Misalnya, variasi komposisi dan penataan dapat menghasilkan paduan yang mempertahankan magnetisasinya dengan kuat (untuk penyimpanan data permanen) atau yang mudah diubah (untuk memori akses acak). Konfigurasi elektron yang tepat menentukan kekuatan dan orientasi “spin” elektron, yang merupakan unit dasar informasi dalam teknologi spintronik masa depan.
| Senyawa Vanadium | Konfigurasi Elektron Ion V | Aplikasi Utama |
|---|---|---|
| V₂O₅ (Vanadium pentoksida) | V⁵⁺: [Ar] 3d⁰ | Katalis industri (proses kontak H₂SO₄), material katoda baterai. |
| VO₂ | V⁴⁺: [Ar] 3d¹ | Jendela pintar (smart windows), sakelar termal akibat transisi fase insulator-logam. |
| V₂O₃ | V³⁺: [Ar] 3d² | Studi material korrelated electron systems, lapisan tipis untuk perangkat elektronik. |
| FeV (Ferrovanadium) | V dalam keadaan campuran | Paduan penguat baja, meningkatkan kekuatan dan ketahanan korosi. |
Eksperimen dan Data Spektroskopi
Teori konfigurasi elektron menjadi nyata dan terukur melalui teknik spektroskopi. Dengan menganalisis cahaya yang diserap atau dipancarkan oleh atom atau ion vanadium, kita dapat memetakan tingkat-tingkat energi orbitalnya secara langsung. Data spektroskopi ini adalah bukti eksperimental yang mengonfirmasi prediksi mekanika kuantum.
Bukti Spektroskopi dan Prediksi Spektrum
Spektrum emisi atom vanadium, misalnya, menunjukkan serangkaian garis spektrum yang khas. Garis-garis ini berasal dari transisi elektron antara orbital 3d dan 4s atau antara subtingkat energi yang berbeda dalam orbital 3d itu sendiri. Untuk senyawa kompleks vanadium, seperti [V(H₂O)₆]³⁺, spektroskopi UV-Vis digunakan. Berdasarkan teori medan kristal, kita dapat memprediksi bahwa ion V³⁺ (d²) dalam lingkungan oktahedral akan menunjukkan tiga pita absorpsi yang berkaitan dengan transisi antara orbital-orbital t₂g dan eg yang telah terpisah akibat medan ligan.
Diagram Tingkat Energi Orbital 3d
Dalam lingkungan oktahedral, lima orbital d yang awalnya degenerasi (berenergi sama) terpisah menjadi dua kelompok energi. Dua orbital (d x²-y² dan d z²) yang disebut orbital eg, mengalami tolakan yang lebih besar dengan ligan yang mendekati sepanjang sumbu, sehingga energinya meningkat. Tiga orbital lainnya (d xy, d xz, d yz) yang disebut t₂g, memiliki energi yang lebih rendah. Perbedaan energi antara tingkat t₂g dan eg ini disebut pemisahan medan kristal (Δ o).
Untuk ion V³⁺ (d²), kedua elektron akan menempati orbital t₂g dengan spin paralel sesuai kaidah Hund.
Warna dan Transisi Elektron dalam Kompleks
Warna yang kita lihat pada senyawa kompleks vanadium adalah warna komplemen dari cahaya yang diserap dalam transisi elektron d-d. Hubungannya dapat dijelaskan sebagai berikut:
- Kompleks [V(H₂O)₆]³⁺ (hijau) menyerap cahaya di daerah merah dan ungu, memantulkan hijau.
- Kompleks [V(H₂O)₆]²⁺ (ungu) menyerap cahaya di daerah hijau-kuning.
- Besarnya pemisahan medan kristal (Δ o) menentukan energi (dan thus warna) cahaya yang diserap. Ligan yang berbeda akan mengubah Δ o dan menggeser warna kompleks.
- Transisi yang terjadi adalah spin-allowed untuk konfigurasi d¹, d², d⁴, d⁶, d⁷, d⁹, sehingga pita absorpsi cukup kuat dan warna jelas teramati.
Perbandingan dan Konteks dalam Tabel Periodik: Konfigurasi Elektron Vanadium
Posisi vanadium di tengah deret transisi pertama memberikannya cerita yang menarik bila dibaca secara vertikal (dalam golongan) dan horizontal (dalam periode). Membandingkannya dengan unsur lain mengungkap pola periodik yang mendasar, seperti energi ionisasi dan jari-jari atom, yang semuanya berakar dari konfigurasi elektron.
Perbandingan dalam Golongan dan Periode, Konfigurasi Elektron Vanadium
Secara vertikal, vanadium berada dalam Golongan 5 bersama niobium (Nb) dan tantalum (Ta). Ketiganya memiliki konfigurasi elektron valensi ns² (n-1)d³, menunjukkan kesamaan sifat kimia, meskipun efek lantanida membuat Nb dan Ta lebih mirip satu sama lain. Secara horizontal, perbandingan dengan kromium (Cr) di sebelah kanannya sangat instruktif. Penyimpangan konfigurasi Cr ([Ar] 4s¹ 3d⁵) yang telah dibahas, menyoroti pentingnya stabilitan subkulit setengah penuh, sebuah fenomena yang tidak terjadi pada vanadium dengan konfigurasi normal [Ar] 4s² 3d³.
Pola Energi Ionisasi dan Jari-Jari
Energi ionisasi pertama unsur transisi deret pertama umumnya meningkat dari kiri ke kanan sepanjang periode, karena muatan inti efektif meningkat. Namun, peningkatannya tidak sedramatis pada golongan utama. Vanadium memiliki energi ionisasi pertama sekitar 650 kJ/mol, sedikit lebih tinggi dari titanium di kirinya dan sedikit lebih rendah dari kromium di kanannya. Pola jari-jari atom menunjukkan penurunan umum dari kiri ke kanan (kontraksi deret transisi) karena elektron yang ditambahkan masuk ke orbital 3d yang kurang efektif dalam perisai.
Jari-jari ion untuk keadaan oksidasi yang sama (misalnya, M³⁺) juga mengikuti pola penurunan yang serupa.
| Unsur | Konfigurasi Elektron [Ar] + … | Jari-Jari Atom (pm) | Energi Ionisasi Pertama (kJ/mol) |
|---|---|---|---|
| Vanadium (V) | 4s² 3d³ | 134 | 650 |
| Kromium (Cr) | 4s¹ 3d⁵ | 128 | 652 |
| Mangan (Mn) | 4s² 3d⁵ | 127 | 717 |
| Besi (Fe) | 4s² 3d⁶ | 126 | 762 |
Data pada tabel menunjukkan bahwa meskipun konfigurasi elektron Cr berbeda, jari-jarinya lebih kecil dan energi ionisasinya sangat mirip dengan V, sementara Mn dan Fe menunjukkan lompatan energi ionisasi yang lebih jelas seiring dengan pengisian orbital 3d yang semakin stabil.
Ringkasan Penutup
Jadi, setelah menelusuri dari dasar konfigurasi hingga aplikasi spektroskopinya, jelas bahwa Konfigurasi Elektron Vanadium jauh lebih dari sekadar hafalan. Ia adalah narasi fundamental yang menjelaskan mengapa ion vanadium punya warna-warna cantik, bagaimana vanadium oksida bisa “berpikir” untuk beralih antara isolator dan konduktor, serta alasan di balik kekuatan magnetik paduannya. Memahami narasi ini memberikan kita lensa yang lebih tajam untuk melihat bukan hanya vanadium, tetapi juga kerumitan dan keindahan seluruh unsur transisi dalam tabel periodik.
Pada akhirnya, setiap elektron yang menempati orbitalnya dengan tertib itu sedang bercerita tentang potensi yang menunggu untuk dimanfaatkan.
Pertanyaan yang Kerap Ditanyakan
Mengapa konfigurasi elektron vanadium ditulis [Ar] 4s² 3d³, bukan [Ar] 3d³ 4s²?
Penulisan [Ar] 4s² 3d³ mengikuti konvensi dimana orbital diurutkan berdasarkan peningkatan bilangan kuantum utama (n) dan azimuth (l). Meskipun energi orbital 4s sedikit lebih rendah daripada 3d saat pengisian, setelah terisi penuh dan atom menjadi ion, orbital 4s memiliki energi yang lebih tinggi. Urutan penulisan ini lebih umum digunakan untuk menunjukkan konfigurasi dasar atom netral.
Apakah konfigurasi elektron vanadium bisa berubah?
Konfigurasi elektron atom vanadium netral adalah tetap. Namun, ketika vanadium membentuk ion atau senyawa, ia akan melepaskan elektron. Urutan pelepasan elektron biasanya dari orbital 4s terlebih dahulu, baru kemudian 3d. Jadi, konfigurasi elektron untuk ion-ionnya (seperti V²⁺, V³⁺) akan berbeda dari atom netralnya.
Bagaimana konfigurasi elektron mempengaruhi warna senyawa vanadium?
Warna muncul dari transisi elektron antara orbital-orbital d yang terpecah (split d-orbitals) dalam suatu medan ligan. Konfigurasi elektron ion vanadium (misalnya, d¹ untuk V⁴⁺ atau d² untuk V³⁺) menentukan elektron mana yang dapat berpindah dan menyerap panjang gelombang cahaya tertentu. Perbedaan jumlah elektron inilah yang menyebabkan ion V⁵⁺ (d⁰) tak berwarna, sedangkan ion lainnya berwarna-warni.
Apa hubungan konfigurasi elektron vanadium dengan sifat magnetnya?
Sifat magnetik ditentukan oleh spin elektron yang tidak berpasangan. Konfigurasi 3d³ pada atom V netral berarti ada tiga elektron tidak berpasangan, menjadikannya paramagnetik (tertarik medan magnet). Jika konfigurasinya berubah sehingga semua elektron berpasangan (seperti pada V⁵⁺ dengan konfigurasi d⁰), maka ia menjadi diamagnetik (ditolak lemah oleh medan magnet).
Mengapa vanadium memiliki banyak bilangan oksidasi?
Hal ini karena energi yang dibutuhkan untuk melepaskan elektron dari orbital 4s dan 3d relatif berdekatan. Vanadium dapat melepaskan elektron secara bertahap (dari 2 hingga 5 elektron) untuk mencapai konfigurasi subkulit d yang setengah penuh (d³ pada V²⁺), penuh (d⁰ pada V⁵⁺), atau stabil lainnya, dengan pertimbangan energi stabilisasi medan ligan dan hidrasi.


