H2O: Rumus Kimia Air, cuma tiga huruf dan angka yang sederhana, tapi di balik itu tersimpan rahasia alam paling fundamental yang bikin planet ini bisa ditinggali. Kita sering banget ngeliat air, minum air, bahkan mandi pake air, tapi apa bener paham apa yang bikin segelas air itu istimewa? Yuk, kita selami lebih dalam, dari struktur molekulnya yang unik sampai perannya yang nggak tergantikan dalam setiap detak jantung dan keseimbangan iklim Bumi.
Ini bukan cuma pelajaran kimia biasa, ini cerita tentang zat yang jadi panggung utama kehidupan itu sendiri.
Mari kita mulai dari partikel terkecilnya: dua atom hidrogen yang setia mengikat satu atom oksigen, membentuk bentuk ‘V’ dengan sudut spesifik. Ikatan polar inilah yang memberinya sifat-sifat luar biasa, mulai dari kemampuannya melarutkan hampir segalanya, menjaga suhu tubuh kita stabil, hingga menjadi agen transportasi nutrisi ke seluruh penjuru tubuh. Air itu lebih dari sekadar cairan bening; dia adalah pelaku utama dalam drama biologi, kimia, dan geologi yang terus berlangsung setiap saat.
Pengertian Dasar dan Struktur Molekul H2O
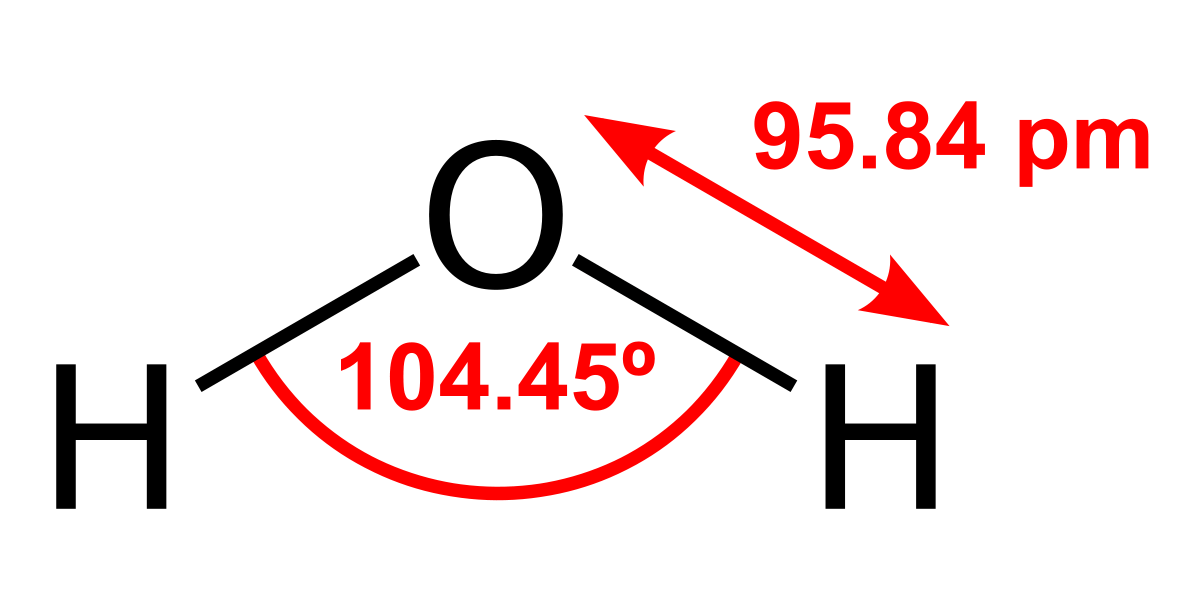
Sebelum kita membahas lebih jauh tentang peran air yang luar biasa, mari kita pahami dulu bangunan dasarnya. Rumus kimia H2O itu sebenarnya adalah kode singkat yang sangat elegan. Huruf ‘H’ mewakili atom Hidrogen, ‘O’ untuk atom Oksigen, dan angka ‘2’ kecil di samping H menunjukkan bahwa ada dua atom hidrogen yang terikat pada satu atom oksigen. Jadi, satu molekul air adalah persatuan dari tiga sahabat kecil: satu atom oksigen yang besar hati dan dua atom hidrogen yang setia.
Struktur molekul air ini tidak simetris. Bayangkan seperti kepala Mickey Mouse yang klasik: atom oksigen adalah kepala bundarnya, sementara dua atom hidrogen adalah dua telinga yang mencuat. Kedua ikatan O-H ini membentuk sudut sekitar 104,5 derajat. Sudut ini yang membuat molekul air tidak lurus dan menjadi kunci dari banyak sifat ajaibnya.
Struktur Geometris dan Ikatan Kovalen Polar
Atom oksigen itu seperti kandidat yang lebih kuat dalam memperebutkan elektron. Sifat ini disebut elektronegativitas. Dalam ikatan dengan hidrogen, oksigen menarik pasangan elektron lebih kuat ke arahnya. Hasilnya, meski elektron bersama, distribusinya tidak merata. Ujung molekul di sekitar oksigen menjadi sedikit bermuatan negatif, sementara ujung di sekitar hidrogen menjadi sedikit bermuatan positif.
Inilah yang disebut ikatan kovalen polar. Ketidakseimbangan muatan ini membuat molekul air seperti magnet kecil yang saling tarik menarik, yang kita kenal sebagai ikatan hidrogen.
Untuk memahami perbedaan dengan ikatan non-polar, bayangkan perbedaan antara sekelompok orang yang saling berbagi makanan dengan adil (non-polar) dan sekelompok orang di mana ada satu yang selalu mengambil porsi lebih banyak (polar). Interaksi sosialnya akan sangat berbeda. Berikut perbandingannya dalam bentuk tabel.
| Aspect | Ikatan Kovalen Polar (contoh: H2O) | Ikatan Kovalen Non-Polar (contoh: CH4 – Metana) |
|---|---|---|
| Distribusi Elektron | Tidak merata; tertarik ke atom yang lebih elektronegatif. | Merata; dibagi secara setara antar atom. |
| Momen Dipol | Ada. Molekul memiliki kutub positif dan negatif. | Tidak ada. Molekul tidak berkutub. |
| Kelarutan dalam Air | Umumnya larut atau mudah bercampur. | Umumnya tidak larut (hidrofobik). |
| Contoh Sifat | Titik didih tinggi karena gaya tarik antarmolekul kuat (ikatan hidrogen). | Titik didih rendah karena gaya tarik antarmolekul lemah (gaya London). |
Ilustrasi pembentukannya begini: Atom oksigen memiliki 6 elektron di kulit terluarnya dan “ingin” 8 untuk stabil. Setiap atom hidrogen punya 1 elektron dan butuh 2 untuk stabil. Mereka pun berbagi. Setiap hidrogen menyumbang 1 elektronnya untuk dipakai bersama dengan oksigen, dan oksigen juga menyumbangkan 1 elektronnya untuk setiap hidrogen. Dari pertukaran yang saling menguntungkan ini, terbentuklah dua ikatan kovalen.
H2O, rumus kimia air yang sederhana itu, mengajarkan kita tentang konsistensi. Sama seperti Rudy yang butuh disiplin untuk Lama Menabung Rudy dengan Bunga 25% hingga Tabungan 950.000 , proses molekul air terbentuk juga memerlukan waktu dan kondisi tepat. Jadi, baik dalam sains maupun mengelola keuangan, kesabaran dan formula yang benar adalah kunci utama yang tak terbantahkan.
Oksigen sekarang dikelilingi oleh 8 elektron (stabil), dan setiap hidrogen dikelilingi 2 elektron (stabil juga). Sebuah molekul air yang sempurna lahir dari kerja sama ini.
Sifat Fisika dan Kimia Air
Air bukan sekadar cairan bening. Ia menyimpan keunikan sifat fisika dan kimia yang membuatnya benar-benar istimewa di antara jutaan senyawa di alam semesta. Keunikan inilah yang justru menjadi alasan mengapa air adalah fondasi kehidupan.
Sifat fisika air seringkali menjadi pengecualian dari aturan umum. Titik didihnya yang mencapai 100°C pada tekanan 1 atm sangat tinggi untuk molekul seukurannya. Biasanya, molekul kecil seperti itu mudah menguap. Titik bekunya 0°C juga relatif tinggi. Kapasitas kalor jenisnya yang besar—artinya butuh banyak energi untuk menaikkan suhunya—menjadikannya penyangga suhu yang handal.
Lautan dan tubuh kita tidak mudah panas atau dingin karena sifat ini.
Air sebagai Pelarut Universal
Sifat kimia air yang paling terkenal adalah kemampuannya melarutkan banyak zat, sehingga dijuluki “pelarut universal”. Ini terjadi karena sifat polar tadi. Kutub positif dan negatif pada molekul air dapat menarik dan mengelilingi ion-ion atau molekul polar lainnya, memisahkannya dari gumpalan besar.
- Zat yang Larut dalam Air: Garam dapur (NaCl), gula (C12H22O11), alkohol, asam cuka, dan berbagai vitamin. Zat-zat ini umumnya bersifat ionik atau polar.
- Zat yang Tidak Larut dalam Air: Minyak, lemak, lilin, dan senyawa hidrokarbon seperti bensin. Zat-zat ini bersifat non-polar, sehingga “takut air” atau hidrofobik.
Peran dalam Reaksi Kimia Penting
Air bukan sekadar penonton, ia adalah aktor penting dalam panggung reaksi kimia. Dua contoh vital adalah hidrolisis dan fotosintesis. Hidrolisis adalah reaksi pemutusan suatu senyawa dengan bantuan molekul air. Contoh sederhana adalah bagaimana tubuh kita memecah pati dari nasi menjadi gula sederhana. Molekul air “menyerang” ikatan pada pati, memutusnya dan memberikan H dan OH untuk melengkapi molekul gula yang terpecah.
Di sisi lain, fotosintesis adalah proses sebaliknya yang membangun kehidupan. Tumbuhan menggunakan energi matahari untuk memecah molekul air (H2O) dan mengambil elektron serta atom hidrogennya, lalu menggabungkannya dengan karbon dioksida (CO2) untuk membentuk glukosa (C6H12O6). Oksigen yang kita hirup adalah produk sampingan yang mulia dari pemecahan air ini.
Perbandingan Sifat Air dalam Tiga Fase
Air hadir dalam tiga wujud di Bumi: padat (es), cair (air), dan gas (uap air). Perubahan wujud ini bukan sekadar perubahan fisik biasa, tetapi menyangkut perubahan energi dan jarak antar molekul. Berikut tabel perbandingannya.
| Sifat | Fase Padat (Es) | Fase Cair (Air) | Fase Gas (Uap Air) |
|---|---|---|---|
| Kerapatan (Massa Jenis) | Rendah (es mengapung di air). | Tinggi (maksimal pada 4°C). | Sangat rendah. |
| Keteraturan Molekul | Sangat teratur (struktur kristal heksagonal). | Tidak teratur, tetapi molekul tetap berdekatan. | Sangat tidak teratur dan berjauhan. |
| Energi Kinetik Molekul | Sangat rendah, molekul hanya bergetar di tempat. | Sedang, molekul dapat bergerak dan berpindah. | Sangat tinggi, molekul bergerak sangat cepat dan bebas. |
| Contoh Peran di Alam | Melindungi ekosistem perairan dari pembekuan total. | Medium transportasi nutrisi, pelarut, pendukung kehidupan. | Membawa energi panas dalam siklus air, pembentuk awan. |
Peran dan Fungsi Air dalam Sistem Biologi: H2O: Rumus Kimia Air
Source: ac.id
Jika sel adalah kota yang sibuk, maka air adalah jalan raya, sistem pendingin, dan tukang bangunannya sekaligus. Hampir tidak ada proses dalam tubuh makhluk hidup yang bisa berjalan tanpa keikutsertaan molekul H2O. Dari tingkat sel hingga sistem organ, air adalah medium yang menghidupkan.
Di dalam tubuh, air berperan sebagai sistem transportasi utama. Darah, yang sebagian besarnya adalah air, mengangkut oksigen, hormon, dan nutrisi seperti glukosa dan asam amino ke setiap sel. Sebaliknya, air juga membawa sampah metabolisme seperti urea dan karbon dioksida menuju organ ekskresi (ginjal dan paru-paru) untuk dibuang. Bayangkan sungai yang mengalirkan pasokan makanan sekaligus membersihkan kotoran dari sebuah kota.
Mekanisme Regulasi Suhu Tubuh
Mamalia, termasuk manusia, adalah homeoterm; kita menjaga suhu tubuh internal yang konstan. Air adalah pahlawan di balik kemampuan ini, terutama melalui proses berkeringat. Ketika tubuh kepanasan, kelenjar keringat mengeluarkan air ke permukaan kulit. Penguapan air membutuhkan energi panas yang besar (kalor laten penguapan), dan energi ini diambil dari panas tubuh kita, sehingga kita merasa dingin.
Prinsip kunci di sini adalah kalor laten penguapan air yang tinggi. Untuk menguapkan 1 gram air pada suhu kulit, diperlukan energi sekitar 2424 Joule. Energi inilah yang “dicuri” dari tubuh untuk mendinginkannya.
Penjaga Struktur Sel dan Organel
Air tidak hanya mengisi ruang di dalam sel; ia memberikan tekanan hidrostatik yang disebut tekanan turgor pada sel tumbuhan, membuat daun dan batang tetap kaku dan segar. Di dalam sel, banyak organel dan makromolekul (seperti protein dan DNA) bergantung pada interaksi dengan molekul air untuk mempertahankan bentuk tiga dimensinya yang tepat. Bentuk ini menentukan fungsi mereka. Tanpa air yang cukup, sel akan mengerut dan struktur penting ini bisa rusak, seperti balon yang kempes.
Fungsi Air dalam Berbagai Sistem Organ, H2O: Rumus Kimia Air
Mari kita lihat lebih spesifik bagaimana air bekerja di berbagai departemen dalam tubuh:
- Sistem Pencernaan: Air dalam saliva (air liur) dan cairan lambung membantu melarutkan makanan. Ia juga menjadi medium reaksi enzimatik dan membentuk feses yang lunak untuk dikeluarkan.
- Sistem Peredaran Darah: Plasma darah terdiri dari sekitar 90% air, berfungsi sebagai medium pengangkut sel darah dan zat-zat lain, serta menjaga viskositas (kekentalan) darah yang ideal.
- Sistem Ekskresi: Di ginjal, air sangat penting untuk proses filtrasi darah. Ia melarutkan limbah nitrogen seperti urea dan membantu mengatur keseimbangan elektrolit dengan membuang kelebihan mineral melalui urin.
- Sistem Persendian: Cairan sinovial yang melumasi sendi sebagian besar adalah air, mengurangi gesekan dan memungkinkan pergerakan yang halus tanpa rasa sakit.
Air dalam Konteks Lingkungan dan Planet
Pengaruh air melampaui batas tubuh makhluk hidup. Ia adalah arsitek utama lanskap Bumi, pengatur iklim global, dan siklus abadi yang menghubungkan lautan, langit, dan daratan. Memahami peran air di tingkat planet berarti memahami bagaimana Bumi ini tetap menjadi tempat yang layak huni.
Siklus hidrologi adalah perjalanan tanpa akhir molekul air. Dimulai dengan evaporasi (penguapan) dari permukaan laut, danau, dan sungai oleh energi matahari. Transpirasi dari tumbuhan juga menyumbang uap air. Uap ini naik, mendingin, dan mengalami kondensasi menjadi titik-titik air kecil membentuk awan. Partikel-partikel ini kemudian bertabrakan dan bergabung hingga cukup berat untuk jatuh sebagai presipitasi (hujan, salju, es).
Air yang sampai di daratan bisa mengalir sebagai air permukaan (runoff) menuju badan air, atau meresap ke dalam tanah menjadi air tanah (infiltrasi), untuk kemudian kembali ke laut, menyempurnakan siklus.
Peran sebagai Penyeimbang Iklim Global
Air memiliki kapasitas menyerap dan melepaskan panas yang luar biasa. Lautan bertindak seperti baterai raksasa penyerap panas matahari, mencegah fluktuasi suhu ekstrem di siang dan malam, atau musim panas dan dingin. Arus laut kemudian mendistribusikan panas ini ke seluruh dunia. Fenomena El Niño dan La Niña adalah contoh bagaimana variasi suhu permukaan laut di Pasifik dapat mengubah pola cuaca global.
Selain itu, uap air di atmosfer adalah gas rumah kaca alami yang paling penting, yang menjaga Bumi tetap hangat. Awan juga memantulkan kembali sinar matahari ke angkasa, memberikan efek pendinginan.
Distribusi Air Tawar dan Air Asin di Bumi
Meskipun Bumi tampak biru, persediaan air yang benar-benar bisa kita gunakan secara langsung sangat terbatas. Sebagian besar air di planet ini terkunci dalam bentuk yang tidak mudah diakses. Data distribusinya membuka mata kita tentang betapa berharganya setiap tetes air tawar.
| Jenis Sumber Air | Persentase Total Air Bumi | Karakteristik & Keterjangkauan |
|---|---|---|
| Air Asin (Lautan & Laut) | ~97.5% | Tidak langsung bisa diminum atau untuk irigasi tanpa proses desalinasi yang mahal. |
| Air Tawar (Total) | ~2.5% | Seluruh persediaan air tawar dunia. |
| – Es & Gletser (Kutub & Pegunungan) | ~68.7% dari air tawar | Terkunci, belum dapat dimanfaatkan secara luas. |
| – Air Tanah | ~30.1% dari air tawar | Sumber penting untuk minum dan irigasi, tetapi banyak yang dalam. |
| – Air Permukaan (Danau, Sungai, Rawa) | ~1.2% dari air tawar | Sumber yang paling mudah diakses dan langsung digunakan oleh kehidupan. |
Interaksi molekul H2O dengan lingkungannya adalah sebuah tarian yang dinamis. Di atmosfer, molekul air dapat mengelilingi partikel debu halus (aerosol) untuk membentuk inti kondensasi awan. Di permukaan tanah, molekul air berinteraksi dengan partikel tanah dan akar tumbuhan melalui gaya adhesi dan kohesi, memengaruhi retensi air tanah. Dalam sebuah ekosistem sungai, air yang mengalir tidak hanya membawa ikan, tetapi juga mengikis batuan, mengangkut sedimen, dan membentuk habitat.
Setiap molekul terlibat dalam jaringan interaksi fisik dan kimia yang kompleks, menghubungkan geologi, biologi, dan klimatologi.
Aplikasi dan Pemanfaatan Air dalam Industri dan Teknologi
Kemampuan air yang luar biasa tidak hanya dimanfaatkan oleh alam, tetapi juga telah direkayasa oleh manusia untuk mendukung peradaban modern. Dari industri berat hingga teknologi energi bersih, air memainkan peran yang tak tergantikan, seringkali dengan prinsip-prinsip fisika dan kimia yang sama seperti yang terjadi di alam.
Salah satu penggunaan air yang paling masif adalah sebagai medium pendingin. Di pembangkit listrik tenaga termal (baik batu bara, gas, atau nuklir), uap bertekanan tinggi digunakan untuk memutar turbin. Setelah melewati turbin, uap ini harus dikondensasi kembali menjadi air untuk diumpankan ke boiler. Proses kondensasi ini membutuhkan pendinginan yang sangat besar, yang biasanya disediakan oleh air dari sungai, danau, atau menara pendingin.
Dalam industri manufaktur, air juga digunakan untuk mendinginkan mesin atau produk yang dipanaskan.
Prinsip Kerja Sel Bahan Bakar Hidrogen
Di ujung spektrum teknologi tinggi, air adalah bagian dari solusi energi masa depan. Sel bahan bakar hidrogen bekerja dengan prinsip kebalikan dari elektrolisis. Ia menggabungkan hidrogen (H2) dan oksigen (O2) dari udara untuk menghasilkan listrik, dengan produk sampingan yang ramah lingkungan: air (H2O). Reaksi intinya adalah 2H2 + O2 → 2H2O + energi listrik. Teknologi ini menggerakkan kendaraan listrik tanpa emisi, karena yang keluar dari knalpot hanyalah uap air murni.
Air di sini bukan lagi sumber daya, melainkan simbol dari siklus energi yang bersih dan berkelanjutan.
Prosedur Destilasi Air Sederhana
Untuk mendapatkan air murni dari air yang terkontaminasi, salah satu metode tertua dan paling efektif adalah destilasi. Proses ini memisahkan air dari zat terlarut berdasarkan perbedaan titik didih. Berikut langkah sederhananya:
- Siapkan alat destilasi sederhana yang terdiri dari labu didih, kondensor (bisa pipa yang didinginkan), dan labu penampung.
- Masukkan air yang akan dimurnikan ke dalam labu didih, lalu panaskan hingga mendidih (sekitar 100°C).
- Uap air murni yang terbentuk akan meninggalkan zat pengotor (mineral, garam, dll) di labu didih.
- Uap air dialirkan ke kondensor yang didinginkan (misal dengan air mengalir). Di sini, uap mengalami kondensasi menjadi cairan kembali.
- Tetesan air hasil kondensasi ini, yang sekarang merupakan air destilat (murni), ditampung di labu penampung. Zat pengotor tetap tertinggal di labu didih.
Perbandingan Metode Pengolahan Air
Destilasi hanyalah satu dari banyak cara untuk mengolah air. Setiap metode memiliki prinsip, kelebihan, dan kekurangannya sendiri, disesuaikan dengan tujuan akhir pengolahan. Berikut perbandingan beberapa metode umum.
| Metode | Prinsip Kerja | Kelebihan Utama | Kekurangan / Keterbatasan |
|---|---|---|---|
| Filtrasi (Penyaringan) | Melewatkan air melalui media berpori (pasir, kerikil, membran) untuk menyisihkan partikel padatan. | Sederhana, efektif untuk partikel besar dan keruh, biaya relatif rendah. | Tidak menghilangkan zat terlarut, bakteri, atau virus yang sangat kecil. |
| Klorinasi | Menambahkan senyawa klorin (seperti kaporit) untuk membunuh mikroorganisme patogen. | Sangat efektif membunuh bakteri & virus, memberikan sisa perlindungan dalam pipa, murah. | Dapat menghasilkan produk sampingan yang berbahaya, tidak efektif pada beberapa parasit (seperti Cryptosporidium), rasa dan bau klorin. |
| Reverse Osmosis (RO) | Memaksa air melalui membran semipermeabel bertekanan tinggi, menyaring hingga tingkat ion/molekul kecil. | Menghasilkan air dengan kemurnian sangat tinggi, menghilangkan hampir semua kontaminan (ion, logam berat, mikroba). | Membutuhkan tekanan tinggi (energi besar), menghasilkan limbah air konsentrat, menghilangkan mineral alami yang bermanfaat. |
| Penyinaran UV | Menyinari air dengan lampu ultraviolet untuk merusak DNA mikroorganisme, sehingga tidak dapat berkembang biak. | Efektif membunuh kuman tanpa menambah bahan kimia, tidak mengubah rasa atau kimia air. | Tidak memberikan sisa perlindungan, efektivitas turun jika air keruh (berpartikel), membutuhkan listrik. |
Ringkasan Penutup
Jadi, setelah menelusuri segala seluk-beluknya, H2O ternyata jauh lebih dari sekadar rumus di buku pelajaran. Dia adalah fondasi yang diam-diam bekerja, mengatur suhu Bumi, menjadi darahnya kehidupan di setiap sel, dan menjadi medium bagi revolusi industri hingga teknologi masa depan. Kesederhanaan rumusnya justru menutupi kompleksitas dan keajaiban fungsinya. Maka, lain kali meneguk segelas air, ingatlah bahwa yang kita minum adalah molekul ajaib yang menghubungkan kita dengan lautan purba, awan di langit, dan denyut nadi kehidupan di planet biru ini.
Sungguh, memahami air berarti memahami secuil esensi dari keberadaan kita sendiri.
Area Tanya Jawab
Apakah air murni (H2O) menghantarkan listrik?
Tidak, air murni yang benar-benar hanya terdiri dari molekul H2O adalah konduktor listrik yang sangat buruk karena minim ion. Air yang kita temui sehari-hari (air keran, air sumur) dapat menghantarkan listrik karena mengandung mineral dan ion terlarut.
Mengapa es mengapung di atas air?
Ini adalah sifat yang sangat unik dan langka. Saat membeku, molekul air membentuk struktur kristal yang lebih renggang daripada bentuk cairnya, sehingga es memiliki kepadatan yang lebih rendah daripada air cair dan mengapung.
Kita semua tahu H2O, rumus kimia air yang jadi sumber kehidupan. Tapi, paham nggak sih kalau memahami dunia juga butuh ‘peta’ yang tepat, kayak Perbedaan Peta Umum dan Khusus ? Sama seperti air yang punya rumus tetap, membaca peta butuh ketelitian agar kita nggak tersesat. Nah, kembali ke H2O, elemen sederhana ini mengajarkan bahwa detail dan konteks yang tepat, dalam sains maupun navigasi, adalah kunci memahami segala sesuatu dengan utuh.
Apakah ada bentuk lain dari H2O selain air, es, dan uap?
Ya, secara ilmiah ada fase lain seperti air superkritis pada suhu dan tekanan sangat tinggi. Selain itu, ada juga berbagai bentuk kristal es (seperti es heksagonal biasa dan es kubik) yang terbentuk pada kondisi tekanan berbeda.
Benarkah air memiliki “memori” seperti yang diklaim homeopati?
Tidak, klaim bahwa air dapat menyimpan “memori” atau informasi dari zat yang pernah terlarut di dalamnya tidak memiliki dasar ilmiah yang kuat dan bertentangan dengan prinsip-prinsip kimia dan fisika yang mapan tentang sifat air sebagai pelarut.
Mengapa kita merasa haus?
Rasa haus adalah mekanisme kompleks yang dipicu oleh otak saat mendeteksi peningkatan konsentrasi garam dalam darah atau penurunan volume darah, yang mengindikasikan tubuh membutuhkan lebih banyak air (H2O) untuk menjaga keseimbangan cairan dan fungsi sel.


