Menghitung massa zat: C6H12O6, Na, CH4 N2, SO2 – Menghitung massa zat: C6H12O6, Na, CH4, N2, SO2 mungkin terdengar seperti kode rahasia atau daftar belanjaan aneh, namun sebenarnya ini adalah pintu gerbang untuk memahami bahasa universal alam semesta: kimia. Bayangkan jika kita bisa mengetahui berat sebutir gula pasir, massa gas dalam balon, atau komponen penyusun udara yang kita hirup; semua misteri itu terkuak berkat perhitungan massa molar. Konsep ini bukan sekadar angka di tabel periodik, melainkan kunci untuk membongkar reaksi di tubuh kita, proses industri, hingga fenomena lingkungan.
Dari glukosa (C6H12O6) yang menjadi sumber energi sel, natrium (Na) yang reaktif, metana (CH4) dalam kompor gas, nitrogen (N2) yang mendominasi atmosfer, hingga sulfur dioksida (SO2) yang menjadi polutan, setiap zat punya “berat molekuler” yang unik. Memahami cara menghitungnya memungkinkan kita untuk mengukur dengan presisi, meramalkan hasil reaksi, dan bahkan merancang material baru. Perjalanan ini dimulai dari satuan kecil bernama mol, yang menghubungkan dunia mikroskopis atom dengan dunia makroskopis yang bisa kita timbang.
Konsep Dasar Massa Molar dan Satuan
Bayangkan kamu punya satu lusin pensil. Kita semua tahu satu lusin itu sama dengan 12 buah. Nah, di dunia partikel yang sangat kecil seperti atom dan molekul, ilmuwan juga butuh satuan “lusin” yang jumlahnya jauh lebih besar, yaitu bilangan Avogadro (6.022 x 10^23). Satuan ini disebut mol. Massa molar adalah jembatan yang menghubungkan dunia mikroskopis (atom) dengan dunia makroskopis (gram) yang bisa kita timbang.
Secara sederhana, massa molar adalah massa dari satu mol zat, dan satuannya adalah gram per mol (g/mol).
Nilai massa molar suatu unsur, dalam satuan g/mol, secara numerik sama dengan massa atom relatifnya (Ar). Perbedaannya terletak pada satuannya. Massa atom relatif (Ar) dinyatakan dalam satuan massa atom (sma), yang merupakan satuan perbandingan. Sementara itu, massa molar adalah besaran yang bisa kita ukur langsung di laboratorium menggunakan timbangan analitis. Pemahaman ini krusial sebelum kita terjun ke perhitungan.
Perbandingan Satuan Massa dan Penggunaannya
Mari kita bedah tiga satuan yang sering membingungkan: sma, g/mol, dan gram. Satuan massa atom (sma) digunakan untuk menyatakan massa satu partikel tunggal, seperti satu atom karbon. Ini terlalu kecil untuk diukur secara praktis. Massa molar (g/mol) adalah konversi yang memungkinkan kita bekerja dengan kumpulan partikel dalam jumlah yang sangat besar (mol). Sedangkan gram adalah hasil akhir dari perhitungan kita, yaitu massa fisik yang bisa kita pegang.
Singkatnya, sma untuk satu partikel, g/mol untuk konversi antara partikel dan massa, dan gram untuk hasil timbangan di lab.
| Unsur/Senyawa | Massa Atom Relatif (Ar) | Jumlah Atom dalam Rumus | Massa Molar (g/mol) |
|---|---|---|---|
| Natrium (Na) | 23 | 1 | 23 |
| Glukosa (C6H12O6) | C=12, H=1, O=16 | 6C + 12H + 6O | (6×12)+(12×1)+(6×16)=180 |
| Metana (CH4) | C=12, H=1 | 1C + 4H | 12 + (4×1)=16 |
| Nitrogen diatomik (N2) | N=14 | 2N | 2×14=28 |
| Belerang dioksida (SO2) | S=32, O=16 | 1S + 2O | 32 + (2×16)=64 |
Menghitung Massa Molar dari Rumus Kimia
Setelah paham konsepnya, sekarang kita praktek. Menghitung massa molar dari sebuah rumus kimia ibarat merakit sebuah meja dari bagian-bagiannya. Kita perlu tahu berat setiap jenis komponen (atom) dan berapa banyak masing-masing komponen itu ada. Prosesnya sistematis dan, jika dilakukan dengan teliti, hampir mustahil untuk salah.
Ambil contoh glukosa, C 6H 12O 6. Langkah pertama adalah mencari massa atom relatif setiap unsur dari tabel periodik: C=12, H=1, O=
16. Langkah kedua, kalikan masing-masing Ar dengan jumlah atomnya dalam rumus: untuk Karbon, 6 atom x 12 = 72; untuk Hidrogen, 12 atom x 1 = 12; untuk Oksigen, 6 atom x 16 =
96. Langkah terakhir, jumlahkan semua hasil perkalian itu: 72 + 12 + 96 = 180 g/mol.
Begitu pula dengan metana (CH 4), perhitungannya adalah (1×12) + (4×1) = 16 g/mol.
Perhitungan untuk Senyawa Ionik dan Poliatomik, Menghitung massa zat: C6H12O6, Na, CH4 N2, SO2
Prinsipnya tetap sama, baik untuk unsur tunggal seperti Na (23 g/mol) maupun senyawa kompleks. Untuk senyawa ionik seperti natrium karbonat (Na 2CO 3), kita perlakukan unit rumusnya (Na 2CO 3) sebagai satu kesatuan. Kita hitung: 2 atom Na (2×23=46), 1 atom C (1×12=12), dan 3 atom O (3×16=48). Massa molarnya adalah 46+12+48 = 106 g/mol. Kuncinya adalah mengidentifikasi dengan benar semua atom yang ada dalam satu unit rumus senyawa tersebut.
Meski terlihat sederhana, beberapa kesalahan sering terjadi. Berikut daftar kesalahan umum dan cara menghindarinya.
- Menggunakan Massa Atom yang Salah: Selalu gunakan nilai Ar terbaru dari tabel periodik standar. Jangan mengandalkan ingatan untuk unsur-unsur yang memiliki isotop dengan kelimpahan signifikan, seperti Klorin (Ar=35.5).
- Melupakan Indeks Bawah (Subscript): Indeks bawah menunjukkan jumlah atom. Dalam Al 2(SO 4) 3, ada 2 atom Al, 3 atom S (karena ada 3 grup SO4), dan 12 atom O (3×4). Lewatkan satu indeks, hasilnya meleset jauh.
- Tidak Menjumlahkan dengan Benar: Setelah mengalikan, lakukan penjumlahan akhir dengan cermat. Kesalahan aritmatika sederhana adalah biang kerok yang paling sering.
- Mengabaikan Satuan: Selalu tuliskan satuan “g/mol” di akhir perhitungan. Ini bukan sekadar formalitas, tapi pengingat bahwa angka yang kita dapat adalah massa per mol zat.
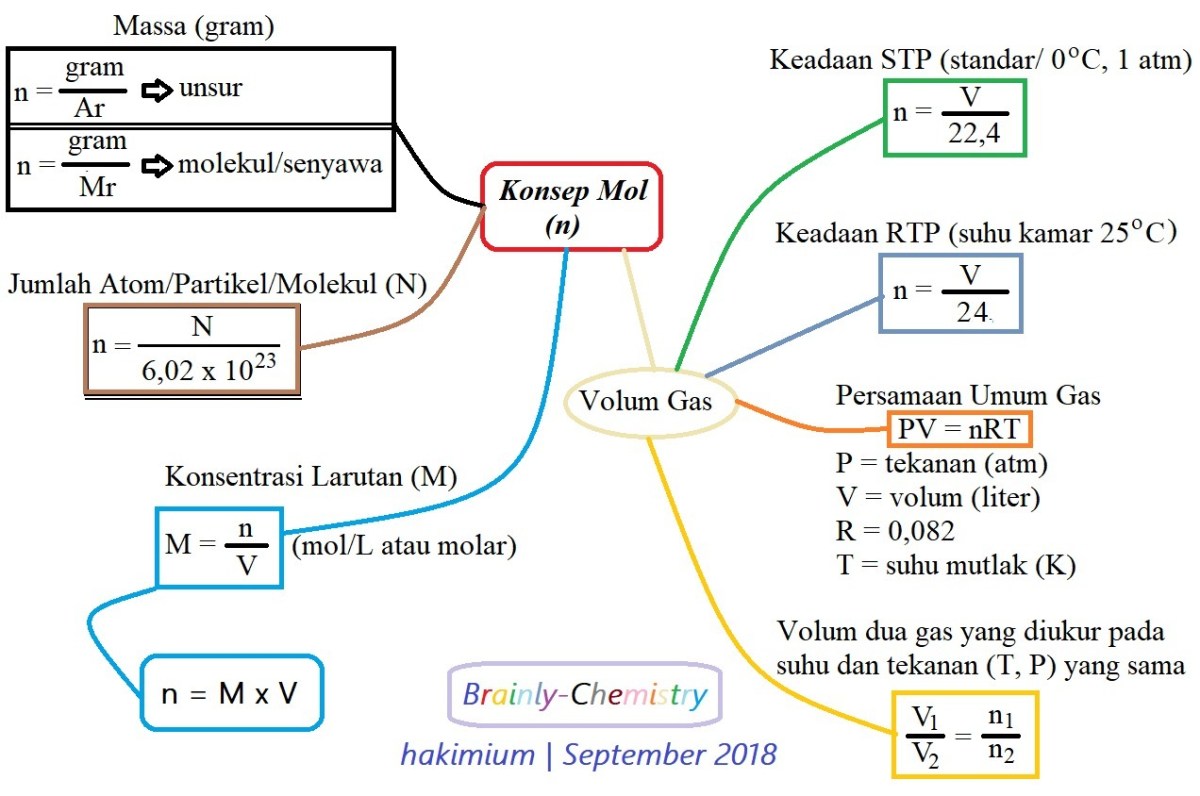
Konversi antara Mol, Massa, dan Jumlah Partikel
Inilah jantung dari perhitungan kimia: kemampuan untuk berjalan bolak-balik antara dunia partikel, mol, dan gram. Bayangkan mol sebagai sebuah wadah standar. Jika kita tahu massa satu wadah (massa molar), kita bisa tahu berapa massa dari sejumlah wadah tertentu, atau sebaliknya, berapa wadah yang ada dalam suatu timbangan massa. Konsep ini memungkinkan kita menghitung jumlah molekul dalam secangkir gula atau massa gas yang dibutuhkan untuk suatu reaksi.
Rumus dasarnya elegan dan langsung. Untuk konversi massa (gram) ke mol, gunakan: mol = massa (g) / massa molar (g/mol). Sebaliknya, untuk konversi mol ke massa: massa (g) = mol x massa molar (g/mol). Dan untuk menghubungkan dengan jumlah partikel, kita punya bilangan Avogadro (N A): Jumlah partikel = mol x NA.
Contoh Perhitungan Konversi
Mari kita lihat penerapannya dengan contoh konkret. Misalnya, kita memiliki 28 gram gas nitrogen (N 2 dengan M=28 g/mol). Berapa mol ini? Mol = 28 g / 28 g/mol = 1 mol. Sekarang, berapa massa dari 0.5 mol gas SO 2 (M=64 g/mol)?
Massa = 0.5 mol x 64 g/mol = 32 gram. Lalu, jika kita diberi tahu ada 3.011 x 10^23 molekul metana (CH 4), kita cari dulu molnya: Mol = (3.011×10^23) / (6.022×10^23) = 0.5 mol. Kemudian baru hitung massanya: 0.5 mol x 16 g/mol = 8 gram.
| Diketahui | Rumus | Contoh Perhitungan (SO2, M=64 g/mol) | Hasil |
|---|---|---|---|
| Massa (gram) | Mol = massa / M | 128 gram SO2 -> Mol = 128/64 | 2 mol |
| Mol | Massa = mol x M | 0.25 mol SO2 -> Massa = 0.25 x 64 | 16 gram |
| Jumlah Partikel | Massa = (Partikel / NA) x M | 1.204 x 1024 molekul -> Mol = (1.204×1024)/(6.022×1023) = 2 mol -> Massa = 2 x 64 | 128 gram |
Diagram Hubungan Massa, Mol, dan Partikel
Hubungan ketiganya dapat divisualisasikan sebagai sebuah segitiga yang saling terhubung. Di setiap sudut segitiga tersebut tertulis: Massa (gram), Mol, dan Jumlah Partikel. Di tengah-tengah sisi yang menghubungkan Massa dan Mol, terdapat pembagi atau pengali “Massa Molar (M)”. Di sisi yang menghubungkan Mol dan Jumlah Partikel, terdapat pembagi atau pengali “Bilangan Avogadro (N A)”. Untuk berpindah dari Massa langsung ke Jumlah Partikel (atau sebaliknya), kita harus melalui sudut Mol terlebih dahulu, dengan melakukan dua langkah konversi berurutan menggunakan kedua faktor konversi tersebut.
Diagram alur ini menegaskan bahwa mol adalah pusat dari semua konversi kuantitatif dalam kimia.
Aplikasi Perhitungan Massa dalam Reaksi Kimia
Di sinilah semua perhitungan dasar itu bersinar: dalam stoikiometri reaksi kimia. Persamaan reaksi yang setara memberikan rasio mol yang tepat antara pereaksi dan produk. Dengan massa molar, kita bisa mengubah rasio mol yang abstrak itu menjadi massa gram yang praktis. Ini seperti resep kue yang sempurna: persamaan reaksi memberitahu proporsi bahannya (mol), dan massa molar membantu kita menimbang tepung dan gula (gram) dalam jumlah yang tepat.
Penerapan ini sangat penting. Dalam industri, kesalahan perhitungan massa bisa berarti pemborosan bahan baku, produk yang tidak murni, atau bahkan reaksi yang berbahaya. Dalam laboratorium, ini adalah dasar untuk mensintesis senyawa dengan jumlah yang diinginkan. Intinya, stoikiometri adalah bahasa untuk mengkuantifikasi perubahan materi.
Contoh Soal: Berapa massa oksigen yang dibutuhkan untuk membakar sempurna 16 gram metana (CH 4) menurut reaksi: CH 4 + 2O 2 → CO 2 + 2H 2O?
Langkah Penyelesaian:
1. Tentukan mol CH 4: Mol = 16 g / 16 g/mol = 1 mol.
2. Dari persamaan, rasio CH 4 : O 2 = 1 : 2.Jadi, mol O 2 yang dibutuhkan = 2 mol.
3. Konversi mol O 2 ke massa: Massa O 2 = 2 mol x 32 g/mol = 64 gram.
Massa Molar dan Hukum Kekekalan Massa
Perhitungan stoikiometri yang akurat adalah bukti nyata dari Hukum Kekekalan Massa Lavoisier. Massa zat-zat sebelum reaksi (pereaksi) harus sama dengan massa zat-zat setelah reaksi (produk). Massa molar memungkinkan kita memverifikasi hukum ini secara kuantitatif. Dari contoh pembakaran metana di atas, kita bisa hitung: massa pereaksi = 16 g CH 4 + 64 g O 2 = 80 gram. Massa produk: 1 mol CO 2 (44 g) + 2 mol H 2O (36 g) juga sama dengan 80 gram.
Keseimbangan sempurna ini hanya bisa dibuktikan dengan menggunakan massa molar yang tepat untuk setiap senyawa yang terlibat.
Analisis Komposisi Unsur dalam Senyawa: Menghitung Massa Zat: C6H12O6, Na, CH4 N2, SO2
Setiap senyawa seperti sebuah kue yang memiliki resep komposisi tetap. Persen massa unsur memberitahu kita berapa persen dari total massa kue itu yang merupakan tepung, gula, atau mentega. Informasi ini bukan hanya teori; ini digunakan untuk menentukan kemurnian suatu sampel, merancang formula baru di industri, atau bahkan menganalisis nutrisi dalam makanan seperti kadar gula (glukosa) dalam suatu produk.
Rumus menghitung persen massa suatu unsur dalam senyawa cukup intuitif: kita bandingkan total kontribusi massa unsur tersebut dalam satu mol senyawa dengan massa molar senyawa itu sendiri, lalu kalikan dengan 100%.
% Unsur = ( (Jumlah atom unsur x Ar unsur) / Massa Molar Senyawa ) x 100%
Contoh %C dalam C 6H 12O 6:
Kontribusi total C = 6 x 12 = 72 g/mol. Massa molar glukosa = 180 g/mol.
%C = (72 / 180) x 100% = 40%.
Komposisi Unsur dalam Beberapa Zat Penting
Source: z-dn.net
Data komposisi unsur memberikan sidik jari kimiawi yang unik untuk suatu senyawa. Berikut adalah rincian untuk beberapa zat yang kita bahas.
| Zat (Rumus) | Unsur Penyusun | Kontribusi Massa per Mol (g) | Persen Massa (%) |
|---|---|---|---|
| Natrium (Na) | Na | 23 | 100% Na |
| Glukosa (C6H12O6) | Karbon (C) | 72 | 40.00% |
| Hidrogen (H) | 12 | 6.67% | |
| Oksigen (O) | 96 | 53.33% | |
| Metana (CH4) | Karbon (C) | 12 | 75.00% |
| Hidrogen (H) | 4 | 25.00% | |
| Nitrogen (N2) | Nitrogen (N) | 28 | 100% N |
| Bel. Dioksida (SO2) | Belerang (S) | 32 | 50.00% |
| Oksigen (O) | 32 | 50.00% |
Dalam kimia analitik, data persen massa seperti ini digunakan dalam berbagai teknik, seperti analisis pembakaran untuk menentukan kadar karbon dan hidrogen dalam suatu sampel organik. Di industri pupuk, perhitungan persen massa nitrogen (seperti dalam N 2 yang difiksasi menjadi amonia) sangat penting untuk menjamin kualitas produk. Dengan kata lain, memahami komposisi adalah langkah pertama untuk mengontrol dan memanfaatkan suatu material.
Massa Zat dalam Keadaan Gas (Volume Molar)
Gas punya sifat yang unik: partikel-partikelnya sangat berjauhan dan bergerak bebas. Pada kondisi suhu dan tekanan yang sama, volume yang ditempati oleh satu mol gas apa pun adalah sama. Fakta menakjubkan ini dikenal sebagai Volume Molar. Pada Kondisi Standar (STP: 0°C dan 1 atm), satu mol gas ideal menempati volume 22.4 liter. Konsep ini membuka pintu untuk konversi langsung antara massa gas dan volume yang ditempatinya, sesuatu yang tidak bisa dilakukan untuk zat padat atau cair dengan mudah.
Jadi, selain konversi massa-mol-partikel, untuk gas kita punya jalur pintas: massa ↔ mol ↔ volume (pada STP). Hubungan ini sangat berguna dalam perhitungan gas, seperti menentukan massa gas yang dihasilkan atau dibutuhkan dalam suatu reaksi.
Perhitungan Massa dari Volume Gas
Misalkan kita punya 5.6 liter gas SO 2 yang diukur pada STP. Berapa massanya? Pertama, kita cari berapa mol SO 2 dalam volume tersebut. Karena 1 mol = 22.4 L pada STP, maka mol SO 2 = 5.6 L / 22.4 L/mol = 0.25 mol. Selanjutnya, kita gunakan massa molar SO 2 (64 g/mol) untuk mengkonversi mol ke gram: Massa = 0.25 mol x 64 g/mol = 16 gram.
Proses sebaliknya, menghitung volume dari massa tertentu, juga mengikuti logika dua langkah yang sama melalui konsep mol.
Perbandingan Sifat Fisik Gas N2, CH 4, dan SO 2
Meskipun pada STP satu mol ketiganya memiliki volume yang sama (22.4 L), massa yang terkandung dalam volume itu berbeda karena perbedaan massa molarnya. Massa jenis (densitas) gas, yang didefinisikan sebagai massa per satuan volume, berbanding lurus dengan massa molarnya. Oleh karena itu:
-Nitrogen (N 2, M=28 g/mol) memiliki densitas sekitar 1.25 g/L (28/22.4).
-Metana (CH 4, M=16 g/mol) lebih ringan, densitasnya ~0.71 g/L.-Belerang dioksida (SO 2, M=64 g/mol) jauh lebih berat, densitasnya ~2.86 g/L.
Inilah mengapa gas CO 2 (M=44) bisa “ditumpuk” di dasar wadah seperti untuk pemadaman kebakaran, sementara helium (M=4) digunakan untuk mengangkat balon udara.
Simpulan Akhir
Jadi, menghitung massa zat seperti C6H12O6, Na, CH4, N2, dan SO2 jauh lebih dari sekadar latihan matematika di kelas. Ini adalah keterampilan fundamental yang menjembatani teori kimia dengan realitas. Mulai dari memastikan resep obat tepat dosis, menghitung emisi gas buang pabrik, hingga mengoptimalkan pupuk untuk pertanian, aplikasinya nyata dan luas. Dengan menguasai konsep massa molar, konversi mol, dan komposisi unsur, kita memperoleh alat untuk tidak hanya memahami, tetapi juga merancang dan mengendalikan proses kimia di sekitar kita.
Pada akhirnya, angka-angka ini bercerita tentang komposisi dunia.
Pertanyaan yang Kerap Ditanyakan
Apakah massa molar sama dengan berat molekul?
Secara numerik, nilai massa molar (dalam g/mol) sama dengan berat molekul relatif (Mr) atau massa atom relatif (Ar) untuk unsur. Bedanya, massa molar memiliki satuan (g/mol) dan menyatakan massa satu mol zat, sementara Mr/Ar adalah bilangan tak bersatuan yang menunjukkan perbandingan massa.
Mengapa dalam perhitungan massa molar C6H12O6, massa atom C dikali 6, H dikali 12, dan O dikali 6?
Karena rumus kimia C6H12O6 menunjukkan bahwa dalam satu molekul glukosa, terdapat tepat 6 atom karbon (C), 12 atom hidrogen (H), dan 6 atom oksigen (O). Massa molar adalah jumlah total massa semua atom dalam satu mol molekul tersebut.
Bagaimana cara membedakan kapan menggunakan satuan gram, sma (satuan massa atom), atau g/mol?
Gunakan gram ketika menimbang sampel zat di laboratorium (massa nyata). Satuan sma digunakan untuk menyatakan massa satu atom atau molekul tunggal (dunia mikro). g/mol (massa molar) digunakan sebagai faktor konversi antara dunia mikro (mol, jumlah partikel) dan dunia makro (gram).
Apakah massa 1 mol gas N2 sama dengan massa 1 mol gas SO2 pada suhu dan tekanan yang sama?
Tidak. 1 mol dari zat apapun selalu mengandung jumlah partikel yang sama (bilangan Avogadro), tetapi massanya berbeda karena massa molekulnya berbeda. Massa 1 mol SO2 (≈64 g) lebih berat dari 1 mol N2 (≈28 g), meski volumenya sama pada kondisi STP.
Kesalahan apa yang paling sering terjadi saat menghitung massa molar senyawa seperti Na2CO3?
Kesalahan umum meliputi: lupa mengalikan Ar dengan jumlah atom (misal, Na harus dikali 2), salah mencari nilai Ar dari tabel periodik, dan tidak menjumlahkan semua kontribusi atom dengan benar. Selalu periksa subscript (angka kecil) dalam rumus kimia.

