Massa 0,2 mol CO₂ dengan Ar C=12, O=16 menjadi sorotan utama karena memberi gambaran konkret tentang berapa gram karbon dioksida yang dihasilkan dari jumlah mol yang kecil namun signifikan dalam dunia laboratorium maupun lingkungan.
Dengan memanfaatkan nilai atom relatif C=12 dan O=16, perhitungan massa molar, konversi ke gram, persentase unsur, hingga volume pada kondisi standar (STP) dapat dijabarkan secara detail, memudahkan pembaca memahami implikasi kimia dan dampak lingkungan dari massa CO₂ tersebut.
Massa Molar CO₂ dan Konversinya
Karbon dioksida (CO₂) adalah salah satu gas utama yang dibahas dalam kimia lingkungan. Mengetahui massa molar, konversi ke gram, serta persentase unsur penyusunnya menjadi langkah penting sebelum membahas dampak atau aplikasi lebih lanjut.
Perhitungan Massa Molar CO₂
Massa molar diperoleh dengan menjumlahkan kontribusi masing‑unsur berdasarkan nilai atom relatif. Berikut rincian perhitungannya.
| Unsur | Jumlah Atom | Nilai Atom Relatif (u) | Kontribusi Massa (g/mol) |
|---|---|---|---|
| C | 1 | 12 | 12 |
| O | 2 | 16 | 32 |
| Total | 44 |
Massa molar CO₂ = 44 g mol⁻¹.
Massa 0,2 mol CO₂ dengan Ar C=12, O=16 setara dengan 8,8 gram, cukup untuk menyoroti detail kimia sederhana. Sementara itu, Klasifikasi Ras Penduduk Indonesia menjadi data penting bagi kebijakan demografis nasional. Kembali ke kimia, pemahaman massa gas tersebut membantu ilmuwan mengukur emisi secara akurat.
- Tuliskan rumus kimia CO₂.
- Kalikan jumlah atom masing‑unsur dengan nilai atom relatifnya (C = 12 u, O = 16 u).
- Jumlahkan semua kontribusi massa untuk memperoleh massa molar total.
Struktur linear CO₂ menampilkan atom karbon di tengah (12 u) yang dikelilingi dua atom oksigen (masing‑masing 16 u). Total massa molekul menjadi 44 u, setara dengan 44 g per mol.
Konversi 0,2 mol CO₂ ke Gram
Setelah massa molar diketahui, langkah selanjutnya adalah mengubah jumlah mol menjadi satuan berat yang lebih mudah dipahami.
| Mol | Massa Molar (g/mol) | Hasil (gram) | Satuan |
|---|---|---|---|
| 0,2 | 44 | 8,8 | g |
0,2 mol CO₂ setara dengan 8,8 g.
- Dapatkan massa molar CO₂ (44 g mol⁻¹).
- Kalikan massa molar dengan jumlah mol (0,2 mol × 44 g mol⁻¹).
- Hasilnya adalah 8,8 g, yang dapat langsung dipakai dalam perhitungan selanjutnya.
Perbandingan sederhana: sebelum konversi kita memiliki 0,2 mol (jumlah partikel), setelah konversi menjadi 8,8 g massa yang dapat diukur dengan neraca laboratorium.
Persentase Massa Unsur dalam CO₂
Analisis persentase memberi gambaran kontribusi masing‑unsur terhadap total massa suatu molekul.
Massa 0,2 mol CO₂ dengan Ar C=12, O=16 setara dengan 8,8 gram, cukup untuk demonstrasi kimia sederhana. Sementara itu, nilai moral manusia juga dapat diukur lewat contoh nyata; lihat 5 Contoh Akhlak Terpuji dan 5 Contoh Akhlak Tercela yang menggambarkan perilaku baik dan buruk dalam kehidupan sehari-hari. Kembali ke kimia, massa 0,2 mol CO₂ tetap menjadi acuan dasar dalam perhitungan stoikiometri.
| Unsur | Massa Atom (g/mol) | Persentase Massa (%) | Keterangan |
|---|---|---|---|
| C | 12 | 27,3 | Karbon |
| O | 32 | 72,7 | Oksigen |
CO₂ terdiri atas 27,3 % karbon dan 72,7 % oksigen berdasarkan massa.
- Hitung kontribusi massa tiap unsur (C = 12 g, O = 32 g).
- Bagi kontribusi masing‑unsur dengan massa total (44 g).
- Kalikan hasilnya dengan 100 % untuk memperoleh persentase.
Distribusi massa menunjukkan bahwa oksigen menyumbang hampir tiga perempat berat CO₂, menjelaskan mengapa gas ini memiliki kepadatan yang lebih tinggi dibandingkan dengan banyak gas lain.
Volume dan Perbandingan dengan Zat Lain
Setelah karakteristik massa diketahui, penting untuk melihat bagaimana CO₂ berperilaku dalam kondisi standar serta bagaimana massanya dibandingkan dengan zat lain yang umum.
Volume Gas CO₂ pada STP
Source: ac.id
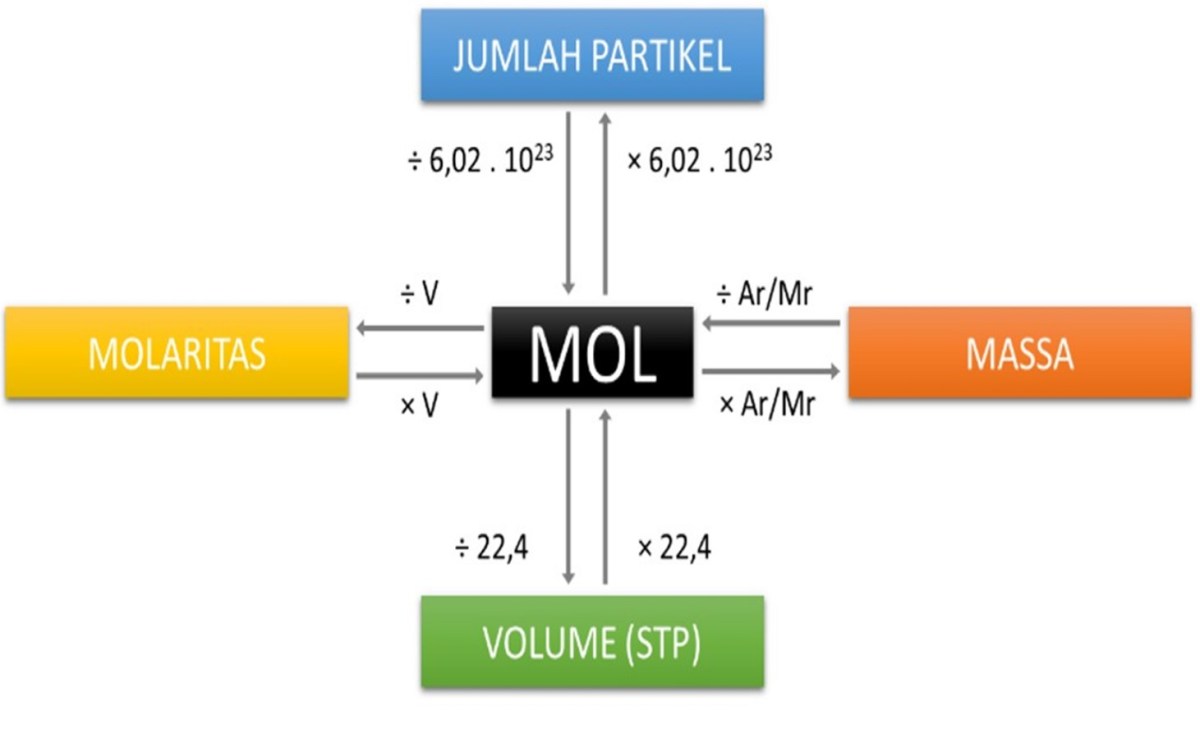
Dengan asumsi gas ideal, satu mol gas pada kondisi standar (STP) menempati 22,4 L. Menghitung volume untuk 0,2 mol CO₂ memberi gambaran praktis tentang ruang yang diperlukan.
| Mol | Kondisi (T, P) | Volume (L) | Satuan |
|---|---|---|---|
| 0,2 | 273 K, 1 atm | 4,48 | L |
0,2 mol CO₂ pada STP menempati 4,48 L.
- Gunakan persamaan PV = nRT (R = 0,0821 L·atm·mol⁻¹·K⁻¹).
- Masukkan nilai n = 0,2 mol, T = 273 K, P = 1 atm.
>Hitung V = nRT/P = 0,2 × 0,0821 × 273 ≈ 4,48 L.
Jika gas tersebut dimasukkan ke dalam tabung silinder, volume 4,48 L setara dengan kira‑kira dua kali kapasitas botol air mineral standar (2 L).
Perbandingan Massa CO₂ dengan Air (H₂O)
Air merupakan zat cair paling umum di laboratorium. Membandingkan massa CO₂ dengan massa air pada jumlah mol yang sama membantu menilai perbedaan signifikan antar zat.
| Zat | Massa Molar (g/mol) | Massa Total (g) | Catatan |
|---|---|---|---|
| CO₂ | 44 | 8,8 | 5,2 g lebih berat daripada air |
| H₂O | 18 | 3,6 |
0,2 mol CO₂ (8,8 g) lebih berat 5,2 g dibandingkan 0,2 mol air (3,6 g).
- Hitung massa molar H₂O (2 × 1 + 16 = 18 g mol⁻¹).
- Kalikan dengan 0,2 mol untuk mendapatkan 3,6 g air.
- Bandingkan dengan 8,8 g CO₂ dan selisihnya 5,2 g.
Secara konseptual, perbedaan ini dapat dibayangkan sebagai menambahkan satu setengah sendok teh gula (sekitar 6 g) ke dalam air, memperlihatkan betapa CO₂ lebih “berat” pada jumlah mol yang sama.
0,2 mol CO₂ dengan atom relatif (C=12, O=16) menghasilkan massa sekitar 8,8 gram, cukup untuk ilustrasi kimia dasar. Sementara itu, konsep Tafkhim dan Tarqiq dalam Surat Al‑Bayyinah menyoroti cara bacaan Qur’an dipertegas atau diperlunak, memberikan analogi penting bagi pemahaman detail. Kembali ke CO₂, massa 0,2 mol tetap menjadi acuan praktis bagi pelajar.
Penyusunan Persamaan Reaksi Pembakaran Karbon, Massa 0,2 mol CO₂ dengan Ar C=12, O=16
Pembakaran karbon menghasilkan CO₂ sebagai produk utama. Menyajikan persamaan lengkap memperjelas hubungan stoikiometri.
| Reaktan | Koefisien | Produk | Koefisien |
|---|---|---|---|
| C + O₂ | 1 | CO₂ | 1 |
C + O₂ → CO₂
- Tentukan zat yang terlibat: karbon (C) dan oksigen (O₂).
- Setelah pembakaran, satu atom karbon menghasilkan satu molekul CO₂.
- Seimbangkan oksigen: satu molekul O₂ menyediakan dua atom O yang diperlukan untuk CO₂.
- Koefisien semua zat tetap 1, sehingga persamaan sudah seimbang.
Alur energi dapat dibayangkan sebagai karbon yang menyerap oksigen, melepaskan energi panas, dan menghasilkan molekul CO₂ yang lebih stabil.
Dampak Lingkungan CO₂
Meskipun 0,2 mol CO₂ tampak kecil, menilai implikasinya pada skala mikro membantu memahami kontribusi kumulatif pada emisi global.
Evaluasi Dampak Massa CO₂ terhadap Lingkungan
8,8 g CO₂ dapat dikonversi ke ekuivalen emisi kendaraan untuk memberi konteks praktis.
| Gram CO₂ | Ekuivalen km Mobil | Potensi Dampak | Keterangan |
|---|---|---|---|
| 8,8 | ≈0,07 km | Rendah | Setara dengan perjalanan 70 m mobil rata‑rata |
8,8 g CO₂ setara dengan emisi yang dihasilkan saat mobil menempuh sekitar 70 meter.
- Rata‑rata mobil menghasilkan ~120 g CO₂ per kilometer.
- Bagilah 8,8 g dengan 120 g/km untuk memperoleh jarak ekuivalen (≈0,07 km).
- Interpretasi: pada skala rumah tangga, emisi sebesar ini tergolong sangat ringan.
Visualisasi konseptual: bayangkan asap tipis yang keluar dari cerobong kecil selama beberapa detik—meskipun volumenya tampak minor, akumulasi seratusnya akan berkontribusi pada peningkatan konsentrasi CO₂ atmosfer.
Ringkasan Penutup: Massa 0,2 mol CO₂ Dengan Ar C=12, O=16
Kesimpulannya, 0,2 mol CO₂ dengan Ar C=12, O=16 menghasilkan sekitar 8,8 gram gas yang tidak hanya penting dalam perhitungan stoikiometri, tetapi juga menjadi acuan dalam menilai jejak karbon pada skala kecil, sekaligus mengingatkan pentingnya pengendalian emisi di setiap aktivitas ilmiah.
Panduan Pertanyaan dan Jawaban
Berapa gram CO₂ yang dihasilkan dari 0,2 mol?
Dengan massa molar CO₂ sebesar 44 g/mol, 0,2 mol menghasilkan 8,8 gram CO₂.
Berapa volume gas CO₂ pada STP untuk 0,2 mol?
Pada STP, 1 mol gas menempati 22,4 L, sehingga 0,2 mol CO₂ menempati sekitar 4,48 L.
Bagaimana cara menghitung persentase massa unsur dalam CO₂?
Persentase massa karbon = (12 g / 44 g) × 100 ≈ 27,3 %; persentase massa oksigen = (32 g / 44 g) × 100 ≈ 72,7 %.
Apa perbandingan massa 0,2 mol CO₂ dengan 0,2 mol air?
0,2 mol air (molar mass 18 g/mol) memiliki massa 3,6 gram, sehingga CO₂ lebih berat sekitar 5,2 gram.

