Menentukan Rumus Molekul Oksida Nitrogen dari Volume Gas itu seperti menyelesaikan teka-teki kimia klasik yang elegan, di mana setiap mililiter gas yang terukur bercerita tentang pertemuan atom nitrogen dan oksigen. Bayangkan kita menjadi detektif di lab abad ke-19, hanya berbekal tabung gas dan hukum alam yang sederhana, berusaha mengungkap identitas senyawa misterius yang terbentuk. Prinsip yang mendasarinya, hukum perbandingan volume Gay-Lussac, ternyata adalah kunci emas yang menghubungkan dunia makroskopik volume gas dengan dunia mikroskopik rumus molekul, sebuah jembatan menakjubkan antara apa yang bisa kita lihat dan apa yang ingin kita ketahui.
Eksperimen ini berdiri di atas fondasi yang kokoh: pada suhu dan tekanan yang sama, volume gas-gas yang bereaksi dan hasil reaksi berbanding sebagai bilangan bulat sederhana. Artinya, jika kita dengan cermat mencampur nitrogen dan oksigen dalam berbagai proporsi dan mengukur volume gas oksida yang dihasilkan—atau volume sisa yang tak bereaksi—deretan angka itu akan membisikkan perbandingan atom penyusunnya. Melalui set-up aparatus yang cermat, pengukuran yang teliti, dan analisis stoikiometri yang runut, data volume mentah itu akhirnya akan mengkristal menjadi rumus molekul yang pasti, apakah itu N₂O, NO, atau NO₂.
Proses ini bukan sekadar hitung-hitungan, melainkan penerapan logika murni pada fenomena alam.
Menelusuri Jejak Eksperimen Klasik Penentuan Rumus Oksida Nitrogen Melalui Data Volume
Bayangkan kita hidup di awal abad ke-19, di era dimana konsep atom dan molekul masih samar-samar, namun para ilmuwan sudah gemar bereksperimen dengan gas. Joseph Louis Gay-Lussac adalah salah satu pionirnya. Ia menemukan pola menarik: ketika gas-gas bereaksi, volume-volume mereka selalu memiliki perbandingan bilangan bulat sederhana, asalkan diukur pada suhu dan tekanan yang sama. Prinsip inilah yang kita kenal sebagai Hukum Perbandingan Volume Gay-Lussac.
Menentukan rumus molekul oksida nitrogen dari data volume gas adalah puzzle kimia yang memuaskan, mengasah logika dan ketelitian analitis. Keterampilan analitis serupa juga sangat berharga dalam linguistik, misalnya saat mengeksplorasi Manfaat Mempelajari Fonetik dan Fonologi untuk memahami bunyi bahasa secara mendalam. Nah, kembali ke lab, pendekatan sistematis dalam menganalisis volume gas itulah kunci untuk mengungkap identitas senyawa nitrogen yang misterius.
Prinsip sederhana namun powerful ini menjadi landasan utama untuk menguak rahasia rumus molekul berbagai senyawa gas, termasuk oksida nitrogen, jauh sebelum kita mengenal bilangan Avogadro atau massa atom modern.
Eksperimen menentukan rumus oksida nitrogen secara klasik sangat elegan karena mengandalkan pengukuran kuantitatif yang langsung. Prinsipnya, kita mencampurkan dua gas, nitrogen (N₂) dan oksigen (O₂), dalam suatu wadah bertutup yang dilengkapi dengan pengukur volume, seperti eudiometer. Gas-gas tersebut kemudian dibiarkan bereaksi, seringkali dengan bantuan percikan listrik untuk memicu reaksi. Setelah reaksi selesai, volume campuran gas yang tersisa diukur. Dengan cermat menganalisis perubahan volume ini—volume mana yang berkurang, volume produk apa yang terbentuk, dan apakah ada sisa gas yang tak bereaksi—kita dapat menyusun perbandingan volume reaktan dan produk.
Perbandingan volume ini, menurut Gay-Lussac, langsung mencerminkan perbandingan jumlah molekul yang bereaksi, yang pada akhirnya mengarah pada koefisien dalam persamaan reaksi yang setara.
Karakteristik Reaksi Nitrogen dan Oksigen
Nitrogen dan oksigen dapat membentuk beberapa senyawa oksida yang berbeda, tergantung pada kondisi perbandingan awal dan energi yang diberikan. Reaksi-reaksi ini menunjukkan pola volume yang unik dan menjadi kunci identifikasi.
| Kondisi Reaksi | Persamaan Reaksi (dalam Volume) | Oksida Nitrogen yang Terbentuk | Pola Perubahan Volume |
|---|---|---|---|
| Kelebihan Nitrogen | 1 vol N₂ + 1 vol O₂ → 2 vol NO | Nitrogen Monoksida (NO) | Volume total tetap (2 vol menjadi 2 vol). |
| Oksigen Berlebih & Suhu Tinggi | 2 vol N₂ + 1 vol O₂ → 2 vol N₂O | Dinitrogen Oksida (N₂O) | Volume menyusut (3 vol menjadi 2 vol). |
| Lingkungan Beroksigen dengan Katalis | 1 vol N₂ + 2 vol O₂ → 2 vol NO₂ | Nitrogen Dioksida (NO₂) | Volume menyusut (3 vol menjadi 2 vol), produk berwarna coklat. |
Deskripsi Aparatus Percobaan Klasik
Eksperimen ini biasanya dilakukan menggunakan sebuah eudiometer, yaitu sebuah tabung kaca panjang yang dikalibrasi dengan skala volume, salah satu ujungnya tertutup dan ujung lainnya terbuka yang dapat dicelupkan ke dalam wadah berisi air atau raksa. Tabung ini diisi dengan merkuri terbalik di atas palung merkuri. Sejumlah volume oksigen murni pertama-tama dimasukkan ke dalam tabung dengan hati-hati, volumenya dicatat tepat. Selanjutnya, nitrogen murni dimasukkan dengan metode serupa, dan volumenya juga dicatat.
Dengan demikian, kita memiliki kolom gas yang merupakan campuran N₂ dan O₂ di dalam tabung yang tercelup dalam merkuri. Dua elektroda kemudian dimasukkan ke bagian atas tabung untuk menghasilkan percikan listrik yang akan memicu reaksi antara nitrogen dan oksigen. Setelah percikan diberikan dan reaksi terjadi, tabung dibiarkan hingga suhu kembali ke kondisi awal. Volume akhir dari campuran gas yang tersisa dalam tabung kemudian dibaca pada skala.
Perbedaan antara volume awal campuran dan volume akhir, serta sifat fisik produk (seperti munculnya warna coklat untuk NO₂), memberikan data krusial untuk analisis.
Langkah Demi Langkah Perhitungan Stoikiometri Gas, Menentukan Rumus Molekul Oksida Nitrogen dari Volume Gas
Misalkan dari suatu percobaan, kita mencampurkan 40 mL gas nitrogen dengan 60 mL gas oksigen. Setelah reaksi selesai, volume total gas yang tersisa adalah 80 mL, dan ketika gas ini dilewatkan ke dalam larutan yang dapat menyerap oksida nitrogen, volume menyusut menjadi 20 mL (yang merupakan sisa oksigen). Dari data ini, kita bisa bekerja mundur.
Pertama, tentukan volume oksigen yang bereaksi. Volume oksigen awal 60 mL, sisa 20 mL, maka volume O₂ yang bereaksi adalah 40 mL. Kedua, tentukan volume oksida nitrogen yang terbentuk. Volume total setelah reaksi adalah 80 mL, terdiri dari oksida nitrogen + sisa O₂. Karena sisa O₂ 20 mL, maka volume oksida nitrogen adalah 60 mL.
Ketiga, karena semua nitrogen habis bereaksi (tidak ada informasi sisa N₂), volume N₂ yang bereaksi adalah 40 mL (semua volume awal). Maka, perbandingan volume yang bereaksi adalah: N₂ : O₂ : Oksida Nitrogen = 40 : 40 :
60. Sederhanakan dengan membagi 20, menjadi 2 : 2 : 3.
Volume N₂ : O₂ : Produk = 40 mL : 40 mL : 60 mL = 2 : 2 : 3
Ini mengindikasikan reaksi: 2 vol N₂ + 2 vol O₂ → 3 vol (Oksida Nitrogen).
Dari perbandingan 2:2:3, kita cari bilangan bulat sederhana untuk koefisien. Jika kita bagi semua dengan 2, kita dapatkan 1:1:1.
5. Untuk menghilangkan desimal, kalikan 2, menjadi 2:2:
3. Jadi, persamaan reaksi dalam volume adalah 2 volume N₂ + 2 volume O₂ → 3 volume produk.
Untuk memenuhi hukum kekekalan atom, rumus oksida yang mungkin adalah N₂O₃ (dinitrogen trioksida), karena 2 molekul N₂ mengandung 4 atom N dan 2 molekul O₂ mengandung 4 atom O, yang jika membentuk 3 molekul N₂O₃, totalnya menjadi 6 atom N dan 9 atom O—tidak cocok. Analisis lebih lanjut dengan mempertimbangkan rumus molekul sederhana dari perbandingan 2:2:3 mengarah pada kebutuhan untuk menulis ulang persamaan menjadi N₂ + O₂ → NO?
Perbandingan volume ini membutuhkan interpretasi lebih lanjut dengan bantuan hipotesis Avogadro.
Mengurai Kompleksitas Stoikiometri Gas dari Data Volume Menuju Rumus Molekul yang Tepat
Data volume dari percobaan gas bukan sekadar angka; ia adalah cerita yang menunggu untuk diartikan. Setiap penurunan volume, setiap gas yang tersisa, adalah petunjuk forensik yang mengarah pada identitas senyawa yang terbentuk. Kunci utamanya terletak pada identifikasi pereaksi pembatas dalam fase gas dan interpretasi volume produk relatif terhadap volume reaktan yang bereaksi. Misalnya, jika setelah reaksi kita menemukan adanya gas sisa, dan gas sisa itu ternyata dapat dibakar atau memiliki sifat tertentu, kita bisa tahu apakah itu nitrogen atau oksigen yang berlebih.
Informasi ini, dikombinasikan dengan hukum perbandingan volume, mempersempit kemungkinan rumus oksida nitrogen yang terbentuk secara signifikan.
Interpretasi menjadi lebih kuat ketika kita menghubungkannya dengan konsep mol dan volume molar. Hipotesis Avogadro menyatakan bahwa pada suhu dan tekanan yang sama, volume gas yang sama mengandung jumlah molekul yang sama. Ini adalah jembatan emas antara dunia makroskopik (volume yang kita ukur) dan dunia mikroskopik (jumlah molekul dan rumus kimia). Dengan demikian, perbandingan volume gas yang bereaksi sama dengan perbandingan jumlah molekulnya, yang juga sama dengan perbandingan koefisien dalam persamaan reaksi setara.
Inilah mengapa dari data volume 20 mL N₂ dan 60 mL O₂ yang bereaksi menghasilkan 40 mL oksida, kita langsung dapat menuliskan rasio koefisien reaksi sebagai 2:6:4 atau yang lebih sederhana.
Contoh Data Volume dan Rumus Oksida yang Mungkin
Berikut adalah beberapa skenario data hipotetis dari percobaan serupa dan interpretasi awalnya. Perlu diingat, analisis akhir membutuhkan konfirmasi lebih lanjut.
| Volume Awal (N₂ : O₂) | Volume Akhir Campuran | Volume Sisa Setelah Penyerapan Produk | Rumus Oksida yang Diduga |
|---|---|---|---|
| 30 mL : 30 mL | 60 mL | 0 mL (tidak ada sisa) | NO (perbandingan 1:1, volume tetap) |
| 50 mL : 25 mL | 50 mL | 0 mL (tidak ada sisa) | N₂O (perbandingan 2:1, volume menyusut) |
| 20 mL : 60 mL | 60 mL | 20 mL (sisa O₂) | NO₂ (O₂ berlebih, pola volume sesuai) |
| 40 mL : 40 mL | 60 mL | 10 mL (sisa O₂) | Campuran atau senyawa lain seperti N₂O₃ |
Penerapan Kondisi Standar (STP) dalam Konversi Volume
Dalam praktiknya, percobaan jarang dilakukan tepat pada kondisi STP (0°C, 1 atm). Oleh karena itu, konversi volume yang diukur ke kondisi STP seringkali diperlukan untuk perhitungan yang akurat dan dapat dibandingkan, terutama jika kita ingin menghitung jumlah mol gas secara langsung menggunakan volume molar (22.4 L/mol pada STP). Konversi ini menggunakan Hukum Gas Gabungan.
- Rumus Konversi: (P₁ × V₁) / T₁ = (P₂ × V₂) / T₂, dengan T dalam Kelvin.
- Contoh Ilustrasi: Misalkan kita mengukur 100 mL gas oksida nitrogen pada suhu 27°C (300 K) dan tekanan 0.95 atm. Berapa volumenya pada STP (0°C/273 K, 1 atm)?
- Perhitungan: V₂ = (P₁ × V₁ × T₂) / (T₁ × P₂) = (0.95 atm × 100 mL × 273 K) / (300 K × 1 atm) ≈ 86.45 mL.
- Volume 86.45 mL pada STP ini kemudian dapat digunakan untuk menghitung mol gas dengan membagi 22,400 mL/mol, memberikan hasil yang lebih universal.
Peran Konsep Mol dan Volume Molar
Konsep mol dan volume molar adalah penerjemah resmi antara data laboratorium dan persamaan kimia. Setelah kita mendapatkan volume gas pada kondisi standar, langkah selanjutnya adalah mengubah volume tersebut menjadi mol. Ini dilakukan dengan membagi volume STP dengan volume molar (22.4 L/mol). Dari jumlah mol setiap gas yang bereaksi, kita mendapatkan perbandingan mol yang paling sederhana, yang langsung merupakan perbandingan koefisien dalam persamaan reaksi.
Misalnya, jika analisis menunjukkan 0.002 mol N₂ bereaksi dengan 0.004 mol O₂ menghasilkan 0.004 mol oksida nitrogen, maka perbandingan molnya adalah 1:2:
2. Persamaan reaksinya menjadi: 1 N₂ + 2 O₂ → 2 (Oksida Nitrogen). Untuk menyeimbangkan atom, setiap molekul oksida harus mengandung 1 atom N dan 2 atom O, sehingga rumusnya adalah NO₂. Proses ini mengubah data fisik menjadi informasi kimia yang definitif.
Strategi Pemecahan Masalah untuk Mengidentifikasi Rumus Berdasarkan Variasi Data Volume
Menghadapi data volume dari percobaan reaksi gas bisa terasa seperti menyelesaikan puzzle. Kuncinya adalah memiliki pendekatan sistematis yang memandu kita dari data mentah menuju kesimpulan yang logis. Langkah pertama dan terpenting adalah menentukan pereaksi pembatas dalam fase gas. Ini dilakukan dengan membandingkan perbandingan volume gas yang tersedia dengan perbandingan volume gas yang seharusnya bereaksi menurut suatu persamaan reaksi hipotetis. Gas yang secara teoritis habis lebih dahulu itulah pereaksi pembatas.
Volume gas yang tersisa setelah reaksi adalah kunci untuk mengidentifikasi gas mana yang berlebih dan berapa volumenya yang bereaksi. Dari sini, kita hanya fokus pada volume reaktan yang benar-benar bereaksi dan volume produk yang terbentuk untuk mencari perbandingan bilangan bulat sederhana.
Pendekatan ini memungkinkan kita mengatasi skenario data yang tampaknya kompleks. Misalnya, ketika kedua gas memiliki sisa, atau ketika volume produk lebih kecil dari volume salah satu reaktan. Dengan metode yang terstruktur, kita dapat mengurai kompleksitas tersebut langkah demi langkah, memastikan tidak ada informasi yang terlewatkan dan setiap asumsi dapat dipertanggungjawabkan secara stoikiometri.
Skenario Masalah dan Strategi Analisis Awal
| Skenario Data Volume | Pertanyaan Kunci | Strategi Analisis Awal | Tujuan |
|---|---|---|---|
| Ada sisa gas, tapi jenisnya belum diketahui. | Gas mana yang sisa? N₂ atau O₂? | Lakukan tes kimia sederhana pada gas sisa (misal, mendekatkan bara api, O₂ akan menyala lebih terang). | Identifikasi pereaksi berlebih secara eksperimen. |
| Volume produk sama dengan volume salah satu reaktan. | Apakah ini kebetulan atau pola stoikiometri? | Hitung selisih volume reaktan yang bereaksi. Cari hubungannya dengan volume produk. | Mencari pola perbandingan volume yang sederhana. |
| Volume akhir lebih kecil dari jumlah volume awal. | Mengapa terjadi penyusutan? | Bukti kuat bahwa jumlah molekul produk lebih sedikit dari reaktan. Hitung total koefisien reaktan dan produk. | Mengkonfirmasi reaksi dengan rasio molekul seperti 2:1:2 atau 1:2:2. |
| Tidak ada sisa gas, tapi perbandingan volume awal tidak bulat. | Apakah data pengukuran akurat? | Ulangi perhitungan perbandingan volume reaktan. Cari bilangan bulat terdekat yang mungkin. | Memastikan keakuratan data sebelum interpretasi. |
Contoh Naratif Proses Penalaran
Mari ikuti proses berpikir seorang analis. Dalam sebuah percobaan, 60 mL gas nitrogen dicampur dengan 90 mL gas oksigen. Setelah reaksi, volume campuran menjadi 105 mL. Gas sisa dalam campuran tersebut kemudian diuji dan ternyata merupakan oksigen. Ketika seluruh oksida nitrogen dalam campuran diserap oleh suatu reagen, volume gas yang tersisa adalah 45 mL.
Bagaimana kita menentukan rumus oksida yang terbentuk?
Pertama, kita tahu sisa 45 mL adalah oksigen. Volume O₂ awal 90 mL, jadi volume O₂ yang bereaksi adalah 90 mL – 45 mL = 45 mL. Kedua, volume total setelah reaksi 105 mL terdiri dari oksida nitrogen + sisa O₂ (45 mL). Jadi, volume oksida nitrogen yang terbentuk adalah 105 mL – 45 mL = 60 mL. Ketiga, semua nitrogen habis bereaksi (tidak disebutkan sisa N₂), jadi volume N₂ yang bereaksi adalah 60 mL.
Sekarang kita punya data inti: Volume N₂ bereaksi : O₂ bereaksi : Produk = 60 mL : 45 mL : 60 mL.
Rasio = 60 : 45 :
Bagi dengan 15, kita dapatkan 4 : 3 : 4.
Ini berarti: 4 volume N₂ + 3 volume O₂ → 4 volume (Oksida Nitrogen).
Rasio 4:3:4 sangat menarik. Dalam bentuk persamaan reaksi, ini bisa ditulis sebagai 4N₂ + 3O₂ → 4(NOₓ). Untuk menyeimbangkan atom, kita lihat sisi kiri: 8 atom N dan 6 atom O. Sisi kanan (4 molekul produk) harus memiliki total yang sama. Jadi, setiap molekul produk harus mengandung 2 atom N (8/4) dan 1.5 atom O (6/4).
Karena rumus molekul harus bilangan bulat, kita kalikan semua koefisien dengan 2: 8N₂ + 6O₂ → 8(NOₓ). Sekarang, sisi kiri: 16 N, 12 O. Sisi kanan (8 molekul): setiap molekul harus memiliki 2 atom N (16/8) dan 1.5 atom O (12/8) — masih setengah! Ini mengindikasikan bahwa produknya mungkin bukan satu senyawa murni, atau oksida yang terbentuk adalah N₂O₃ (dimana setiap molekul memiliki 2 N dan 3 O).
Untuk rasio 4:3:4, jika produknya N₂O₃, persamaannya menjadi 4N₂ + 6O₂ → 4N₂O₃, yang tidak cocok karena O₂ yang dibutuhkan 6 volume, bukan 3. Analisis lebih mendalam diperlukan, mungkin melibatkan kemungkinan terbentuknya campuran NO dan NO₂.
Sumber Kesalahan Umum dalam Pengukuran Volume Gas
Beberapa sumber kesalahan dapat memengaruhi keakuratan interpretasi rumus molekul. Pertama, ketidaktepatan dalam mengukur volume awal dan akhir, terutama jika meniskus cairan (air atau raksa) tidak dibaca pada titik yang konsisten. Kedua, asumsi bahwa suhu dan tekanan benar-benar konstan sebelum dan setelah reaksi; reaksi eksotermik dapat memanaskan gas secara singkat dan mengubah volumenya. Ketiga, kelarutan gas produk dalam cairan penampung (misalnya, NO₂ dapat larut dalam air), yang menyebabkan volume yang terukur lebih kecil dari yang sebenarnya terbentuk.
Keempat, reaksi tidak berjalan sempurna atau menghasilkan campuran beberapa oksida, sehingga data volume yang diperoleh merupakan rata-rata dari beberapa reaksi. Kesalahan-kesalahan ini dapat menggeser perbandingan volume dari bilangan bulat sederhana, mengaburkan petunjuk dan berpotensi menyebabkan penentuan rumus molekul yang keliru.
Aplikasi Prinsip Avogadro dalam Validasi Rumus Oksida Nitrogen Hasil Analisis Volume
Setelah melalui perhitungan stoikiometri yang rumit, kita mungkin mendapatkan sekumpulan perbandingan bilangan bulat. Namun, apa yang menjamin bahwa perbandingan volume ini benar-benar mewakili perbandingan molekul? Di sinilah kejeniusan Amedeo Avogadro berperan. Hipotesis Avogadro, yang kini telah menjadi prinsip fundamental, menyatakan bahwa pada suhu dan tekanan yang sama, volume gas-gas yang berbeda tetapi sama volumenya mengandung jumlah partikel (molekul) yang sama.
Menentukan rumus molekul oksida nitrogen dari data volume gas itu seperti memecahkan teka-teki kimia yang seru, lho. Nah, proses menjelaskan langkah-langkah perhitungannya secara runut dan jelas itu sendiri merupakan penerapan dari Pengertian Tulisan Eksposisi. Dengan menguasai teknik eksposisi, kita bisa menyajikan analisis perbandingan volume dan penentuan rumus empiris ini dengan lebih sistematis, sehingga hasil akhirnya pun mudah dipahami dan dipertanggungjawabkan secara ilmiah.
Prinsip inilah yang memberikan justifikasi teoretis mengapa hukum Gay-Lussac bekerja. Ia menjadi validator utama: jika perbandingan volume reaksi gas adalah bilangan bulat sederhana, maka perbandingan jumlah molekulnya juga pasti bilangan bulat sederhana yang sama. Ini membuktikan bahwa analisis volume kita tidak hanya permainan matematika, tetapi benar-benar mencerminkan realitas di tingkat molekuler.
Dengan prinsip Avogadro, data volume tidak hanya membawa kita ke rumus empiris (perbandingan atom paling sederhana), tetapi juga dapat mengusulkan rumus molekul yang sebenarnya. Misalnya, dari suatu percobaan kita mendapatkan perbandingan volume N₂:O₂:Produk = 1:1:
2. Ini mengarah pada persamaan N₂ + O₂ → 2(NOₓ). Untuk menyeimbangkan, (NOₓ) harus berupa NO. Jadi, rumus molekulnya adalah NO.
Namun, bagaimana dengan N₂O? Perbandingan volumenya adalah 2:1:2 (2N₂ + O₂ → 2N₂O). Kedua pola ini unik dan dapat dibedakan dengan data volume yang cermat. Dengan demikian, eksperimen volume menjadi alat yang ampuh untuk membedakan senyawa-senyawa seperti NO, N₂O, dan NO₂ hanya berdasarkan pola perubahan volumenya.
Dari Volume ke Rumus Empiris dan Molekul
Langkah kritis adalah menghubungkan rasio volume dengan rasio atom. Karena satu molekul N₂ mengandung 2 atom N, dan satu molekul O₂ mengandung 2 atom O, rasio volume yang kita ukur harus dikalikan dengan 2 untuk mendapatkan rasio atom sebenarnya dalam produk. Contoh: Jika perbandingan volume N₂:O₂ yang bereaksi adalah 1:2, maka perbandingan atom N:O dalam produk adalah (1×2) : (2×2) = 2:4 = 1:2.
Rumus empirisnya adalah NO₂. Apakah rumus molekulnya pasti NO₂? Bisa jadi, atau bisa juga N₂O₄, yang memiliki rasio atom yang sama. Untuk membedakannya, diperlukan data tambahan seperti massa molar. Namun, untuk banyak oksida nitrogen sederhana, rumus empiris sering sama dengan rumus molekulnya (NO, NO₂, N₂O).
Implikasi Rumus Molekul terhadap Sifat Oksida Nitrogen
- N₂O (Dinitrogen Monoksida): Rasio volume pembentukannya 2:1. Molekulnya linier (N-N-O). Bersifat sebagai oksidator ringan, dikenal sebagai gas tertawa, dan relatif inert pada suhu kamar.
- NO (Nitrogen Monoksida): Rasio volume 1:1. Molekul diatomik. Gas tak berwarna yang sangat reaktif, berperan penting dalam biologi sebagai signaling molecule, dan mudah teroksidasi menjadi NO₂ di udara.
- NO₂ (Nitrogen Dioksida): Rasio volume 1:2 (dari N₂). Molekulnya berbentuk bengkok. Gas berwarna coklat kemerahan, beracun, dan merupakan polutan utama yang berkontribusi pada kabut asap dan hujan asam. Dimerisasi menjadi N₂O₄ pada suhu rendah.
Ilustrasi Konseptual Pembentukan Molekul Oksida Nitrogen
Bayangkan sebuah ruang tertutup yang penuh dengan molekul dinamis: pasangan dua atom nitrogen (N₂) yang bergerak cepat dan pasangan dua atom oksigen (O₂). Ketika energi percikan listrik diberikan, ikatan dalam beberapa molekul ini terputus. Atom-atom yang bebas ini kemudian mencari pasangan baru. Jika kita memiliki satu kotak berisi molekul N₂ dan satu kotak berisi molekul O₂ dengan volume yang sama (misal, masing-masing 10 kotak), saat bereaksi, setiap pasangan N₂ dan O₂ akan bertukar pasangan membentuk dua molekul baru yang terdiri dari satu atom N dan satu atom O (NO).
Hasilnya, dari 10 kotak N₂ dan 10 kotak O₂, kita akan mendapatkan tepat 20 kotak NO. Volume total tetap 20 kotak. Sekarang, ubah perbandingannya: dua kotak N₂ untuk setiap satu kotak O₂. Dalam skenario ini, dua molekul N₂ (mengandung 4 atom N) akan berbagi satu molekul O₂ (2 atom O) untuk membentuk dua molekul baru dimana dua atom N berikatan dengan satu atom O (N₂O).
Terlihat bahwa dari 3 kotak awal (2 N₂ + 1 O₂), kita hanya mendapatkan 2 kotak produk. Volume menyusut, dan rumus molekulnya berbeda. Inilah keindahan yang terungkap dari data volume yang tampak sederhana.
Kesimpulan: Menentukan Rumus Molekul Oksida Nitrogen Dari Volume Gas
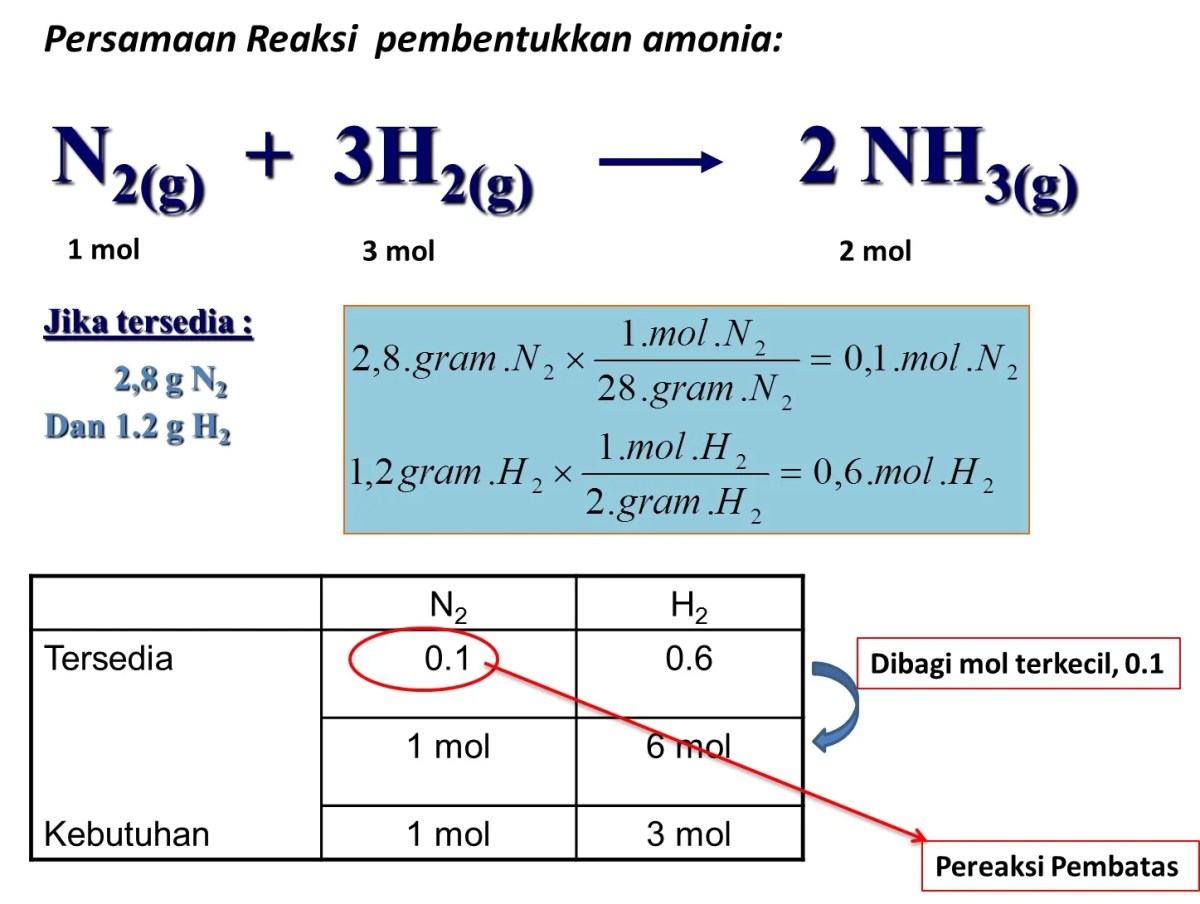
Source: materikimia.com
Jadi, perjalanan dari gelembung gas dalam tabung eudiometer hingga sekumpulan huruf dan angka subskrip pada rumus molekul benar-benar menunjukkan keindahan kimia yang rasional. Analisis volume gas untuk menentukan rumus oksida nitrogen mengajarkan bahwa pola-pola sederhana di alam—seperti hukum perbandingan volume—dapat menjadi petunjuk kuat untuk menguak struktur materi yang tak terlihat. Setiap rumus yang berhasil diidentifikasi bukanlah akhir, melainkan pintu gerbang untuk memahami sifat yang lebih kompleks, dari sifat racun NO₂ hingga efek anestetik N₂O.
Metode klasik ini, meski tampak sederhana, tetap menjadi bukti abadi tentang bagaimana pemikiran deduktif dan eksperimen yang dirancang dengan baik dapat menjawab pertanyaan mendasar dalam sains: apa sebenarnya penyusun dunia ini?
Tanya Jawab Umum
Apakah metode ini hanya berlaku untuk oksida nitrogen?
Tidak, prinsip dasar ini berlaku universal untuk reaksi apa pun yang melibatkan gas, asalkan pengukuran dilakukan pada kondisi suhu dan tekanan yang sama. Metode serupa dapat digunakan untuk menentukan rumus hidrida, klorida, atau senyawa gas lainnya.
Bagaimana jika gas yang dihasilkan bukan gas pada kondisi percobaan?
Metode ini menjadi tidak langsung berlaku. Hukum Gay-Lussac dan prinsip Avogadro hanya berlaku untuk zat berwujud gas. Jika produk reaksi berupa cairan atau padat pada kondisi percobaan, maka volume gas yang diukur hanya akan merepresentasikan gas reaktan yang bereaksi atau sisa, dan diperlukan informasi tambahan seperti massa produk untuk analisis lengkap.
Mengapa perbandingan volume harus bilangan bulat sederhana?
Ini adalah konsekuensi langsung dari Hipotesis Avogadro: volume gas yang sama pada suhu dan tekanan yang sama mengandung jumlah molekul yang sama. Jadi, perbandingan volume mencerminkan perbandingan jumlah molekul, yang pada reaksi kimia setara dengan perbandingan koefisien stoikiometri dalam persamaan yang setara—dan koefisien tersebut selalu bilangan bulat sederhana.
Apa kelemahan utama metode penentuan rumus melalui volume gas ini?
Kelemahannya terletak pada ketergantungannya pada asumsi bahwa semua zat yang terlibat adalah gas ideal dan pengukuran dilakukan pada kondisi yang benar-benar terjaga konstan. Kesalahan eksperimental seperti kebocoran gas, kelarutan gas dalam air (jika menggunakan metode pengukuran dengan air), atau fluktuasi suhu/tekanan dapat menggeser perbandingan volume dari bilangan bulat sempurna, mempersulit interpretasi.
Dapatkah metode ini membedakan antara rumus empiris dan rumus molekul?
Ya, bisa. Data volume dapat langsung mengarah pada perbandingan atom paling sederhana (rumus empiris). Namun, dengan mengetahui sifat bahwa produknya adalah gas dan mempertimbangkan molekul-molekul gas sederhana yang mungkin (seperti N₂O, NO, N₂O₃, NO₂, N₂O₅), analisis volume seringkali dapat mengarah langsung pada rumus molekul yang sebenarnya, terutama jika perbandingan volume yang diperoleh sudah sederhana.

