Modifikasi yang Membuat Percobaan Produksi Gas SO₂ Berhasil bukan sekadar urusan teknis di laboratorium, melainkan cerminan dari kehidupan kita yang penuh penyesuaian dan perbaikan terus-menerus. Sebagaimana kita menata hidup untuk meraih hasil terbaik, percobaan produksi gas SO₂ memerlukan serangkaian modifikasi cerdas pada metode, bahan, dan peralatan untuk mengubah potensi kegagalan menjadi kesuksesan.
Percobaan ini pada dasarnya bertumpu pada reaksi kimia tertentu, seperti pembakaran belerang atau dekomposisi garam sulfit. Keberhasilannya sangat ditentukan oleh bagaimana kita memodifikasi faktor-faktor kritis, mulai dari konsentrasi reaktan, pemilihan katalis, desain alat, hingga teknik pengumpulan gas, untuk menghasilkan SO₂ dengan volume dan kemurnian yang diinginkan.
Prinsip Dasar dan Persiapan Produksi Gas SO₂
Keberhasilan sebuah percobaan laboratorium selalu berawal dari pemahaman yang kuat terhadap fondasinya. Dalam produksi gas sulfur dioksida, fondasi ini dibangun atas prinsip kimia yang jelas dan persiapan yang matang, yang menjadi kunci untuk membuka pintu kesuksesan eksperimen.
Secara esensial, produksi SO₂ dalam skala lab sering mengandalkan reaksi antara suatu bahan sumber sulfur dengan agen pengoksidasi atau peruraian termal. Prinsip yang paling umum adalah reaksi antara logam sulfida dengan asam kuat, atau dekomposisi garam sulfit. Memahami mekanisme ini bukan hanya teori belaka, melainkan peta yang akan menuntun kita dalam memilih bahan dan merancang prosedur.
Prinsip Kimia dan Perlengkapan Penting
Reaksi utama yang sering dimanfaatkan adalah antara natrium sulfit (Na₂SO₃) dengan asam sulfat (H₂SO₄). Reaksi ini berlangsung relatif cepat dan mudah dikendalikan di lab. Persamaan reaksinya digambarkan sebagai:
Na₂SO₃ (s) + H₂SO₄ (aq) → Na₂SO₄ (aq) + H₂O (l) + SO₂ (g)
Reaksi ini menghasilkan gas SO₂ yang kemudian dapat dikumpulkan. Untuk melaksanakan percobaan ini, diperlukan seperangkat alat dan bahan inti. Bahan baku utamanya adalah natrium sulfit anhidrat dan asam sulfat. Sementara peralatan laboratorium krusial mencakup labu dasar bulat atau tabung generator gas, pendingin (kondensor), selang penghubung yang tahan kimia, dan apparatus untuk pengumpulan gas seperti tabung ukur atau jerigen.
Langkah-Langkah Keselamatan Kerja
Gas SO₂ bersifat toxic, korosif, dan sangat mengiritasi sistem pernapasan. Oleh karena itu, membangun benteng keselamatan sebelum memulai adalah hal yang non-negotiable. Protokol ini dirancang untuk melindungi diri dan lingkungan sekitar.
- Selalu bekerja di dalam lemari asam (fume hood) yang berfungsi dengan baik untuk memastikan sirkulasi dan pembuangan gas yang aman.
- Gunakan alat pelindung diri (APD) yang lengkap, termasuk sarung tangan nitril tahan kimia, jas lab, dan pelindung mata (goggles). Masker respirator dengan kartrid khusus untuk gas asam direkomendasikan.
- Siapkan larutan penetral seperti soda abu (Na₂CO₃) atau kalsium hidroksida (Ca(OH)₂) dalam jumlah yang cukup di dekat area kerja untuk menangani tumpahan asam atau kebocoran gas SO₂.
- Pastikan semua sambungan peralatan telah dikencangkan dan di-check terhadap kebocoran sebelum reaksi dimulai. Oleskan sedikit air sabun pada sambungan untuk mendeteksi gelembung udara yang menandakan kebocoran.
- Rencanakan prosedur shut-down dan disposal limbah dengan jelas. Gas SO₂ sisa harus dialirkan ke dalam larutan penetral sebelum dibuang.
Faktor Penyebab Kegagalan Umum
Bahkan dengan persiapan terbaik, beberapa faktor sering kali menjadi batu sandungan. Kesadaran akan titik rawan ini memungkinkan kita untuk lebih waspada dan antisipatif.
- Kebocoran pada sistem: Ini adalah penyebab utama kegagalan. Gas SO₂ yang hilang melalui sambungan yang longgar akan membuat hasil pengumpulan sangat sedikit.
- Bahan baku yang tidak berkualitas: Natrium sulfit yang sudah terkontaminasi dengan udara lembab atau teroksidasi menjadi sulfat akan bereaksi tidak sempurna, menghasilkan gas yang sedikit.
- Konsentrasi asam yang tidak tepat: Penggunaan asam sulfat encer dapat memperlambat reaksi secara signifikan dan menghasilkan gas yang bercampur dengan banyak uap air.
- Penanganan suhu yang keliru: Reaksi ini bersifat eksotermik. Jika tidak didinginkan dengan baik, panas yang berlebihan dapat mendidihkan campuran reaksi secara tidak terkendali atau bahkan merusak peralatan.
Modifikasi Metode dan Bahan Reaksi: Modifikasi Yang Membuat Percobaan Produksi Gas SO₂ Berhasil
Setelah paham dengan dasar-dasarnya, langkah selanjutnya adalah berinovasi. Modifikasi pada metode dan bahan reaksi adalah jiwa dari percobaan yang berhasil, di mana kita mengubah yang biasa menjadi lebih baik, lebih aman, dan lebih efisien.
Perbandingan Metode Pembakaran dan Dekomposisi Termal
Dua metode klasik produksi SO₂ adalah pembakaran belerang dan dekomposisi termal garam sulfit. Masing-masing membawa kelebihan dan tantangannya sendiri. Pembakaran belerang murni menghasilkan gas SO₂ dengan persamaan S (s) + O₂ (g) → SO₂ (g). Metode ini menghasilkan gas yang relatif murni namun memerlukan pemanasan suhu tinggi dan penanganan belerang yang berisiko. Sebaliknya, dekomposisi termal garam sulfit, seperti tembaga(II) sulfit, lebih mudah dilakukan di lab karena suhu dekomposisinya lebih rendah.
Namun, metode ini sering kali memerlukan katalis dan dapat menghasilkan produk samping berupa logam oksida yang menyulitkan pemurnian.
Pengaruh Modifikasi Konsentrasi Reaktan
Pilihan konsentrasi asam sulfat bukanlah hal yang sepele. Asam sulfat pekat (96-98%) bereaksi sangat vigor dan eksotermik dengan natrium sulfit. Meski laju produksi gasnya tinggi, reaksi menjadi sulit dikendalikan dan berisiko menyebabkan bumping atau percikan. Di sisi lain, asam sulfat encer (misalnya 50%) menghasilkan reaksi yang lebih kalem dan terkendali, namun laju produksi gasnya lebih lambat dan gas SO₂ yang dihasilkan mengandung lebih banyak uap air.
Modifikasi yang ideal sering kali adalah menggunakan asam dengan konsentrasi menengah, sekitar 70-80%, untuk menyeimbangkan antara laju reaksi dan keamanan.
Peran Katalis dalam Efisiensi Reaksi
Dalam beberapa metode, terutama dekomposisi termal, katalis dapat menjadi game-changer. Penambahan katalis padat seperti vanadium pentaoksida (V₂O₅) atau platinum (Pt) pada metode kontak dapat menurunkan energi aktivasi yang dibutuhkan, sehingga reaksi dapat berlangsung pada suhu yang lebih rendah dan lebih efisien. Modifikasi ini sangat berguna untuk produksi skala besar, namun untuk skala lab, kompleksitas penanganan katalis sering kali tidak sebanding dengan manfaatnya.
Prosedur Modifikasi dengan Bahan Alternatif
Ketersediaan bahan kimia bisa menjadi kendala. Sebuah modifikasi prosedur yang efektif dapat menggunakan natrium metabisulfit (Na₂S₂O₅) sebagai alternatif dari natrium sulfit. Bahan ini lebih stabil, mudah disimpan, dan bereaksi dengan asam menurut persamaan: Na₂S₂O₅ + H₂SO₄ → 2 SO₂ + Na₂SO₄ + H₂O. Prosedurnya relatif sama, tetapi dengan natrium metabisulfit, kita mendapatkan hasil gas yang setara bahkan lebih konsisten, sekaligus mengurangi risiko bahan baku yang telah terdegradasi.
Modifikasi Peralatan dan Teknik Pengumpulan
Sebuah reaksi yang sempurna bisa sia-sia jika gas hasilnya tidak tertangkap dengan baik. Modifikasi pada peralatan dan teknik pengumpulan adalah tentang membangun sebuah benteng yang kedap, efisien, dan dirancang untuk memenjarakan setiap gelembung gas SO₂ yang berharga.
Desain Rangkaian Peralatan Antikebocoran, Modifikasi yang Membuat Percobaan Produksi Gas SO₂ Berhasil
Rangkaian standar generator gas sering kali rentan terhadap kebocoran pada sambungan karet atau ground glass joint. Modifikasi sederhana namun sangat efektif adalah dengan menerapkan teknik “double-clamp” pada setiap sambungan, dimana setiap joint tidak hanya dipegang oleh satu penjepit, tetapi dua. Selain itu, mengganti selang karet biasa dengan selang PTFE (Teflon) atau silikon yang tahan terhadap asam kuat akan sangat mengurangi degradasi dan potensi kebocoran.
Sebuah labu dua atau tiga leher juga lebih disukai daripada labu satu leher, karena memungkinkan penambahan reaktan, pemasangan termometer, dan pengadukan secara bersamaan tanpa harus membuka sistem.
Perbandingan Peralatan Standar dan Modifikasi
Setiap komponen dalam rangkaian dapat ditingkatkan fungsinya. Tabel berikut merangkum beberapa modifikasi kunci yang memberikan keuntungan signifikan.
| Komponen | Fungsi | Bahan Modifikasi | Keuntungan |
|---|---|---|---|
| Sambungan Selang | Menghubungkan generator ke kolektor | Selang PTFE dengan ferrule logam | Tahan korosi, koefisien ekspansi rendah, mengurangi kebocoran. |
| Labu Reaksi | Tempat berlangsungnya reaksi | Labu leher tiga dengan jaket pendingin | Memungkinkan kontrol suhu yang lebih baik dan penambahan reaktan tanpa membuka sistem. |
| Pendingin Gas | Mendinginkan gas dan mengembunkan uap air | Kondensor Graham (spiral dalam tabung) | Area permukaan pendinginan lebih besar, menghasilkan gas SO₂ yang lebih kering. |
| Botol Pencuci | Menjerap kelembaban dan impurities | Botol gas washing yang diisi silica gel, lalu H₂SO₄ pekat | Silica gel menjerap sebagian besar uap air, H₂SO₄ pekat mengeringkan sempurna dan menjerap impurities tertentu. |
Teknik Modifikasi Pendinginan dan Pengeringan
Gas SO₂ yang keluar dari generator pasti mengandung uap air. Untuk aplikasi yang memerlukan gas kering, sistem pengeringan menjadi penting. Modifikasi yang efektif adalah dengan melewatkan gas terlebih dahulu melalui sebuah botol pencuci (gas washing bottle) yang diisi dengan agen pengering yang tidak bereaksi dengan SO₂, seperti silica gel. Setelah itu, gas dapat dilewatkan lagi melalui botol berisi asam sulfat pekat untuk pengeringan tahap akhir.
Rangkaian pendingin yang baik sebelum tahap pengeringan akan mengembunkan sebagian besar uap air, sehingga meringankan beban kerja agen pengering.
Pentingnya Modifikasi Teknik Pengumpulan
Teknik pengumpulan yang tepat adalah penentu akhir dari kualitas dan kuantitas sampel gas. Kesalahan di sini dapat menggagalkan seluruh usaha.
Pengumpulan gas SO₂ yang optimal memerlukan pertimbangan terhadap densitasnya yang lebih berat dari udara. Metode displacement of air (penggeseran udara) ke bawah adalah yang paling efektif. Modifikasi pada outlet tube dalam tabung pengumpul, misalnya dengan menambahkan pipa yang panjang dan fleksibel hingga menyentuh dasar tabung, memastikan bahwa udara di dalam tabung tergeser sempurna oleh SO₂, meminimalkan pencampuran dan menghasilkan sampel yang lebih murni.
Optimasi Proses dan Pengendalian Reaksi
Memproduksi gas bukanlah tentang membiarkan reaksi berjalan liar. Ini adalah seni mengendalikan variabel-variabel untuk memeras hasil sebanyak-banyaknya dengan kemurnian setinggi-tingginya. Optimasi adalah tentang presisi.
Modifikasi Suhu dan Tekanan Reaksi
Suhu adalah tuas pengendali yang powerful. Reaksi antara Na₂SO₃ dan H₂SO₄ bersifat eksotermik. Memanaskan awal campuran dapat memicu reaksi, tetapi begitu mulai, panas yang dihasilkan harus diimbangi dengan pendinginan untuk mencegah ledakan. Modifikasi dengan menggunakan penangas air es di sekitar labu reaksi memungkinkan kita mempertahankan suhu optimal sekitar 50-60°C, dimana laju reaksi sudah cukup cepat namun masih terkendali. Untuk tekanan, meski umumnya reaksi dilakukan pada tekanan atmosfer, modifikasi dengan menambahkan pressure release valve yang di-set pada tekanan rendah (0.5 bar) dapat menjadi pengaman tambahan jika terjadi penyumbatan.
Prosedur Pemantauan Laju Reaksi dan Kemurnian
Sebuah percobaan yang terkendali adalah percobaan yang terpantau. Berikut adalah langkah-langkah sistematis untuk memantau perkembangan reaksi.
- Pasang termometer pada salah satu leher labu reaksi untuk memantau suhu campuran secara real-time.
- Laju aliran gas dapat dipantau secara kualitatif dengan menghitung gelembung per detik yang melalui botol pencuci, atau secara kuantitatif dengan mengalirkan gas akhir ke dalam larutan hidrogen peroksida standar dan melakukan titrasi berkala.
- Kemurnian gas dapat diuji secara sederhana dengan melewatkan sebagian kecil gas melalui larutan kalium dikromat. Gas SO₂ yang murni akan mereduksi ion dikromat (jingga) menjadi ion kromium(III) (hijau).
- Catat volume reaktan yang digunakan, suhu, dan perkiraan laju aliran gas pada interval waktu tertentu untuk dianalisis lebih lanjut.
Titik Kritis Pengendalian Reaksi Eksotermik
Reaksi eksotermik memiliki titik kritis dimana panas yang dihasilkan dapat berlipat ganda secara tak terkendali. Titik ini biasanya terjadi sesaat setelah penambahan awal asam atau ketika konsentrasi reaktan sudah tinggi. Modifikasi kritis yang harus dilakukan adalah: Pertama, menambahkan asam sulfat secara bertahap dan perlahan melalui corong tambah, bukan sekaligus. Kedua, memastikan jaket pendingin atau penangas es sudah siap dan berfungsi sebelum reaksi dimulai.
Ketiga, memiliki rencana darurat untuk mendinginkan reaksi secara instan, seperti kesiapan untuk merendam labu reaksi dalam bak es besar jika suhu melebihi batas aman.
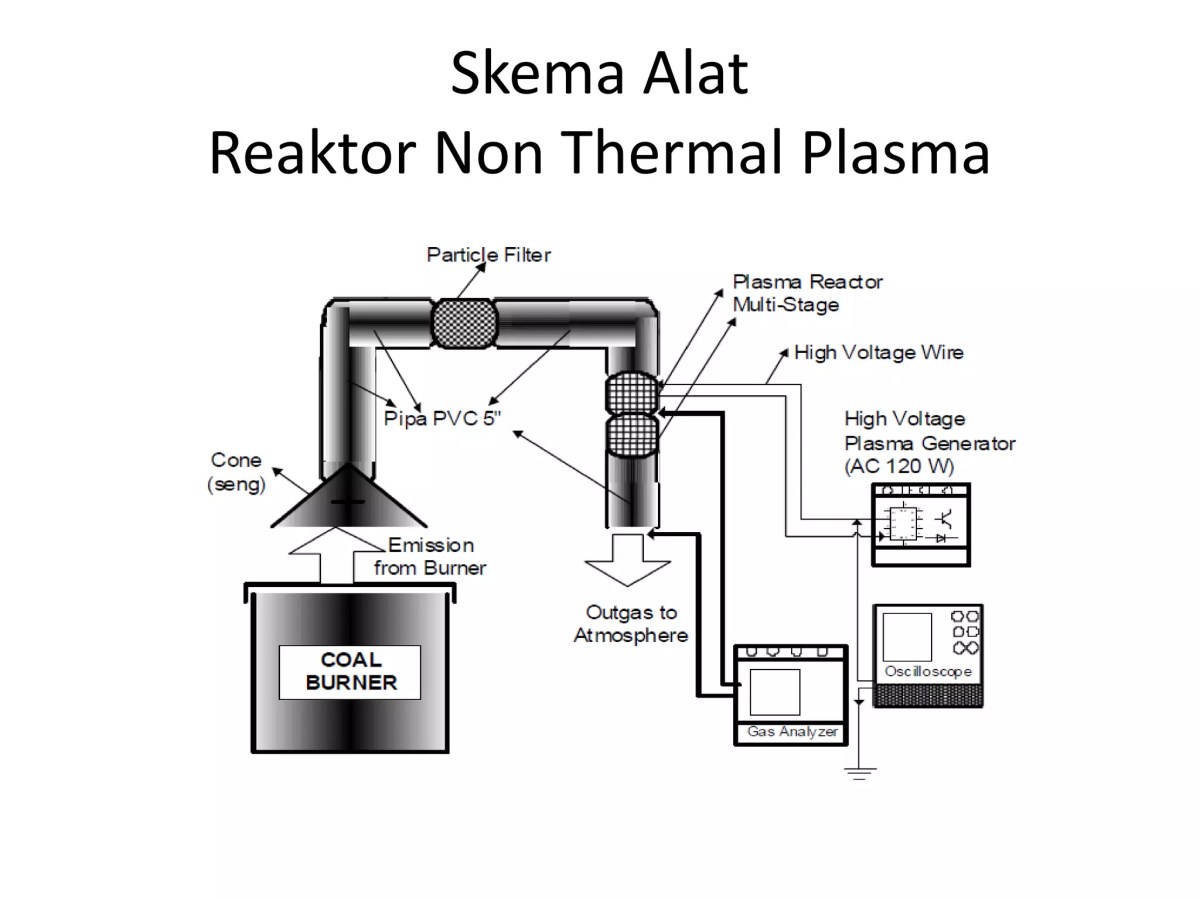
Diagram Alir Proses Produksi SO₂ Termodifikasi
Sebuah diagram alir membantu memvisualisasikan proses yang telah dimodifikasi. Bayangkan sebuah diagram yang dimulai dari Labu Reaksi Tiga Leher (dimodifikasi dengan jaket pendingin). Satu leher untuk corong tambah asam, satu untuk termometer, satu untuk outlet gas. Gas panas kemudian masuk ke Kondensor Graham (modifikasi untuk pendinginan maksimal) untuk mengembunkan uap air. Selanjutnya, gas yang sudah lebih dingin dilewatkan ke Botol Pencuci 1 berisi Silica Gel (modifikasi pengering tahap 1), lalu ke Botol Pencuci 2 berisi H₂SO₄ Pekat (modifikasi pengering tahap 2 dan penjerap impurities).
Akhirnya, gas SO₂ kering dan murni dialirkan ke Tabung Pengumpul melalui selang inlet yang menjulur ke dasar tabung (modifikasi untuk penggeseran udara sempurna). Setiap tahap modifikasi pada diagram ini dianotasi dengan penjelasan singkat tentang tujuannya.
Validasi Keberhasilan dan Aplikasi
Setelah semua usaha modifikasi dilakukan, tibalah saatnya untuk menjawab satu pertanyaan penting: Apakah percobaan ini berhasil? Validasi adalah proses mengukur keberhasilan tersebut dengan parameter yang objektif dan terukur, sekaligus melihat nilai aplikasi dari hasil yang kita peroleh.
Parameter Pengukuran Keberhasilan
Keberhasilan produksi gas SO₂ tidak hanya dinilai dari “ada gasnya”. Tiga parameter utama yang saling melengkapi adalah volume, kemurnian, dan konsistensi. Volume gas yang dihasilkan harus mendekati volume teoritis yang dihitung berdasarkan reaktan pembatas. Kemurnian gas dinilai dari tidak adanya impurities seperti uap air atau udara, yang dapat diuji dengan metode kimiawi. Konsistensi berarti bahwa prosedur yang sama dapat diulang pada waktu yang berbeda dan menghasilkan output dengan volume dan kemurnian yang relatif sama.
Tabel Validasi Hasil Gas SO₂
Untuk memvalidasi hasil secara komprehensif, serangkaian pengujian dapat dilakukan. Tabel berikut merangkum pendekatannya.
| Jenis Pengujian | Metode | Hasil yang Diharapkan | Indikator Keberhasilan |
|---|---|---|---|
| Uji Volume | Pengumpulan dengan displacement air ke dalam tabung ukur tertutup. | Volume gas mendekati volume teoritis. | Perhitungan % yield > 85%. |
| Uji Kekeringan | Melewatkan gas melalui tabung kaca berisi cobalt chloride paper anhidrat. | Gas kering, tidak mengandung uap air. | Kertas kobalt klorida tetap biru, tidak berubah menjadi merah muda. |
| Uji Kemurnian (Kualitatif) | Mengalirkan gelembung gas ke dalam larutan KMnO₄ encer. | Gas SO₂ murni mereduksi ion permanganat. | Larutan KMnO₄ ungu menjadi tidak berwarna. |
| Uji Kuantitatif | Mengalirkan gas yang telah diketahui volumenya ke dalam larutan H₂O₂ berlebih, lalu menitrasi asam yang terbentuk dengan basa standar. | Jumlah mol asam setara dengan mol SO₂ yang dihasilkan. | Nilai kemurnian > 95%. |
Aplikasi Praktis Gas SO₂ Hasil Percobaan
Source: slidesharecdn.com
Gas SO₂ yang berhasil diproduksi dengan kemurnian tinggi bukanlah akhir cerita, melainkan bahan awal untuk serangkaian eksperimen lain yang lebih menarik. Salah satu aplikasi praktisnya adalah dalam sintesis garam tiosulfat. Gas SO₂ dapat dialirkan ke dalam larutan natrium sulfida (Na₂S) untuk menghasilkan natrium tiosulfat (Na₂S₂O₃), yang merupakan bahan pentransfer gambar dalam fotografi dan titrator dalam kimia analitik. Aplikasi lain adalah sebagai pereaksi reduksi dalam berbagai reaksi organik dan anorganik.
Skenario Pemecahan Masalah Pasca-Modifikasi
Setelah modifikasi, masalah baru mungkin muncul. Sebagai contoh, jika setelah modifikasi sistem pengeringan dengan silica gel dan H₂SO₄, laju aliran gas menjadi sangat lambat, ini mengindikasikan adanya penyumbatan kelembaban. Troubleshooting-nya adalah memeriksa apakah silica gel sudah jenuh dan perlu diganti, atau apakah suhu pendinginan sebelum pengeringan sudah cukup rendah untuk mengembunkan sebagian besar air. Contoh lain, jika yield gas masih rendah meski sistem sudah kedap, periksa kembali kualitas natrium sulfit; bisa jadi bahan telah teroksidasi oleh udara dan perlu diganti dengan yang baru.
Akhir Kata
Demikianlah, kesuksesan produksi gas SO₂ mengajarkan kita bahwa modifikasi yang tepat dan didasari pemahaman mendalam adalah kunci mengatasi tantangan. Dalam kehidupan, sebagaimana dalam laboratorium, setiap proses memerlukan evaluasi, penyesuaian, dan optimasi tanpa henti untuk mencapai hasil yang optimal dan bermanfaat bagi tujuan yang lebih besar.
Daftar Pertanyaan Populer
Apakah gas SO₂ yang dihasilkan dari percobaan ini aman untuk digunakan dalam sintesis senyawa lain di lab sekolah?
Dengan kemurnian tinggi dan bebas kelembaban yang dicapai melalui modifikasi, gas SO₂ dapat digunakan untuk sintesis, namun tetap memerlukan pengawasan ketat dan peralatan yang memadai mengingat sifatnya yang beracun dan korosif.
Bagaimana jika saya tidak memiliki akses ke asam sulfat pekat untuk percobaan ini?
Modifikasi dapat dilakukan dengan menggunakan bahan alternatif yang lebih aman atau mudah didapat, seperti garam sulfit dengan asam klorida encer, meskipun mungkin perlu penyesuaian pada konsentrasi dan suhu reaksi.
Mengapa modifikasi teknik pengumpulan gas sangat penting untuk keberhasilan percobaan?
Modifikasi teknik pengumpulan, seperti menggunakan sistem pendingin atau penyerap kelembaban, sangat penting untuk meminimalkan kebocoran, mendapatkan gas yang kering dan murni, serta memastikan volume yang dihasilkan dapat terukur secara akurat.
Apa indikator langsung yang paling sederhana bahwa modifikasi yang saya lakukan berhasil selama percobaan berlangsung?
Indikator langsung yang sederhana adalah laju aliran gas yang stabil dan terukur, serta tidak adanya kebocoran yang ditandai dengan bau khas SO₂ yang menyengat di sekitar apparatus. Hasil akhir divalidasi dengan mengukur volume dan kemurnian gas.