Penyebab larutan elektrolit dapat menghantarkan arus listrik ternyata punya cerita seru di balik kesan seriusnya di pelajaran kimia. Bayangkan, cairan biasa seperti air aki atau larutan garam ternyata bisa jadi jalan tol bagi elektron, dan kuncinya ada pada para pemain kecil yang bermuatan: ion-ion. Fenomena ini bukan cuma teori di lab, tapi jantung dari banyak teknologi yang memudahkan hidup kita sehari-hari.
Pada dasarnya, kemampuan menghantarkan listrik ini muncul karena adanya partikel bermuatan bebas yang bisa bergerak dalam larutan. Ketika senyawa elektrolit seperti garam dapur (NaCl) atau asam cuka larut dalam air, mereka terurai menjadi ion-ion positif (kation) dan negatif (anion). Saat dua elektroda dicelupkan dan dialiri tegangan, ion-ion inilah yang akan berlarian menghantarkan muatan, menutup rangkaian listrik itu dan menghasilkan aliran arus yang bisa kita ukur.
Konsep Dasar Larutan Elektrolit
Pernah nggak sih, waktu lagi isi ulang baterai atau lihat proses penyepuhan emas, kamu bertanya-tanya cairan apa sih yang bisa bikin listrik “mengalir” di dalamnya? Nah, jawabannya ada pada larutan elektrolit. Intinya, larutan elektrolit adalah larutan yang bisa menghantarkan arus listrik. Kemampuan ini muncul karena di dalam larutan tersebut terdapat partikel-partikel bermuatan yang bebas bergerak, yaitu ion-ion. Kalau larutan non-elektrolit?
Itu kebalikannya. Larutan seperti larutan gula atau alkohol murni nggak bisa ngasih “jalan” buat listrik karena zat terlarutnya nggak terurai menjadi ion.
Membedakannya secara praktis cukup mudah. Ciri fisik atau kimia yang paling mencolok ya responnya terhadap aliran listrik itu sendiri. Kalau kita celupin dua elektroda yang disambung ke sumber listrik dan sebuah lampu kecil ke dalam larutan elektrolit, lampu itu bakal nyala (terang atau redup) dan di sekitar elektroda muncul gelembung gas. Itu adalah bukti visual bahwa terjadi aliran muatan listrik dan reaksi kimia di elektroda.
Pada larutan non-elektrolit, lampu tetap mati dan nggak ada gelembung.
Kemampuan larutan elektrolit menghantarkan listrik bersumber dari pergerakan ion-ion bebasnya, sebuah prinsip konduksi yang fundamental. Mirip seperti bagaimana kita membutuhkan alat untuk mengelola arus informasi, pemahaman ini pun perlu diakses dan diolah agar bermakna. Di sinilah peran Fungsi Komputer: Akses, Mempermudah, Mengolah, dan Mencari Data menjadi krusial, memungkinkan kita mensimulasikan dan menganalisis perilaku ion-ion tersebut secara mendalam. Pada akhirnya, eksplorasi digital itu justru memperkaya pemahaman kita tentang fenomena fisiko-kimiawi di balik konduktivitas elektrolit yang sederhana namun elegant.
Perbandingan Sifat Larutan Berdasarkan Daya Hantar
Larutan elektrolit sendiri ternyata nggak semuanya sama kuat. Ada yang konduktornya jago banget, ada yang biasa aja. Berdasarkan kekuatan menghantarkan listriknya, kita bagi jadi elektrolit kuat dan elektrolit lemah. Perbedaan mendasarnya terletak pada seberapa sempurna zat terlarutnya terurai menjadi ion. Berikut tabel yang merangkum perbandingannya.
| Sifat Uji | Elektrolit Kuat | Elektrolit Lemah | Non-Elektrolit |
|---|---|---|---|
| Daya Hantar Listrik | Sangat Baik | Lemah | Tidak Menghantar |
| Nyala Lampu Uji | Menyala Terang | Menyala Redup atau Tidak Menyala | Tidak Menyala |
| Gelembung Gas pada Elektroda | Banyak | Sedikit | Tidak Ada |
| Contoh Senyawa | NaCl, HCl, NaOH, H2SO4 | CH3COOH (cuka), NH3, H2CO3 | C12H22O11 (gula), C2H5OH (etanol), Urea |
Mekanisme Penghantaran Arus Listrik dalam Larutan
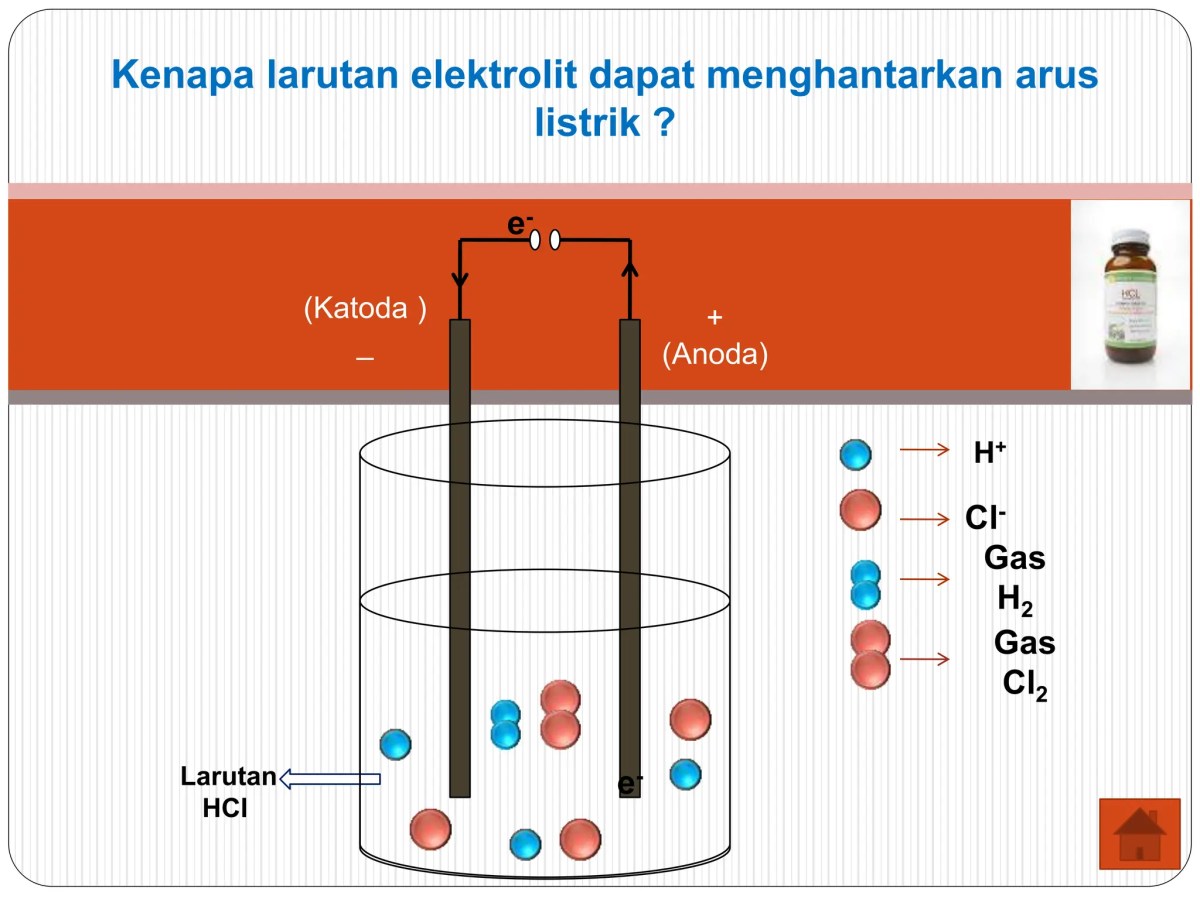
Jadi, gimana ceritanya ion-ion itu bisa bawa-bawa listrik? Bayangkan sebuah rangkaian listrik sederhana dengan baterai, kabel, dan sebuah wadah berisi larutan elektrolit yang di dalamnya tercelup dua batang logam (elektroda). Baterai punya kutub positif (katoda) dan negatif (anoda). Saat rangkaian tertutup, baterai menciptakan “tekanan” atau beda potensial yang memaksa partikel bermuatan untuk bergerak teratur.
Di dalam larutan, yang bergerak adalah ion-ion. Kation, yaitu ion bermuatan positif, akan tertarik dan bergerak menuju elektroda negatif (katoda). Sebaliknya, anion, ion bermuatan negatif, akan tertarik dan bergerak menuju elektroda positif (anoda). Pergerakan terarah inilah yang membentuk aliran muatan listrik di dalam larutan. Arus listrik secara konvensional dianggap mengalir dari positif ke negatif, dan di dalam larutan, “tugas” membawa arus ini dibagi rata antara kation dan anion yang bergerak berlawanan arah.
Aliran Muatan dalam Sistem Elektrolisis
Prosesnya bisa dideskripsikan sebagai sebuah siklus yang berkesinambungan. Arus listrik dari baterai mengalir melalui kabel ke elektroda positif. Elektroda ini menjadi sangat “lapar” akan elektron, sehingga ia menarik elektron dari anion yang ada di larutan. Saat anion menyentuh elektroda positif, ia melepaskan elektron (teroksidasi). Elektron-elektron ini kemudian mengalir melalui kabel menuju elektroda negatif.
Di elektroda negatif, elektron-elektron tersebut diberikan kepada kation (yang tereduksi). Dengan demikian, aliran elektron di kabel luar dan aliran ion di dalam larutan saling melengkapi, menutup rangkaian dan membuat arus terus mengalir.
Faktor yang Mempengaruhi Daya Hantar Listrik: Penyebab Larutan Elektrolit Dapat Menghantarkan Arus Listrik
Source: slidesharecdn.com
Kekuatan nyala lampu saat menguji larutan elektrolit bisa bervariasi, kan? Terang, redup, atau cuma kedap-kedip. Variasi ini nggak terjadi secara acak, tapi sangat dipengaruhi oleh beberapa faktor kunci. Memahami faktor-faktor ini penting, bukan cuma untuk teori, tapi juga untuk aplikasi praktis seperti mendesain baterai yang lebih efisien atau proses industri kimia.
- Jenis Zat Terlarut (Kekuatan Elektrolit): Ini faktor utama. Elektrolit kuat seperti garam dapur (NaCl) atau asam sulfat (H 2SO 4) terdisosiasi sempurna dalam air, menghasilkan konsentrasi ion yang tinggi. Makin banyak ion, makin bagus daya hantarnya. Elektrolit lemah seperti cuka (CH 3COOH) hanya terionisasi sebagian, sehingga jumlah ion bebasnya sedikit dan daya hantarnya lemah.
- Konsentrasi Larutan: Untuk larutan encer, umumnya makin tinggi konsentrasi zat elektrolit, makin banyak ion yang tersedia, sehingga konduktivitas meningkat. Namun, hubungan ini nggak selalu linear. Pada konsentrasi sangat tinggi, ion-ion bisa saling menghambat pergerakan satu sama lain karena gaya tarik antar-ion, yang justru bisa menurunkan mobilitas dan konduktivitasnya.
- Suhu Larutan: Ketika suhu dinaikkan, energi kinetik ion-ion meningkat. Mereka bergerak lebih cepat dan lebih lincah menghindari tarikan dari ion berlawanan muatan. Peningkatan mobilitas ion ini langsung meningkatkan kemampuan larutan dalam menghantarkan listrik. Itulah mengapa banyak sel elektrokimia industri bekerja pada suhu tertentu yang dioptimalkan.
Peran Disosiasi dan Ionisasi
Dua proses kunci yang melahirkan ion-ion “pembawa listrik” itu adalah disosiasi ionik dan ionisasi. Meski hasil akhirnya sama-sama menghasilkan ion, asal-usulnya beda. Memahami perbedaan ini membantu kita memprediksi sifat suatu senyawa ketika dilarutkan.
Disosiasi ionik terjadi pada senyawa ionik, seperti garam NaCl. Dalam bentuk padatnya, ion Na⁺ dan Cl⁻ sudah ada, terikat erat dalam kisi kristal. Ketika dimasukkan ke dalam air, molekul air yang polar mengelilingi dan melemahkan gaya tarik antar-ion tersebut, sehingga ion-ion itu terlepas dan bebas bergerak. Prosesnya lebih seperti “melepaskan” ion yang sudah ada.
Sebaliknya, ionisasi terjadi pada senyawa kovalen polar, seperti asam klorida (HCl). Dalam keadaan murni, HCl adalah molekul netral yang berikatan kovalen. Saat bertemu air, interaksi yang kuat dengan molekul air menyebabkan ikatan dalam molekul HCl putus, menghasilkan ion H⁺ (yang segera terhidrasi menjadi H 3O⁺) dan ion Cl⁻. Jadi, ion-ion ini “terbentuk” saat proses pelarutan.
Contoh Reaksi Kimia Prosesnya, Penyebab larutan elektrolit dapat menghantarkan arus listrik
Berikut adalah persamaan kimia yang menggambarkan kedua proses tersebut.
Disosiasi Ionik (NaCl):
NaCl(s) → Na⁺(aq) + Cl⁻(aq)
Ionisasi (HCl):
HCl(g) + H 2O(l) → H 3O⁺(aq) + Cl⁻(aq)
Aplikasi dan Contoh dalam Kehidupan Sehari-hari
Prinsip larutan elektrolit ini bukan cuma teori di buku kimia SMA. Dari bangun tidur sampai tidur lagi, kita dikelilingi oleh aplikasinya. Mulai dari yang sederhana seperti rasa asin di air laut (yang adalah larutan elektrolit kompleks) sampai teknologi canggih di genggaman tangan kita.
Contoh larutan elektrolit sehari-hari yang paling gampang ditemui adalah cairan tubuh kita sendiri. Darah, keringat, dan cairan dalam sel semuanya mengandung berbagai ion seperti Na⁺, K⁺, Ca²⁺, dan Cl⁻, yang penting untuk impuls saraf dan fungsi otot. Larutan oralit untuk penderita diare juga dirancang sebagai larutan elektrolit untuk menggantikan ion yang hilang. Lalu, ada aki kendaraan yang menggunakan larutan asam sulfat (H 2SO 4) sebagai elektrolitnya.
Penerapan Prinsip Elektrolit dalam Teknologi
| Aplikasi | Larutan Elektrolit yang Digunakan | Peran Ion-Ion |
|---|---|---|
| Baterai Aki (Accumulator) | Larutan Asam Sulfat (H2SO4) | Ion H⁺ dan SO₄²⁻ menghantarkan muatan antara pelat timbal (Pb) dan timbal dioksida (PbO₂) selama proses pengosongan dan pengisian ulang. |
| Penyepuhan Logam (Electroplating) | Larutan garam logam yang akan disepuh (e.g., CuSO₄ untuk penyepuhan tembaga) | Ion logam (Cu²⁺) bergerak menuju katoda (benda yang disepuh) dan tereduksi menjadi logam padat yang melapisi permukaan. |
| Alat Ukur TDS Meter | Larutan/sampel air yang diuji | Alat mengukur Total Dissolved Solids dengan cara mendeteksi konduktivitas listrik. Semakin banyak ion terlarut (seperti Ca²⁺, Mg²⁺, Na⁺), semakin tinggi konduktivitas dan pembacaan TDS. |
| Fungsi Biologis (Impuls Saraf) | Cairan tubuh (cairan intrasel & ekstrasel) | Aliran ion Na⁺, K⁺, dan Cl⁻ melintasi membran sel saraf menciptakan perbedaan muatan yang merupakan dasar dari penghantaran sinyal saraf. |
Eksperimen dan Pengujian Sederhana
Membuktikan teori ini dengan eksperimen sederhana itu seru dan mencerahkan. Kamu bisa melihat langsung bagaimana berbagai cairan di rumah punya sifat kelistrikan yang berbeda. Eksperimen ini dikenal sebagai uji daya hantar listrik larutan.
Alat utamanya adalah sebuah rangkaian tester elektrolit sederhana. Kamu bisa membuatnya dengan baterai 9V, sebuah lampu LED kecil (dengan resistor yang sesuai), dua buah kabel dengan penjepit buaya, dan dua batang elektroda dari bahan inert seperti grafit (isi pensil mekanik) atau stainless steel. Rangkaiannya seri: kutub positif baterai disambung ke lampu, lalu ke elektroda pertama. Elektroda kedua disambung kembali ke kutub negatif baterai.
Saat kedua elektroda dicelupkan ke dalam larutan yang menghantar, rangkaian akan tertutup dan lampu menyala.
Prosedur dan Langkah Keselamatan
Berikut langkah-langkah umum untuk melakukan pengujian. Pertama, siapkan beberapa sampel larutan seperti air suling, air keran, larutan garam, larutan gula, cuka, dan air jeruk nipis. Pastikan setiap sampel dalam wadah terpisah yang cukup untuk mencelupkan kedua elektroda. Celupkan elektroda yang telah dibersihkan ke dalam sampel pertama. Amati apakah lampu menyala (dan tingkat kecerahan) serta apakah muncul gelembung gas di sekitar elektroda.
Prinsip dasar konduksi listrik dalam larutan elektrolit terletak pada keberadaan ion-ion bebas yang bergerak. Mirip dengan proses kompleks dimana seseorang mengubah status hukumnya, seperti yang dijelaskan dalam Prosedur Memperoleh Kewarganegaraan Melalui Naturalisasi , yang membutuhkan tahapan formal untuk mencapai pengakuan baru. Demikian pula, arus listrik hanya mengalir jika ada ‘jalan’ yang tersedia, yaitu ion-ion yang bermuatan tersebut, yang menjadi penghantar utama dalam sistem elektrokimia.
Catat hasilnya, bersihkan elektroda dengan air suling, dan lanjutkan ke sampel berikutnya.
Keselamatan adalah prioritas. Gunakan baterai dengan tegangan rendah (3V-9V) untuk menghindari sengatan listrik yang berbahaya. Jangan pernah menguji larutan langsung dari sumber listrik rumah (AC 220V). Hindari kontak kulit langsung dengan bahan kimia yang tidak dikenal, dan lakukan di area yang berventilasi baik jika menggunakan cairan yang berbau menyengat. Selalu cuci tangan setelah percobaan.
Deskripsi Alat Uji Elektrolit Sederhana
Bayangkan sebuah alat berbentuk seperti huruf “U” terbalik yang sederhana. Pada bagian dasar “U” yang terbuka, terdapat dua batang lurus sejajar yang berfungsi sebagai elektroda. Kedua batang ini dihubungkan oleh kabel ke sebuah kotak kecil (tempat baterai) yang memiliki sakelar dan sebuah lampu indikator kecil di bagian atasnya. Saat alat dicelupkan ke dalam gelas kimia berisi larutan, ruang antara kedua elektroda terisi larutan.
Jika larutan itu elektrolit, maka larutan itu bertindak sebagai “jembatan” yang menyambungkan sirkuit antara kedua elektroda, menyebabkan lampu indikator menyala. Semakin kuat elektrolitnya, semakin terang nyala lampunya, dan semakin banyak gelembung kecil yang terlihat menempel pada permukaan elektroda.
Kesimpulan
Jadi, sederhananya, rahasia di balik penghantaran listrik oleh larutan elektrolit terletak pada kebebasan ion-ion untuk berpindah. Mulai dari proses disosiasi yang melepaskan mereka, hingga mobilitasnya yang dipengaruhi oleh konsentrasi dan suhu, semua faktor itu bersatu menciptakan konduktivitas. Pemahaman ini bukan sekadar untuk menjawab soal ujian, tetapi juga membuka mata betapa prinsip kimia yang elegan ini menggerakkan dunia, dari baterai ponsel hingga proses penyepuhan perhiasan.
Dengan demikian, setiap kali melihat lampu uji elektrolit menyala, yang kita saksikan adalah tarian teratur dari partikel-partikel kecil yang sedang bekerja.
FAQ dan Solusi
Apakah air murni termasuk larutan elektrolit?
Tidak, air murni (H2O) bersifat non-elektrolit yang sangat lemah karena hanya terionisasi sangat sedikit. Air yang dapat menghantarkan listrik dengan baik biasanya telah mengandung zat terlarut elektrolit, seperti mineral atau garam.
Mengapa larutan gula tidak bisa menghantarkan listrik?
Karena gula (sukrosa) adalah senyawa kovalen non-polar. Saat dilarutkan, ia tidak terurai menjadi ion-ion, melainkan tetap sebagai molekul netral yang tidak bermuatan, sehingga tidak ada partikel pembawa muatan yang dapat bergerak.
Bagaimana suhu mempengaruhi daya hantar listrik larutan elektrolit?
Umumnya, kenaikan suhu meningkatkan daya hantar listrik. Panas memberikan energi lebih pada ion-ion, meningkatkan mobilitas atau kecepatan geraknya, sehingga mereka lebih mudah menghantarkan muatan. Namun, pada kasus tertentu seperti baterai, suhu terlalu tinggi bisa merusak.
Apakah semua cairan yang terasa asin atau asam pasti menghantarkan listrik?
Secara umum, ya. Rasa asin mengindikasikan adanya garam (senyawa ionik), dan rasa asam mengindikasikan adanya asam (senyawa kovalen polar yang terionisasi). Keduanya adalah ciri khas elektrolit. Namun, pengujian dengan alat adalah cara yang lebih akurat.

