Menentukan massa CO(NH₂)₂ dalam larutan BaCl₂ pada titik didih 100,4 °C – Menentukan massa CO(NH₂)₂ dalam larutan BaCl₂ pada titik didih 100,4°C adalah sebuah perjalanan ilmiah yang mengungkap harmoni tersembunyi di balik fenomena alam. Setiap kenaikan suhu yang kecil, seperti dari 100°C menjadi 100,4°C, bukanlah suatu kebetulan, melainkan cerita yang ditulis oleh partikel-partikel terlarut yang bekerja bersama, memengaruhi sifat dasar pelarutnya. Proses ini mengajarkan tentang keteraturan dalam kompleksitas, di mana hukum sifat koligatif menjadi bahasa universal yang memandu pemahaman kita.
Analisis ini menggabungkan dua zat dengan karakter berbeda: urea yang non-elektrolit dan barium klorida yang elektrolit kuat. Kehadiran mereka bersama dalam air menciptakan sebuah teka-teki yang hanya dapat dipecahkan dengan memahami kontribusi masing-masing terhadap kenaikan titik didih. Perhitungan yang dilakukan bukan sekadar manipulasi angka, tetapi sebuah upaya untuk mengkuantifikasi pengaruh tidak kasat mata dari setiap molekul dan ion dalam larutan tersebut.
Konsep Dasar Kenaikan Titik Didih dan Sifat Koligatif
Pernahkah kamu memperhatikan bahwa air yang kita rebus dengan menambahkan garam akan membutuhkan waktu sedikit lebih lama untuk mendidih? Fenomena ini bukan sekadar perasaan, melainkan manifestasi nyata dari sifat koligatif larutan. Sifat koligatif adalah sifat-sifat fisis larutan yang hanya bergantung pada jumlah partikel zat terlarut, bukan pada jenis partikelnya. Salah satu sifat koligatif yang paling mudah diamati adalah kenaikan titik didih.
Prinsipnya, ketika zat terlarut non-volatil (tidak mudah menguap) seperti urea atau garam ditambahkan ke dalam pelarut murni seperti air, partikel-partikel zat terlarut ini mengganggu proses penguapan molekul pelarut. Akibatnya, dibutuhkan energi lebih besar, yang berarti suhu lebih tinggi, untuk mencapai tekanan uap yang setara dengan tekanan atmosfer. Selisih suhu didih larutan dengan pelarut murni inilah yang disebut kenaikan titik didih (ΔTb).
Perbandingan Larutan Elektrolit dan Non-Elektrolit
Perilaku larutan elektrolit kuat seperti barium klorida (BaCl₂) dan non-elektrolit seperti urea (CO(NH₂)₂) dalam konteks sifat koligatif sangat berbeda. Urea, sebagai senyawa molekuler, tidak terionisasi dalam air. Satu molekul urea yang dilarutkan akan menghasilkan satu partikel dalam larutan. Sebaliknya, BaCl₂ adalah senyawa ionik yang terdisosiasi sempurna dalam air menjadi tiga ion: satu ion Ba²⁺ dan dua ion Cl⁻. Dengan demikian, satu satuan rumus BaCl₂ memberikan kontribusi tiga partikel terhadap sifat koligatif larutan.
Perbedaan mendasar ini diakomodasi dalam perhitungan melalui faktor Van’t Hoff (i), yang secara sederhana dapat dianggap sebagai rasio jumlah partikel nyata dalam larutan terhadap jumlah partikel yang diperkirakan jika zat tersebut tidak terionisasi.
Rumus Kenaikan Titik Didih dan Variabelnya
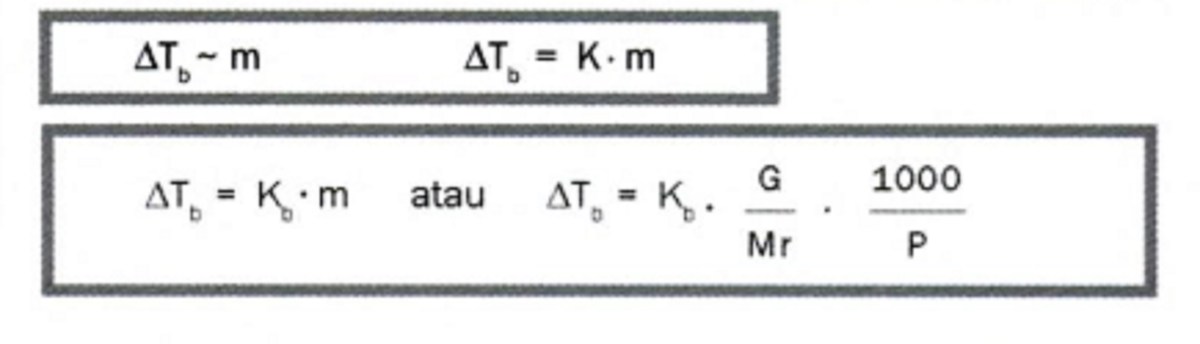
Untuk menghitung kenaikan titik didih secara kuantitatif, digunakan persamaan berikut:
ΔTb = Kb × m × i
Mari kita jabarkan makna dari setiap simbol dalam rumus penting ini:
- ΔTb: Kenaikan titik didih, yaitu selisih antara titik didih larutan (Tb larutan) dan titik didih pelarut murni (Tb° pelarut). Satuannya derajat Celsius (°C).
- Kb: Konstanta kenaikan titik didih molal pelarut. Nilainya spesifik untuk setiap jenis pelarut. Untuk air, Kb = 0,52 °C kg/mol.
- m: Molalitas larutan, yang menyatakan jumlah mol zat terlarut per kilogram pelarut (mol/kg).
- i: Faktor Van’t Hoff. Untuk non-elektrolit seperti urea, i = 1. Untuk elektrolit kuat seperti BaCl₂ yang terdisosiasi sempurna menjadi 3 ion, i = 3.
Analisis Komponen dalam Larutan dan Data yang Diperlukan
Untuk menentukan massa urea dalam campuran larutan dengan BaCl₂, kita perlu melakukan analisis komponen secara cermat. Permasalahan ini menjadi menarik karena kita berhadapan dengan larutan yang mengandung dua zat terlarut dengan sifat berbeda: satu elektrolit dan satu non-elektrolit. Kenaikan titik didih yang kita ukur (100,4°C) adalah hasil kumulatif dari kontribusi kedua zat tersebut.
Identifikasi Data Penting untuk Perhitungan, Menentukan massa CO(NH₂)₂ dalam larutan BaCl₂ pada titik didih 100,4 °C
Sebelum memulai perhitungan, pastikan kita telah mengumpulkan semua data yang diperlukan. Data-data kunci ini biasanya diberikan dalam soal atau dapat diukur secara eksperimen.
| Variabel | Contoh Nilai | Satuan | Keterangan |
|---|---|---|---|
| Titik didih larutan (Tb) | 100.4 | °C | Hasil pengamatan |
| Titik didih air murni (Tb°) | 100.0 | °C | Diketahui (asumsi tekanan 1 atm) |
| Kb air | 0.52 | °C kg/mol | Konstanta universal |
| Massa BaCl₂ | 10 | gram | Diketahui dari soal |
| Massa larutan total | 510 | gram | Diketahui dari soal (misal) |
| Massa molar BaCl₂ | 208.23 | g/mol | Dihitung dari tabel periodik |
| Massa molar Urea (CO(NH₂)₂) | 60.06 | g/mol | Dihitung dari tabel periodik |
Sifat Urea sebagai Non-Elektrolit dan Peran BaCl₂
Urea, dengan rumus CO(NH₂)₂, adalah senyawa organik yang larut dalam air melalui pembentukan ikatan hidrogen, bukan melalui proses ionisasi. Molekul urea tetap utuh dalam larutan. Oleh karena itu, dalam perhitungan sifat koligatif, faktor Van’t Hoff untuk urea selalu bernilai 1. Sementara itu, kehadiran BaCl₂ sebagai elektrolit kuat memperumit sekaligus memperjelas analisis. Karena setiap molekul BaCl₂ menghasilkan 3 partikel ion (i=3), kontribusinya terhadap kenaikan titik didih tiga kali lebih besar dibandingkan jumlah mol yang sama dari urea.
Inilah mengapa pemisahan kontribusi keduanya menjadi langkah kunci dalam penyelesaian masalah ini.
Prosedur Perhitungan Massa Urea (CO(NH₂)₂)
Dengan data dan konsep yang telah dipahami, kita dapat menyusun prosedur perhitungan yang sistematis untuk mengungkap massa urea yang “tersembunyi” dalam larutan. Logika utamanya adalah menghitung molalitas total dari ΔTb yang terukur, lalu mengurangi kontribusi dari BaCl₂ yang dapat kita hitung secara terpisah, sehingga diperoleh kontribusi dari urea.
Langkah-langkah Perhitungan Molalitas Total
Pertama, kita hitung kenaikan titik didih yang terjadi: ΔTb = Tb larutan – Tb° air = 100.4°C – 100.0°C = 0.4°C. Kenaikan ini berasal dari kedua zat terlarut. Karena kita tidak tahu faktor i campuran secara langsung, kita hitung dulu molalitas total efektif (m_total × i_efektif) dari rumus dasar: ΔTb = Kb × (m × i). Untuk campuran, (m × i) mewakili jumlah total partikel dari semua zat terlarut.
m_total efektif = ΔTb / Kb = 0.4 °C / 0.52 °C kg/mol ≈ 0.7692 mol/kg
Nilai 0.7692 mol/kg ini bukan molalitas urea atau BaCl₂, melainkan jumlah mol partikel (ion+molekul) per kilogram pelarut.
Memisahkan Kontribusi Molalitas Urea dan BaCl₂
Langkah kritis berikutnya adalah menghitung kontribusi partikel dari BaCl₂. Kita perlu mengetahui massa pelarut (air). Jika diketahui massa larutan total dan massa BaCl₂, maka massa air = massa larutan – massa BaCl₂. Misal, jika massa larutan = 510 g dan massa BaCl₂ = 10 g, maka massa air = 500 g = 0.5 kg.
Kemudian hitung mol BaCl₂ = massanya / massa molar = 10 g / 208.23 g/mol ≈ 0.0480 mol. Molalitas BaCl₂ = mol / kg air = 0.0480 mol / 0.5 kg = 0.0960 mol/kg. Karena BaCl₂ memiliki i=3, kontribusi partikelnya adalah: m_BaCl₂ × i = 0.0960 mol/kg × 3 = 0.2880 mol partikel/kg.
Kontribusi partikel dari urea adalah selisih antara molalitas total efektif dan kontribusi BaCl₂: 0.7692 – 0.2880 = 0.4812 mol partikel/kg. Karena urea non-elektrolit (i=1), maka molalitas urea itu sendiri sama dengan kontribusi partikelnya, yaitu m_urea = 0.4812 mol/kg.
Perhitungan Massa Urea Akhir
Dari molalitas urea dan massa pelarut (air), kita dapat menghitung mol urea yang ada: mol urea = m_urea × massa air (dalam kg) = 0.4812 mol/kg × 0.5 kg = 0.2406 mol. Terakhir, massa urea diperoleh dari: massa urea = mol urea × massa molar urea = 0.2406 mol × 60.06 g/mol ≈ 14.45 gram.
Berikut ringkasan data perhitungan dalam bentuk :
| Variabel | Nilai | Satuan | Keterangan |
|---|---|---|---|
| ΔTb | 0.4 | °C | Dihitung dari pengamatan |
| m_total efektif | 0.7692 | mol partikel/kg | ΔTb / Kb |
| Massa air | 500 | g (0.5 kg) | Massa larutan – massa BaCl₂ |
| Mol BaCl₂ | 0.0480 | mol | Massa / Mr (208.23) |
| Kontribusi BaCl₂ (m×i) | 0.2880 | mol partikel/kg | Molalitas_BaCl₂ × 3 |
| Kontribusi Urea (m×i) | 0.4812 | mol partikel/kg | m_total efektif – kontribusi BaCl₂ |
| Molalitas Urea (m) | 0.4812 | mol/kg | Sama dengan kontribusinya (i=1) |
| Mol Urea | 0.2406 | mol | m_urea × kg air |
| Massa Urea | 14.45 | gram | Mol × Mr (60.06) |
Ilustrasi dan Contoh Perhitungan Lengkap
Mari kita rangkikan seluruh prosedur tersebut dalam sebuah contoh numerik yang koheren dari awal hingga akhir. Anggaplah kita melakukan eksperimen dengan data berikut: Sebanyak 10 gram BaCl₂ dan sejumlah urea dilarutkan dalam air hingga membentuk 510 gram larutan. Titik didih larutan ini terukur 100,4°C pada tekanan 1 atm.
Contoh Numerik dengan Asumsi Kritis
Perhitungan mengikuti alur logis yang telah dijelaskan. Beberapa asumsi kritis yang kita pegang dalam perhitungan ini adalah:
1. Titik didih air murni tepat 100,0°C pada tekanan 1 atm.
- Konstanta Kb air adalah 0,52 °C kg/mol.
- BaCl₂ terdisosiasi sempurna dalam air (derajat ionisasi = 1), sehingga faktor Van’t Hoff (i) = 3.
- Urea adalah non-elektrolit sempurna dengan i = 1.
- Tidak terjadi interaksi khusus antara ion BaCl₂ dan molekul urea yang mengubah sifat koligatifnya.
Dengan asumsi-asumsi tersebut, perhitungan berjalan seperti yang telah dirinci pada bagian sebelumnya, menghasilkan massa urea sebesar sekitar 14,45 gram.
Diagram Alur Penyelesaian Masalah
Urutan logis penyelesaian dapat digambarkan sebagai diagram alur tekstual berikut: Mulai dari Data Input (Tb larutan, massa BaCl₂, massa larutan, Kb, Tb° air) → Hitung ΔTb → Hitung Molalitas Total Efektif (ΔTb/Kb) → Hitung Massa Air (massa larutan – massa BaCl₂) → Hitung Kontribusi Partikel BaCl₂ (mol BaCl₂/kg air × 3) → Hitung Kontribusi Partikel Urea (Molalitas Total Efektif – Kontribusi BaCl₂) → Karena i_urea=1, diperoleh Molalitas Urea → Hitung Mol Urea (m_urea × kg air) → Hitung Massa Urea (mol urea × Mr urea) → Output (Massa Urea dalam gram).
Setiap langkah bersifat deterministik, di mana keluaran dari satu langkah menjadi masukan untuk langkah berikutnya.
Faktor-Faktor yang Mempengaruhi Akurasi Hasil
Hasil perhitungan massa urea yang kita peroleh sangat bergantung pada akurasi data masukan dan validitas asumsi yang kita buat. Dalam setting laboratorium nyata atau aplikasi industri, beberapa faktor dapat menyebabkan deviasi antara hasil hitung dan nilai sebenarnya. Memahami sumber ketidakpastian ini penting untuk mengevaluasi keandalan metode ini.
Pengaruh Kesalahan Pengukuran Titik Didih
Source: co.id
Pengukuran titik didih secara eksperimen rentan terhadap kesalahan. Termometer yang tidak dikalibrasi, pembacaan yang kurang teliti, atau ketidakstabilan pendidihan dapat menyebabkan kesalahan pada nilai Tb larutan. Misalnya, kesalahan baca sebesar 0,1°C (misalnya 100,3°C dibaca sebagai 100,4°C) akan langsung mengubah nilai ΔTb sebesar 0,1°C. Mengingat ΔTb total hanya 0,4°C, kesalahan relatifnya menjadi 25%, yang akan berpropagasi secara signifikan ke perhitungan molalitas total dan akhirnya massa urea.
Oleh karena itu, pengukuran suhu harus dilakukan dengan instrumentasi yang presisi dan teknik yang benar.
Dampak Kemurnian Zat Terlarut
Asumsi kita bahwa urea murni (non-elektrolit, i=1) dan BaCl₂ murni (elektrolit kuat, i=3) mungkin tidak selalu valid. Jika urea terkontaminasi dengan senyawa ionik atau jika memiliki pengotor yang bersifat elektrolit, maka kontribusi partikelnya akan lebih besar dari yang dihitung, sehingga massa urea yang dihitung akan lebih tinggi dari massa sebenarnya. Sebaliknya, jika BaCl₂ tidak terdisosiasi sempurna (misalnya karena pembentukan ion pasangan dalam larutan pekat), nilai i efektifnya akan kurang dari 3.
Hal ini menyebabkan kita mengestimasi kontribusi BaCl₂ terlalu tinggi, sehingga kontribusi urea yang dihitung menjadi terlalu rendah, dan akhirnya massa urea yang diperoleh juga rendah.
Pengaruh Tekanan Atmosfer terhadap Titik Didih
Perhitungan ini sangat bergantung pada nilai titik didih air murni (Tb°) yang kita gunakan, yaitu 100,0°C. Nilai ini hanya benar pada tekanan atmosfer standar (1 atm atau 760 mmHg). Di daerah dengan elevasi tinggi, tekanan atmosfer lebih rendah, sehingga titik didih air murni bisa turun menjadi 98°C atau bahkan lebih rendah. Jika kita tetap menggunakan Tb° = 100°C dalam perhitungan di lokasi tersebut, nilai ΔTb yang kita hitung akan sangat besar dan salah, yang berujung pada hasil massa urea yang fantastis dan tidak akurat.
Implikasinya, tekanan harus dikontrol atau dikoreksi dalam pengukuran titik didih untuk tujuan analisis kuantitatif yang presisi.
Akhir Kata
Dari rangkaian perhitungan untuk menentukan massa urea dalam larutan BaCl₂, kita mendapatkan lebih dari sekadar angka akhir. Kita menyelami pelajaran tentang ketergantungan dan kontribusi unik setiap komponen dalam sebuah sistem. Seperti dalam kehidupan, keberadaan zat terlarut elektrolit dan non-elektrolit yang bersama-sama mengubah titik didih mengingatkan bahwa setiap elemen, dengan caranya sendiri, membawa pengaruh terhadap keseluruhan. Pemahaman ini tidak hanya menyelesaikan masalah kimia, tetapi juga memperkaya perspektif tentang interaksi dan keseimbangan yang ada di sekitar kita.
Pertanyaan Umum (FAQ): Menentukan Massa CO(NH₂)₂ Dalam Larutan BaCl₂ Pada Titik Didih 100,4 °C
Apakah tekanan udara memengaruhi hasil perhitungan ini?
Ya, secara signifikan. Konstanta kenaikan titik didih (Kb) air biasanya ditentukan pada tekanan 1 atm. Jika tekanan atmosfer saat pengukuran titik didih berbeda, titik didih air murni (sebagai acuan) akan berubah, sehingga nilai ΔTb yang dihitung menjadi tidak akurat dan berdampak pada hasil akhir massa urea.
Bagaimana jika urea yang digunakan tidak murni dan mengandung sedikit air?
Ketidakmurnian urea, seperti kandungan air, akan mengurangi jumlah molekul urea aktual dalam sampel. Massa yang ditimbang akan mencakup pengotor, sehingga massa urea sebenarnya yang berkontribusi pada sifat koligatif lebih kecil. Hal ini menyebabkan hasil perhitungan massa urea menjadi overestimate dari nilai sebenarnya.
Mengapa kita perlu memisahkan kontribusi molalitas urea dan BaCl₂?
Karena kenaikan titik didih (ΔTb) yang diamati adalah hasil gabungan dari kedua zat terlarut. BaCl₂ sebagai elektrolit memberikan pengaruh yang lebih besar per mol-nya karena faktor Van’t Hoff (i). Untuk menemukan massa urea, kita harus menghitung kontribusi BaCl₂ terlebih dahulu, lalu mengurangkannya dari ΔTb total untuk mendapatkan bagian yang hanya berasal dari urea.
Apakah metode ini bisa digunakan untuk campuran lebih dari dua zat terlarut?
Prinsipnya bisa, tetapi menjadi jauh lebih kompleks. Diperlukan data tambahan seperti massa dan sifat tiap zat (elektrolit/non-elektrolit). Persamaan akan melibatkan penjumlahan kontribusi ΔTb dari semua komponen. Solusinya mungkin memerlukan lebih dari satu data sifat koligatif atau informasi lain untuk menyelesaikan sistem persamaan.
