Hitung pH larutan asam oksalat 11,25 g dalam 500 ml air – Hitung pH larutan asam oksalat 11,25 g dalam 500 ml air terdengar seperti soal textbook yang kaku, tapi percayalah, di balik angka-angka itu ada cerita menarik tentang bagaimana sih asam lemah ini bersikap saat bertemu air. Kita akan mengupasnya bukan sekadar dengan rumus, tapi dengan logika yang bikin kamu paham sampai ke akar-akarnya. Bayangkan ini seperti membongkar rahasia sebuah senyawa yang ternyata punya dua sisi kepribadian saat melepas ion H+-nya.
Asam oksalat, atau H₂C₂O₄, adalah asam organik diprotik yang lemah. Artinya, ia tidak melepaskan semua ion hidrogennya sekaligus ke dalam air, melainkan bertahap dengan konstanta disosiasi (Ka) yang kecil. Perhitungan pH-nya punya nuansa tersendiri, berbeda dengan asam kuat. Kita akan mulai dari mengkonversi massa menjadi mol, mencari konsentrasi, lalu menggunakan pendekatan khusus untuk asam lemah dengan mempertimbangkan Ka pertamanya yang bernilai sekitar 5.6 × 10⁻².
Proses ini adalah fondasi dalam memahami perilaku larutan asam lemah secara kuantitatif.
Pengantar Asam Oksalat dan Konsep pH
Asam oksalat, atau H₂C₂O₄, adalah asam organik yang cukup sering muncul di laboratorium dan kehidupan sehari-hari. Senyawa ini termasuk dalam golongan asam diprotik lemah, artinya ia memiliki dua atom hidrogen yang dapat dilepaskan secara bertahap ketika dilarutkan dalam air. Pelepasan ini tidak terjadi sekaligus, melainkan melalui dua tahap kesetimbangan yang masing-masing memiliki kekuatan asam atau konstanta disosiasi (Ka) yang berbeda.
Perhitungan pH larutan asam oksalat 11,25 g dalam 500 ml air, selain soal ketelitian teknis, juga memerlukan pendekatan yang terstruktur. Prinsip ini serupa dengan bagaimana sebuah Strategi Pameran Seni Rupa Capai Tujuan , di mana perencanaan matang menentukan keberhasilan akhir. Jadi, setelah merancang strategi, kembali fokus pada perhitungan molaritas dan konstanta disosiasi asam oksalat untuk mendapatkan nilai pH yang akurat.
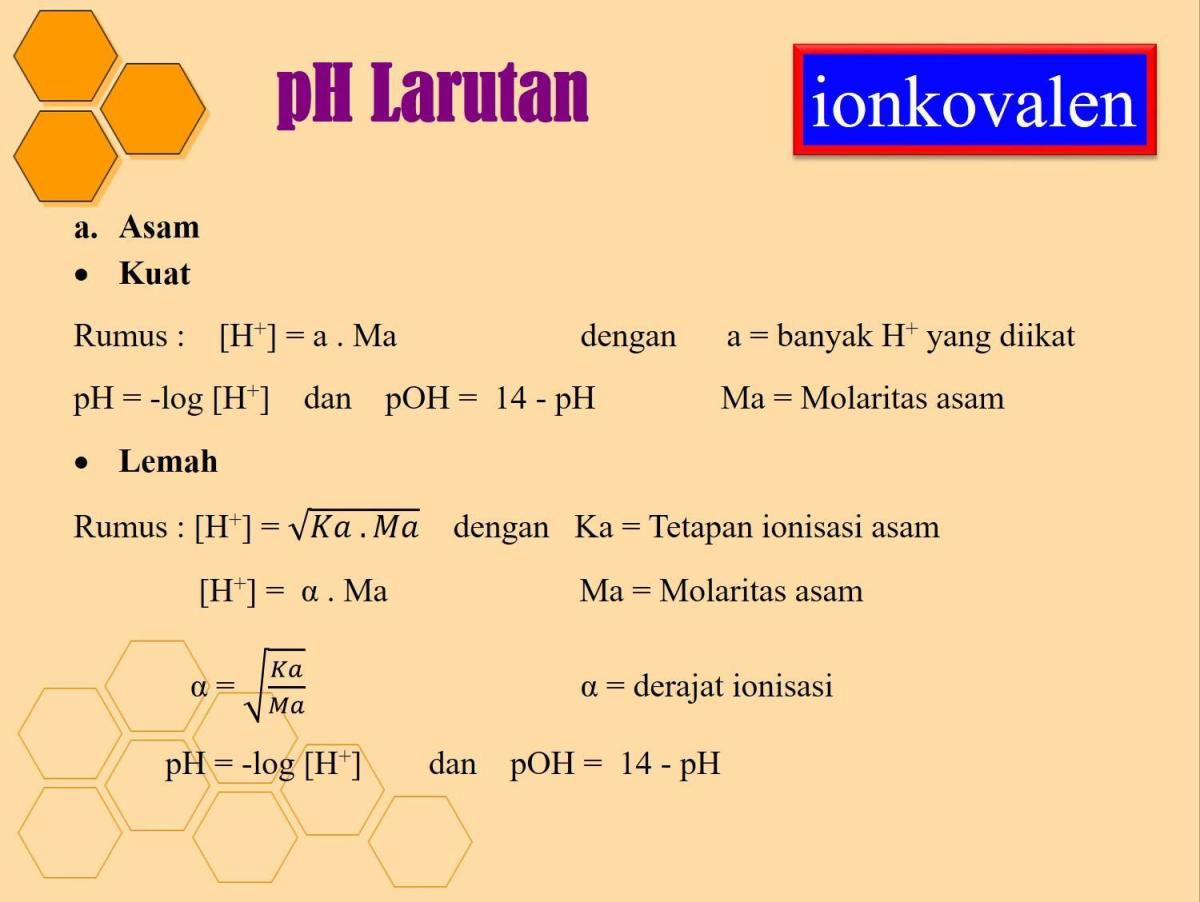
Perhitungan pH larutan asam lemah seperti ini adalah fondasi penting dalam kimia larutan. Berbeda dengan asam kuat yang terionisasi sempurna, perhitungan untuk asam lemah harus mempertimbangkan derajat ionisasi yang kecil dan nilai Ka-nya. Untuk asam lemah monoprotik sederhana, pendekatan perhitungannya menggunakan rumus yang relatif langsung, yaitu [H⁺] = √(Ka . M), dengan asumsi bahwa perubahan konsentrasi asam awal akibat ionisasi sangat kecil sehingga dapat diabaikan.
Untuk asam diprotik seperti asam oksalat, kita sering kali hanya menggunakan nilai Ka pertama (Ka₁) dalam perhitungan awal karena kontribusi ion H⁺ dari tahap ionisasi kedua biasanya sangat kecil.
Sifat Umum Asam Oksalat dan Pendekatan Perhitungan pH
Dalam bentuk padatannya, asam oksalat umumnya ditemukan sebagai dihidrat, dengan rumus H₂C₂O₄·2H₂O. Senyawa ini berbentuk kristal putih dan larut dengan baik dalam air. Sifat keasamannya yang cukup signifikan (dengan Ka₁ sekitar 5.6 × 10⁻²) membuatnya berguna dalam berbagai aplikasi, mulai dari zat pereduksi dalam laboratorium hingga bahan pembersih karat dan kerak kalsium di rumah tangga. Pemahaman tentang bagaimana menghitung pH larutannya membantu dalam mengantisipasi kekuatan dan perilaku senyawa ini dalam berbagai kondisi.
Data dan Konversi yang Diperlukan
Sebelum melakukan perhitungan, kita perlu mengurai dan mengonversi semua data yang diberikan dari soal: “Hitung pH larutan asam oksalat 11,25 g dalam 500 ml air”. Dari pernyataan ini, kita dapat mengidentifikasi beberapa besaran kunci: massa zat terlarut, volume pelarut, dan identitas zat terlarut. Asumsi penting yang sering digunakan adalah bahwa asam oksalat yang dimaksud adalah bentuk dihidratnya (H₂C₂O₄·2H₂O), karena itulah bentuk yang paling umum tersedia.
Langkah pertama adalah menghitung massa molar senyawa tersebut. Massa atom relatif: H=1, C=12, O=
16. Perhitungannya: 2(H) + 2(C) + 4(O) + 2 molekul air [2*(2(H)+1(O))] = (2) + (24) + (64) + (36) = 126 g/mol. Nilai inilah yang akan kita gunakan untuk mengubah massa menjadi jumlah mol.
Tabel Data dan Konversi Awal
| Besaran | Nilai | Keterangan |
|---|---|---|
| Massa Asam Oksalat | 11,25 gram | Massa zat terlarut yang dilarutkan. |
| Volume Air | 500 mL | Volume pelarut. Perlu dikonversi ke liter. |
| Volume (V) dalam Liter | 0,5 L | Hasil konversi: 500 mL / 1000 = 0,5 L. |
| Massa Molar (Mr) H₂C₂O₄.2H₂O | 126 g/mol | Dihitung dari jumlah Ar semua atom penyusunnya. |
| Jumlah Mol (n) | 0,0893 mol | Hasil perhitungan: n = massa / Mr = 11,25 g / 126 g/mol. |
Tahapan Perhitungan Konsentrasi dan pH
Setelah data dasar terkumpul, kita dapat melanjutkan ke inti perhitungan. Proses ini melibatkan penentuan konsentrasi molar larutan, kemudian penerapan rumus kesetimbangan asam lemah dengan konstanta Ka yang tepat. Untuk asam oksalat, nilai Ka₁ = 5.6 × 10⁻² dan Ka₂ = 5.4 × 10⁻⁵. Perbedaan orde besarnya yang signifikan antara Ka₁ dan Ka₂ menjadi alasan utama mengapa ionisasi tahap kedua sering diabaikan dalam perhitungan pH awal.
Ion H⁺ yang dihasilkan dari tahap kedua sangat sedikit dibandingkan dengan yang dari tahap pertama.
Langkah-langkah Kalkulasi Utama
Source: z-dn.net
Menghitung pH larutan asam oksalat dari 11,25 g dalam 500 ml air itu seru, lho, karena kita main-main dengan konsep molaritas dan tetapan asam. Proses berpikir sistematis ini ternyata mirip dengan memahami ragam instrumen keuangan, seperti yang dijelaskan dalam artikel Enam contoh uang giral dan pengertiannya , di mana keduanya memerlukan analisis mendalam. Nah, setelah memahami konteks itu, kita kembali fokus ke perhitungan kimia: setelah molaritas diketahui, langkah berikutnya adalah menghitung ion H⁺ dari asam diprotik ini untuk menemukan pH-nya.
- Menghitung Konsentrasi Awal (M): Konsentrasi molar dihitung dari mol zat terlarut dibagi volume larutan dalam liter. M = n / V = 0,0893 mol / 0,5 L = 0,1786 M.
- Menulis Reaksi dan Rumus Kesetimbangan: Ionisasi tahap pertama: H₂C₂O₄ ⇌ H⁺ + HC₂O₄⁻. Rumus yang digunakan adalah Ka₁ = [H⁺][HC₂O₄⁻] / [H₂C₂O₄]. Dengan asumsi [H⁺] = [HC₂O₄⁻] = x, dan [H₂C₂O₄] sisa ≈ M (karena asam lemah), maka Ka₁ = x² / M.
- Substitusi dan Penyelesaian: x² = Ka₁ × M = (5.6 × 10⁻²) × (0.1786) = 1.0 × 10⁻². Maka, x = √(1.0 × 10⁻²) = 0.1 M. Jadi, [H⁺] ≈ 0.1 M.
- Menghitung pH: pH = -log[H⁺] = -log(0.1) = 1.0.
Perhitungan ini mengasumsikan bahwa pengaruh ionisasi kedua dan perubahan konsentrasi asam awal (M – x) dapat diabaikan. Untuk mendapatkan hasil yang lebih akurat, khususnya jika konsentrasi sangat encer atau nilai Ka mendekati M, persamaan kuadrat penuh perlu diselesaikan.
Faktor yang Mempengaruhi Hasil Perhitungan
Hasil pH = 1.0 yang kita dapatkan bukanlah angka mutlak. Beberapa faktor dapat menggeser nilai ini, mulai dari ketelitian data yang digunakan hingga model perhitungan yang dipilih. Pemahaman tentang faktor-faktor ini penting untuk menilai keandalan hasil dan mengetahui kapan kita perlu melakukan perhitungan yang lebih rigor.
Akurasi Nilai Ka dan Bentuk Senyawa
Nilai konstanta kesetimbangan (Ka) dapat sedikit bervariasi tergantung suhu dan sumber literatur. Penggunaan nilai Ka₁ yang berbeda, misalnya 5.9 × 10⁻² alih-alih 5.6 × 10⁻², akan memberikan hasil pH yang sedikit berbeda. Selain itu, bentuk senyawa yang digunakan sangat krusial. Jika soal ternyata merujuk pada asam oksalat anhidrat (H₂C₂O₄, Mr = 90 g/mol), maka jumlah mol dari massa 11,25 g akan menjadi 0,125 mol, sehingga konsentrasinya 0,25 M.
Perhitungan ulang dengan konsentrasi ini akan menghasilkan [H⁺] sekitar 0,118 M dan pH sekitar 0,93—perbedaan yang cukup signifikan.
Pengaruh Pengenceran dan Ionisasi Tahap Kedua
Volume pelarut berbanding terbalik dengan konsentrasi. Jika volume air dinaikkan menjadi, misalnya, 2 liter (4x lebih encer), konsentrasi menjadi 0,04465 M. Perhitungan [H⁺] menjadi √(5.6×10⁻² × 0,04465) = 0,05 M, yang memberikan pH = 1,3. Larutan menjadi kurang asam. Pada konsentrasi yang sangat rendah, kontribusi [H⁺] dari air sendiri (10⁻⁷ M) dan dari ionisasi tahap kedua (Ka₂) mulai menjadi signifikan secara proporsional dan mungkin perlu diperhitungkan untuk hasil yang sangat presisi.
Contoh Soal dan Variasi Latihan: Hitung PH Larutan Asam Oksalat 11,25 g Dalam 500 ml Air
Untuk menguasai konsep ini, cobalah berlatih dengan variasi soal berikut. Perubahan pada satu parameter saja dapat mengubah alur perhitungan dan hasil akhirnya. Tabel di bawah ini membandingkan tiga skenario berbeda yang dirancang untuk menguji pemahaman.
Perbandingan Tiga Variasi Soal
| Parameter | Soal A (Mudah) | Soal B (Menengah) | Soal C (Lanjutan) |
|---|---|---|---|
| Massa H₂C₂O₄.2H₂O | 6,3 gram | 11,25 gram | 18 gram |
| Volume Larutan | 500 mL | 250 mL | 1 L |
| Jenis Asam | Dihidrat (Mr=126) | Dihidrat (Mr=126) | Anhidrat (Mr=90) |
| Tantangan | Hitung pH. | Hitung pH, lalu bandingkan jika volumenya jadi 1 L. | Hitung pH, dan perkirakan apakah perhitungan dengan Ka₂ diperlukan. |
Tips penting: Selalu periksa satuan (gram vs mg, mL vs L) dan pastikan bentuk senyawa (hidrat atau anhidrat) sebelum memulai. Lakukan uji asumsi: jika [H⁺] yang dihitung lebih dari 5% dari konsentrasi asam awal, gunakan persamaan kuadrat.
Aplikasi dan Ilustrasi Konseptual
Proses disosiasi asam oksalat dalam air dapat dibayangkan seperti dua pintu yang berurutan dan kekuatan pegasnya berbeda. Pintu pertama (pelepasan H⁺ pertama) relatif mudah terbuka (Ka₁ lebih besar), melepaskan ion H⁺ dan meninggalkan ion HC₂O₄⁻. Ion ini kemudian menghadapi pintu kedua yang pegasnya jauh lebih kuat (Ka₂ jauh lebih kecil), sehingga hanya sedikit sekali ion HC₂O₄⁻ yang berhasil melepaskan H⁺ keduanya menjadi ion oksalat (C₂O₄²⁻).
Pada akhirnya, kerumunan utama di dalam larutan adalah H₂C₂O₄ yang belum terion, H⁺, dan HC₂O₄⁻.
Penerapan dalam Analitik dan Kehidupan Sehari-hari, Hitung pH larutan asam oksalat 11,25 g dalam 500 ml air
Dalam kimia analitik, asam oksalat sering digunakan sebagai zat pembaku primer untuk menstandarisasi larutan basa seperti KMnO₄ dalam titrasi redoks atau NaOH dalam titrasi asam-basa. Pengetahuan tentang konsentrasi dan pH pastinya sangat krusial untuk keakuratan titrasi ini. Di industri, senyawa ini digunakan untuk membersihkan logam, memutihkan tekstil, dan sebagai bahan baku untuk berbagai sintesis kimia.
Di rumah, kita mungkin menemukan garamnya, seperti kalium oksalat, dalam beberapa produk pembersih khusus untuk batu atau kayu. Bahkan, asam oksalat secara alami terdapat dalam konsentrasi rendah pada beberapa sayuran seperti bayam dan rhubarb. Pemahaman tentang sifat keasamannya membantu menjelaskan mengapa memasak dapat mengurangi kadar asam oksalat dan mengapa konsumsi bagian daun rhubarb dalam jumlah besar (yang asam oksalatnya tinggi) bisa berbahaya.
Ringkasan Penutup
Jadi, setelah menjalani perhitungan step-by-step, pH larutan dari 11,25 gram asam oksalat dalam 500 ml air bukan lagi sekadar angka. Ia adalah bukti bagaimana konsep molaritas, konstanta kesetimbangan, dan pendekatan matematis bersatu untuk mendeskripsikan sifat keasaman suatu larutan. Perhitungan ini mengajarkan ketelitian, mulai dari memastikan massa molar yang tepat hingga memahami kapan konstanta disosiasi kedua bisa diabaikan. Pada akhirnya, kimia adalah tentang menerjemahkan sifat materi ke dalam bahasa angka yang bisa kita ukur dan pahami.
Pertanyaan Umum (FAQ)
Apakah hasil pH akan sama jika asam oksalatnya dilarutkan dalam air panas?
Tidak persis sama. Suhu mempengaruhi nilai konstanta disosiasi (Ka) dan tingkat disosiasi air (Kw). Perhitungan kita umumnya mengasumsikan suhu kamar (25°C). Pada suhu berbeda, nilai Ka bisa berubah sehingga perhitungan pH-nya juga akan berbeda.
Mengapa dalam perhitungan sering digunakan massa molar asam oksalat dihidrat (H₂C₂O₄.2H₂O)?
Karena asam oksalat paling stabil dan umum ditemukan dalam bentuk kristal dihidratnya. Menggunakan massa molar yang salah (misalnya massa molar anhidrat untuk sampel dihidrat) akan menyebabkan kesalahan besar dalam menghitung jumlah mol, yang berujung pada hasil konsentrasi dan pH yang tidak akurat.
Bisakah perhitungan ini diterapkan untuk campuran asam oksalat dengan asam lain?
Tidak langsung. Jika ada asam lain dalam larutan yang sama, perhitungan pH menjadi lebih kompleks karena melibatkan kesetimbangan bersaing dari beberapa sumber ion H+. Diperlukan pendekatan yang berbeda, seperti penggunaan persamaan charge balance atau perhitungan numerik.
Apa dampak praktis jika perhitungan pH asam oksalat ini meleset?
Dalam konteks industri, seperti pembersihan logam atau pengaturan proses, pH yang tidak tepat dapat mengurangi efektivitas asam oksalat atau justru menyebabkan kerusakan material karena korosi yang tidak terkendali. Dalam analisis laboratorium, ketidakakuratan pH dapat mempengaruhi hasil titrasi atau sintesis senyawa.

