Konfigurasi Elektron, Valensi Unsur, dan Ion bukan sekadar deretan angka dan huruf dalam buku pelajaran, melainkan peta harta karun yang mengungkap rahasia terdalam setiap materi di alam semesta. Dari kilauan logam hingga reaksi dahsyat, semua bermula dari tarian elektron-elektron kecil di sekitar inti atom. Memahami pola tarian ini berarti membuka kunci untuk memprediksi bagaimana unsur-unsur saling berinteraksi, berikatan, dan membentuk dunia material yang kita kenal.
Prinsip-prinsip fundamental seperti aturan Aufbau, Hund, dan Pauli menjadi fondasi dalam menyusun konfigurasi elektron, layaknya aturan main dalam permainan strategi tingkat atom. Melalui pemahaman ini, kita dapat menjelaskan mengapa kromium memiliki konfigurasi yang unik, bagaimana sifat keperiodikan berubah, serta alasan di balik muatan ion tertentu. Pengetahuan ini menjadi landasan kokoh dalam kimia modern, mulai dari merancang material baru hingga memahami proses biologis dalam sel.
Prinsip dasar kimia seperti konfigurasi elektron dan valensi unsur mengatur bagaimana atom mencapai kestabilan, serupa dengan prinsip seleksi dalam pertanian untuk mendapatkan bibit unggul. Dalam konteks ini, penerapan Teknik Terbaik Memperbanyak Bibit Mangga Cepat untuk Petani dapat dianalogikan sebagai upaya mencapai “kestabilan” produktivitas kebun. Pada akhirnya, baik dalam reaksi kimia maupun budidaya, pemahaman mendalam tentang fondasi dan prosesnya adalah kunci keberhasilan yang fundamental.
Dasar Konfigurasi Elektron: Konfigurasi Elektron, Valensi Unsur, Dan Ion
Pemahaman tentang konfigurasi elektron ibarat memiliki peta harta karun untuk memahami sifat-sifat unsur. Konfigurasi ini menggambarkan bagaimana elektron-elektron tersusun di sekitar inti atom dalam orbital-orbitalnya. Susunan ini tidaklah sembarangan, melainkan mengikuti seperangkat aturan utama yang menjadi fondasi dalam kimia modern.
Prinsip Aufbau, Aturan Hund, dan Larangan Pauli
Penyusunan konfigurasi elektron diatur oleh tiga prinsip fundamental. Prinsip Aufbau menyatakan bahwa elektron akan mengisi orbital dari tingkat energi terendah ke tertinggi, mengikuti urutan seperti 1s, 2s, 2p, 3s, dan seterusnya. Aturan Hund mengatur pengisian elektron pada orbital-orbital yang setara (misalnya, ketiga orbital p), di mana elektron akan menempati orbital secara sendiri-sendiri dengan spin paralel sebelum berpasangan. Larangan Pauli menegaskan bahwa tidak ada dua elektron dalam satu atom yang dapat memiliki keempat bilangan kuantum yang sama persis; ini berarti satu orbital maksimal diisi dua elektron dengan spin yang berlawanan.
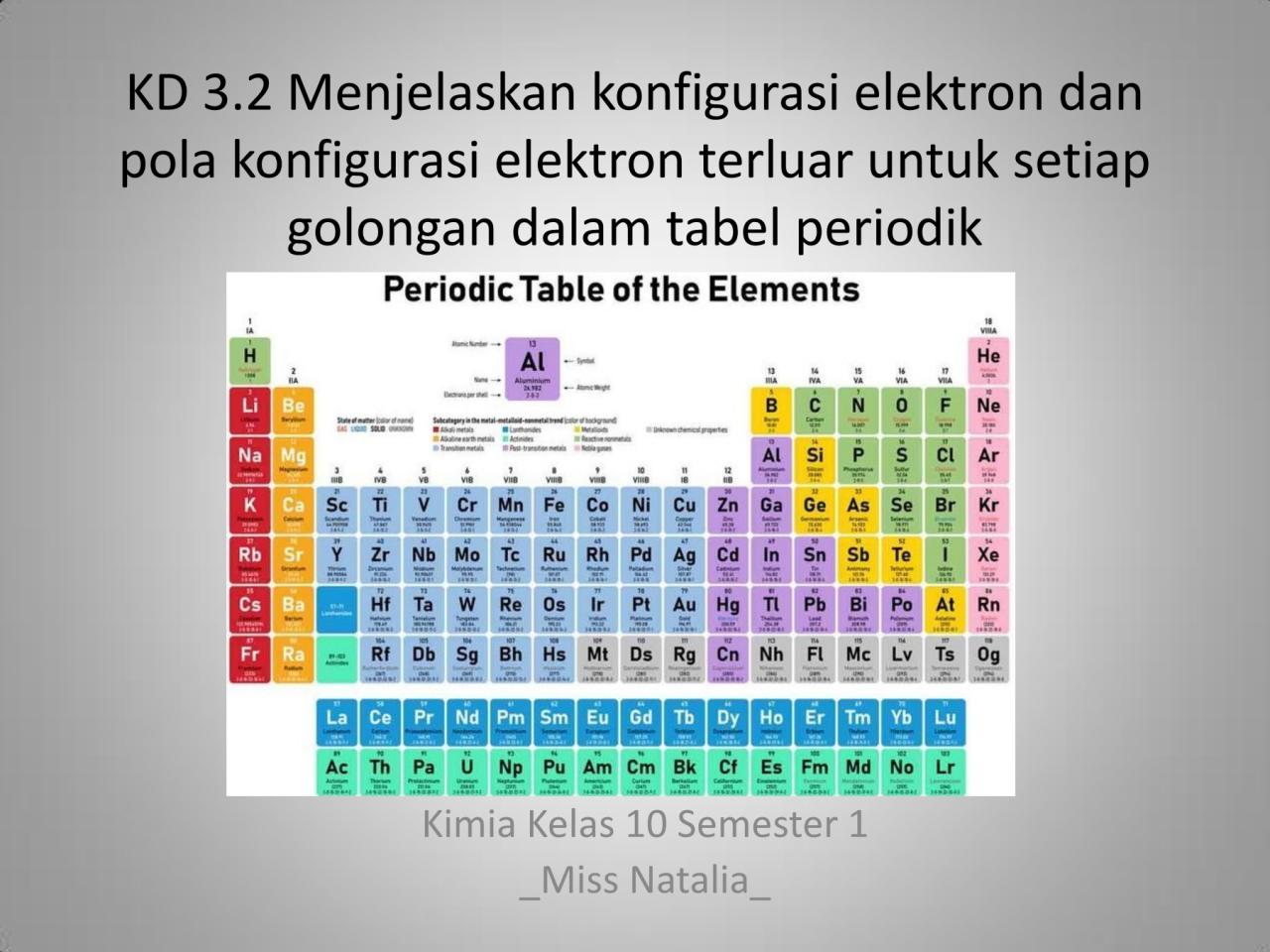
Konfigurasi Elektron Unsur Golongan Utama
Pola konfigurasi elektron menunjukkan periodisitas yang jelas dalam tabel periodik. Unsur-unsur dalam golongan yang sama memiliki konfigurasi elektron valensi yang serupa, yang menjelaskan kemiripan sifat kimia mereka. Tabel berikut membandingkan konfigurasi elektron untuk unsur-unsur periode kedua dan ketiga dari golongan utama.
Pemahaman mendalam tentang konfigurasi elektron dan valensi unsur menjadi kunci untuk memprediksi pembentukan ion dan senyawa, seperti PbCl₂. Konsep ini langsung teraplikasi dalam perhitungan kimia analitik, misalnya saat menentukan Gram NaCl Minimum untuk Endapan PbCl₂ dalam Larutan 0,8×10⁻³ M Pb(NO₃)₂ (2,08 L). Analisis stoikiometri yang presiden ini, pada akhirnya, berakar dari sifat dasar atom dan kecenderungannya mencapai kestabilan melalui ikatan ionik.
| Golongan | Unsur (Periode 2) | Unsur (Periode 3) | Konfigurasi Elektron Valensi |
|---|---|---|---|
| IA (Alkali) | Litium (Li) | Natrium (Na) | ns¹ |
| IIA (Alkali Tanah) | Berilium (Be) | Magnesium (Mg) | ns² |
| IIIA (Boron) | Boron (B) | Aluminium (Al) | ns² np¹ |
| IVA (Karbon) | Karbon (C) | Silikon (Si) | ns² np² |
| VA (Nitrogen) | Nitrogen (N) | Fosfor (P) | ns² np³ |
| VIA (Oksigen) | Oksigen (O) | Belerang (S) | ns² np⁴ |
| VIIA (Halogen) | Fluor (F) | Klor (Cl) | ns² np⁵ |
| VIIIA (Gas Mulia) | Neon (Ne) | Argon (Ar) | ns² np⁶ |
Langkah Penulisan dan Penyimpangan Konfigurasi
Penulisan konfigurasi elektron umumnya mengikuti urutan Aufbau. Sebagai contoh, besi (Fe, nomor atom 26) diisi secara berurutan: 1s² 2s² 2p⁶ 3s² 3p⁶ 4s² 3d⁶. Perhatikan bahwa setelah 3p penuh, elektron mengisi orbital 4s yang lebih rendah energinya sebelum 3d. Namun, terdapat penyimpangan penting yang disebabkan oleh stabilitas setengah penuh dan penuh penuh subkulit d. Kromium (Cr, nomor atom 24) tidak mengikuti pola 4s² 3d⁴, melainkan 4s¹ 3d⁵.
Konfigurasi ini lebih stabil karena orbital d terisi setengah penuh.
Konfigurasi Penuh dan Konfigurasi Valensi
Penting untuk membedakan antara konfigurasi elektron penuh dan konfigurasi elektron valensi. Konfigurasi penuh menggambarkan seluruh elektron dalam atom, sementara konfigurasi valensi hanya menampilkan elektron pada kulit terluar (kulit valensi) yang terlibat dalam pembentukan ikatan kimia.
- Konfigurasi Elektron Penuh: Menunjukkan semua orbital yang terisi. Contoh: Natrium (Na, nomor atom 11): 1s² 2s² 2p⁶ 3s¹.
- Konfigurasi Elektron Valensi: Hanya menampilkan elektron di kulit terluar. Contoh: Natrium (Na): 3s¹. Klor (Cl, nomor atom 17): 3s² 3p⁵.
Elektron Valensi dan Sifat Unsur
Elektron valensi, yaitu elektron yang berada di kulit terluar atom, memegang peran kunci sebagai “duta” kimia suatu unsur. Jumlah dan susunannya secara langsung menentukan bagaimana suatu unsur berinteraksi dengan unsur lain, membentuk pola sifat periodik yang dapat diprediksi dalam tabel periodik.
Memahami konfigurasi elektron dan valensi unsur sangat krusial untuk memprediksi bagaimana suatu atom akan berikatan atau membentuk ion. Prinsip stabilitas ini, menariknya, memiliki paralel dalam ekonomi, di mana Hubungan MPC dan MPS menggambarkan kecenderungan perilaku konsumsi dan tabungan, mirip seperti kecenderungan atom mencapai kestabilan. Dengan demikian, baik dalam reaksi kimia maupun aktivitas ekonomi, pemahaman mendalam tentang kecenderungan dasar menjadi kunci penjelasan yang otoritatif.
Hubungan Elektron Valensi dengan Tabel Periodik
Letak suatu unsur dalam tabel periodik secara langsung mencerminkan konfigurasi elektron valensinya. Nomor golongan (untuk golongan utama, IA hingga VIIIA) menunjukkan jumlah elektron valensi. Sebagai contoh, semua unsur golongan IA memiliki 1 elektron valensi (ns¹), dan golongan VIIA memiliki 7 elektron valensi (ns² np⁵). Sementara itu, nomor periode menunjukkan kulit valensi (kulit ke-n) tempat elektron valensi tersebut berada, yang berkaitan erat dengan ukuran atom.
Sifat Periodik Unsur Periode Ketiga
Sifat-sifat periodik seperti jari-jari atom, energi ionisasi, afinitas elektron, dan keelektronegatifan mengalami perubahan yang sistematis sepanjang satu periode, dipengaruhi oleh bertambahnya muatan inti efektif dan jumlah elektron valensi. Data untuk unsur-unsur periode ketiga menggambarkan tren ini dengan jelas.
| Unsur (Na ke Cl) | Jari-jari Atom (pm) | Energi Ionisasi (kJ/mol) | Keelektronegatifan (Pauling) |
|---|---|---|---|
| Natrium (Na) | 186 | 496 | 0.93 |
| Magnesium (Mg) | 160 | 738 | 1.31 |
| Aluminium (Al) | 143 | 578 | 1.61 |
| Silikon (Si) | 117 | 786 | 1.90 |
| Fosfor (P) | 115 | 1012 | 2.19 |
| Belerang (S) | 104 | 1000 | 2.58 |
| Klor (Cl) | 99 | 1251 | 3.16 |
Peran Elektron Valensi dalam Pembentukan Ikatan
Sifat kimia suatu unsur sangat ditentukan oleh upayanya mencapai konfigurasi elektron yang stabil, umumnya seperti gas mulia. Unsur dengan sedikit elektron valensi (logam, seperti golongan IA/IIA) cenderung melepaskan elektron untuk membentuk kation, sehingga membentuk ikatan ionik dengan nonlogam. Sebaliknya, unsur dengan banyak elektron valensi (nonlogam, seperti golongan VIA/VIIA) cenderung menarik atau berbagi elektron untuk mencapai oktet, membentuk ikatan kovalen atau menerima elektron menjadi anion dalam ikatan ionik.
Stabilitas Konfigurasi Gas Mulia, Konfigurasi Elektron, Valensi Unsur, dan Ion
Kestabilan luar biasa gas mulia menjadi acuan bagi semua unsur lainnya dalam berikatan. Konfigurasi elektron valensi mereka yang penuh (ns² np⁶ untuk Ne, Ar, Kr, Xe, Rn) membuatnya sangat sulit untuk melepaskan atau menerima elektron. Akibatnya, energi ionisasi dan afinitas elektronnya sangat tinggi, serta keelektronegatifannya tidak terdefinisi dengan skala konvensional karena ketidakaktifannya.
Keadaan stabil gas mulia, seperti Argon dengan konfigurasi valensi 3s² 3p⁶, merupakan kondisi ideal yang dicari unsur lain melalui reaksi kimia. Konfigurasi penuh kulit terluar ini memberikan kestabilan energi yang maksimal, menjadikan gas mulia hampir tidak reaktif dalam kondisi normal.
Pembentukan Ion dan Konfigurasinya
Atom-atom yang tidak stabil dengan sendirinya akan berusaha mencapai kestabilan melalui pembentukan ion. Proses ini melibatkan transfer elektron dari satu atom ke atom lain, sehingga menghasilkan partikel bermuatan yang memiliki konfigurasi elektron identik dengan gas mulia terdekat. Pemahaman tentang transformasi ini menjelaskan dasar dari ikatan ionik dan sifat senyawa ionik.
Proses Pembentukan Kation dan Anion
Atom logam, yang memiliki energi ionisasi rendah dan sedikit elektron valensi, cenderung melepaskan elektron-elektron valensinya. Pelepasan ini menghasilkan ion bermuatan positif yang disebut kation, dengan ukuran lebih kecil dari atom netralnya karena berkurangnya tolakan antar elektron. Sebaliknya, atom nonlogam dengan afinitas elektron tinggi cenderung menangkap elektron untuk mengisi kulit valensinya, membentuk ion bermuatan negatif atau anion, yang ukurannya lebih besar dari atom netralnya akibat meningkatnya tolakan elektron.
Perbandingan Konfigurasi Atom Netral dan Ion
Perubahan konfigurasi elektron selama pembentukan ion mengikuti pola yang dapat diprediksi. Tabel berikut menunjukkan bagaimana atom-atom mencapai konfigurasi gas mulia (Ne atau Ar) setelah menjadi ion.
| Unsur | Konfigurasi Atom Netral | Ion yang Dibentuk | Konfigurasi Ion |
|---|---|---|---|
| Natrium (Na) | 1s² 2s² 2p⁶ 3s¹ | Na⁺ | 1s² 2s² 2p⁶ (seperti Ne) |
| Magnesium (Mg) | 1s² 2s² 2p⁶ 3s² | Mg²⁺ | 1s² 2s² 2p⁶ (seperti Ne) |
| Aluminium (Al) | 1s² 2s² 2p⁶ 3s² 3p¹ | Al³⁺ | 1s² 2s² 2p⁶ (seperti Ne) |
| Kalsium (Ca) | 1s² 2s² 2p⁶ 3s² 3p⁶ 4s² | Ca²⁺ | 1s² 2s² 2p⁶ 3s² 3p⁶ (seperti Ar) |
| Belerang (S) | 1s² 2s² 2p⁶ 3s² 3p⁴ | S²⁻ | 1s² 2s² 2p⁶ 3s² 3p⁶ (seperti Ar) |
| Klor (Cl) | 1s² 2s² 2p⁶ 3s² 3p⁵ | Cl⁻ | 1s² 2s² 2p⁶ 3s² 3p⁶ (seperti Ar) |
Konsep Isotop Elektronik
Isotop elektronik merujuk pada ion-ion dari unsur yang berbeda tetapi memiliki konfigurasi elektron yang identik. Fenomena ini terjadi karena mereka telah mencapai konfigurasi gas mulia yang sama setelah kehilangan atau mendapatkan elektron. Contoh klasik adalah ion Na⁺, Mg²⁺, Al³⁺, dan O²⁻, F⁻, Ne, yang semuanya memiliki konfigurasi elektron 1s² 2s² 2p⁶, persis seperti atom neon. Meski konfigurasinya sama, sifat fisik seperti muatan dan jari-jari ionnya berbeda.
Ilustrasi Pembentukan Ion Natrium dan Klorida
Bayangkan sebuah atom natrium dengan 11 elektron, di mana satu elektron kesepian beredar di kulit terluarnya (3s¹). Dari kejauhan, atom klorin dengan 17 elektron tampak “lapar” akan satu elektron untuk melengkapi kulit terluarnya menjadi
8. Ketika mereka bertemu, atom natrium dengan rela memberikan elektron tunggalnya itu kepada klorin. Setelah transfer, struktur natrium berubah: kulit ketiganya hilang, meninggalkan konfigurasi stabil 2s² 2p⁶ seperti neon, tetapi dengan inti bermuatan +11 yang hanya dikelilingi 10 elektron, sehingga menjadi ion Na⁺.
Di sisi lain, klorin yang menerima elektron kini memiliki 18 elektron melingkupi inti +17, konfigurasinya menjadi 3s² 3p⁶ seperti argon, tetapi dengan kelebihan satu elektron sehingga menjadi ion Cl⁻. Gaya tarik elektrostatik yang kuat antara Na⁺ dan Cl⁻ inilah yang membentuk ikatan ionik dalam kristal garam dapur.
Aplikasi dan Analisis Kasus
Penerapan konsep konfigurasi elektron melampaui atom dan ion sederhana, merambah ke senyawa kompleks dan analisis perbandingan sifat yang mendalam. Melalui studi kasus, kita dapat mengapresiasi kekuatan prediktif dari prinsip-prinsip dasar ini dalam menjelaskan fenomena kimia yang lebih kompleks.
Analisis Ion Kompleks [Fe(H₂O)₆]²⁺
Dalam ion kompleks heksaaquabesi(II), atom pusatnya adalah besi dalam keadaan oksidasi +2 (Fe²⁺). Konfigurasi elektron atom besi netral (Fe) adalah [Ar] 4s² 3d⁶. Ketika membentuk ion Fe²⁺, ia kehilangan dua elektron, yang berasal dari orbital 4s terlebih dahulu. Dengan demikian, konfigurasi Fe²⁺ adalah [Ar] 3d⁶. Enam elektron valensi yang penting untuk ikatan koordinasi dalam kompleks ini berasal dari orbital 3d, 4s, dan 4p yang mengalami hibridisasi.
Pada Fe²⁺ ini, terdapat enam elektron tak berpasangan di subkulit 3d yang tersedia untuk membentuk ikatan koordinasi dengan pasangan elektron bebas dari enam molekul air.
Perbandingan Sifat Magnesium Atom dan Ion
Perubahan dari atom magnesium (Mg) menjadi ion magnesium (Mg²⁺) melalui pelepasan dua elektron valensi mengakibatkan transformasi sifat yang dramatik, semata-mata karena perbedaan konfigurasi elektron.
- Sifat Fisik: Atom Mg adalah logam padat berwarna perak, konduktor listrik yang baik, dan memiliki kilau logam. Ion Mg²⁺, sebagai bagian dari senyawa ionik seperti MgO, tidak memiliki sifat-sifat logam tersebut; ia berupa partikel bermuatan dalam kisi kristal yang hanya menghantarkan listrik dalam keadaan lelehan atau larutan.
- Sifat Kimia: Atom Mg sangat reaktif, mudah teroksidasi di udara dan bereaksi kuat dengan air. Ion Mg²⁺ relatif stabil; ia tidak lagi memiliki kecenderungan untuk melepaskan elektron dan justru cenderung membentuk ikatan ionik yang kuat dengan anion, seperti dalam garam magnesium sulfat (MgSO₄).
- Ukuran: Jari-jari ion Mg²⁺ (72 pm) jauh lebih kecil daripada jari-jari atom Mg (160 pm) karena hilangnya kulit elektron terluar dan meningkatnya tarikan inti efektif terhadap elektron yang tersisa.
Prosedur Prediksi Muatan Ion Umum
Muatan ion yang umum untuk unsur-unsur golongan utama dapat diprediksi secara langsung dari konfigurasi elektron valensinya, dengan tujuan mencapai konfigurasi oktet (atau duplet untuk helium).
- Golongan IA (ns¹): Cenderung melepaskan 1 elektron valensi untuk mencapai konfigurasi gas mulia periode sebelumnya, membentuk ion bermuatan +1 (contoh: Li⁺, Na⁺, K⁺).
- Golongan IIA (ns²): Melepaskan 2 elektron valensi untuk mencapai konfigurasi gas mulia periode sebelumnya, membentuk ion bermuatan +2 (contoh: Mg²⁺, Ca²⁺, Ba²⁺).
- Golongan VIA (ns² np⁴): Memerlukan 2 elektron untuk mencapai oktet, sehingga cenderung menerima 2 elektron membentuk ion bermuatan -2 (contoh: O²⁻, S²⁻).
- Golongan VIIA (ns² np⁵): Memerlukan 1 elektron untuk mencapai oktet, sehingga cenderung menerima 1 elektron membentuk ion bermuatan -1 (contoh: F⁻, Cl⁻, Br⁻).
Alasan Muatan Ion Aluminium Al³⁺
Aluminium (nomor atom 13) memiliki konfigurasi elektron [Ne] 3s² 3p¹. Untuk mencapai kestabilan konfigurasi gas mulia neon ([Ne]), aluminium memiliki tiga pilihan teoretis: melepaskan satu elektron (menjadi Al⁺ dengan [Ne]3s²), dua elektron (Al²⁺ dengan [Ne]3s¹), atau tiga elektron (Al³⁺ dengan [Ne]). Meskipun melepaskan elektron pertama relatif mudah, pelepasan elektron kedua dan ketiga dari kulit ketiga memerlukan energi yang sangat tinggi.
Namun, setelah melepaskan ketiga elektronnya, ion Al³⁺ mencapai konfigurasi gas mulia yang sangat stabil ([Ne]). Stabilitas ekstra ini begitu besar sehingga energi yang dibutuhkan untuk membentuk Al³⁺, meski tinggi, dapat dikompensasi oleh energi kisi yang sangat besar yang dihasilkan dalam senyawa ionik seperti Al₂O₃. Oleh karena itu, Al³⁺ adalah spesies yang paling stabil dan umum ditemui, bukan Al⁺ atau Al²⁺ yang konfigurasinya kurang stabil.
Ringkasan Penutup
Dengan demikian, eksplorasi terhadap Konfigurasi Elektron, Valensi Unsur, dan Ion telah membawa kita pada pemahaman yang lebih intim tentang bahasa universal atom. Pengetahuan ini bukan akhir, melainkan pintu gerbang menuju inovasi yang lebih luas. Dari sini, kita dapat merancang material dengan sifat yang diinginkan, memahami mekanisme reaksi pada tingkat paling dasar, dan mengapresiasi keteraturan alam yang elegan. Pada akhirnya, menguasai bahasa elektron berarti memiliki kemampuan untuk tidak hanya membaca, tetapi juga menulis ulang cerita kimiawi di sekitar kita.
Jawaban untuk Pertanyaan Umum
Apakah konfigurasi elektron ion selalu sama dengan gas mulia?
Tidak selalu. Meski banyak ion stabil (seperti Na+ atau Cl-) memiliki konfigurasi elektron oktet yang menyerupai gas mulia, terdapat pengecualian. Ion-ion logam transisi (seperti Fe2+ atau Cu+) dan ion unsur blok-d atau f umumnya tidak memiliki konfigurasi gas mulia, tetapi mencapai kestabilan melalui struktur kulit elektron yang penuh atau setengah penuh pada subkulit d atau f.
Bagaimana cara cepat mengetahui elektron valensi suatu unsur hanya dari tabel periodik?
Untuk unsur golongan utama (golongan A), jumlah elektron valensi umumnya sama dengan angka satuannya. Golongan IA dan IIA memiliki 1 dan 2 elektron valensi. Golongan IIIA hingga VIIIA memiliki 3 hingga 8 elektron valensi (kecuali Helium di golongan VIIIA yang hanya 2). Golongan transisi (blok-d) lebih kompleks dan tidak mengikuti pola sederhana ini.
Mengapa unsur golongan VIII A (gas mulia) sulit membentuk ikatan?
Karena mereka telah memiliki konfigurasi elektron valensi yang sangat stabil, yaitu kulit terluar yang penuh (oktet, kecuali Helium yang duplet). Kondisi ini membuat mereka memiliki energi ionisasi yang sangat tinggi dan afinitas elektron yang sangat rendah, sehingga tidak memiliki kecenderungan kuat untuk melepas, menangkap, atau berbagi elektron dengan unsur lain.
Apa hubungan antara konfigurasi elektron dengan sifat magnetik suatu unsur atau senyawa?
Sifat magnetik sangat bergantung pada spin elektron yang tidak berpasangan dalam orbital. Unsur atau senyawa dengan elektron tidak berpasangan (seperti Besi atau Kobalt) bersifat paramagnetik (ditarik medan magnet), sementara yang semua elektronnya berpasangan bersifat diamagnetik (ditolak lemah oleh medan magnet). Konfigurasi elektron membantu memprediksi keberadaan elektron tidak berpasangan ini.