Rumus Kimia Dinitrogen Trioksida, N₂O₃, bukan sekadar susunan huruf dan angka di buku pelajaran. Senyawa oksida nitrogen yang satu ini menyimpan karakter unik sebagai zat berwarna biru tua pada suhu rendah, menawarkan jendela menarik untuk memahami kompleksitas ikatan kimia dan reaktivitas. Keberadaannya, meski tidak sepopuler ‘sepupunya’ seperti NO atau NO₂, memiliki cerita sendiri dalam narasi besar kimia anorganik dan proses industri.
Sebagai anhidrida dari asam nitrit, N₂O₃ memegang peran kunci sebagai perantara dalam berbagai sintesis senyawa nitrogen lainnya. Struktur molekulnya yang tidak biasa dan sifatnya yang sangat reaktif menjadikannya subjek kajian yang menarik, sekaligus menuntut penanganan ekstra hati-hati. Dari laboratorium penelitian hingga aplikasi potensial dalam industri, senyawa ini mengajarkan bahwa dalam dunia kimia, hal-hal yang tampak niche seringkali menyimpan pengaruh yang fundamental.
Pengenalan Dinitrogen Trioksida
Dalam katalog senyawa nitrogen oksida yang beragam, dinitrogen trioksida menempati posisi yang unik dan seringkali kurang dikenal dibandingkan dengan saudaranya seperti nitrogen dioksida (NO₂) atau dinitrogen tetroksida (N₂O₄). Senyawa ini merupakan salah satu oksida nitrogen yang menarik untuk dikaji baik dari segi struktur maupun reaktivitasnya.
Dinitrogen trioksida (N₂O₃) pada kondisi ruang berupa cairan berwarna biru tua yang tidak stabil. Warna biru ini menjadi ciri khasnya, meskipun pada suhu rendah ia cenderung berwarna lebih terang. Senyawa ini mudah terurai kembali menjadi nitrogen oksida (NO) dan nitrogen dioksida (NO₂), terutama saat suhu meningkat. Dalam konteks industri, peran langsung N₂O₃ mungkin tidak sebesar senyawa nitrogen lainnya, namun signifikansinya terletak pada studi kimia fundamental.
Keberadaannya sebagai perantara reaksi dan model untuk memahami ikatan antara atom nitrogen dalam bilangan oksidasi berbeda (+2 dan +3) menjadikannya subjek penelitian yang penting dalam kimia anorganik dan atmosfer.
Rumus Kimia dan Struktur Molekul
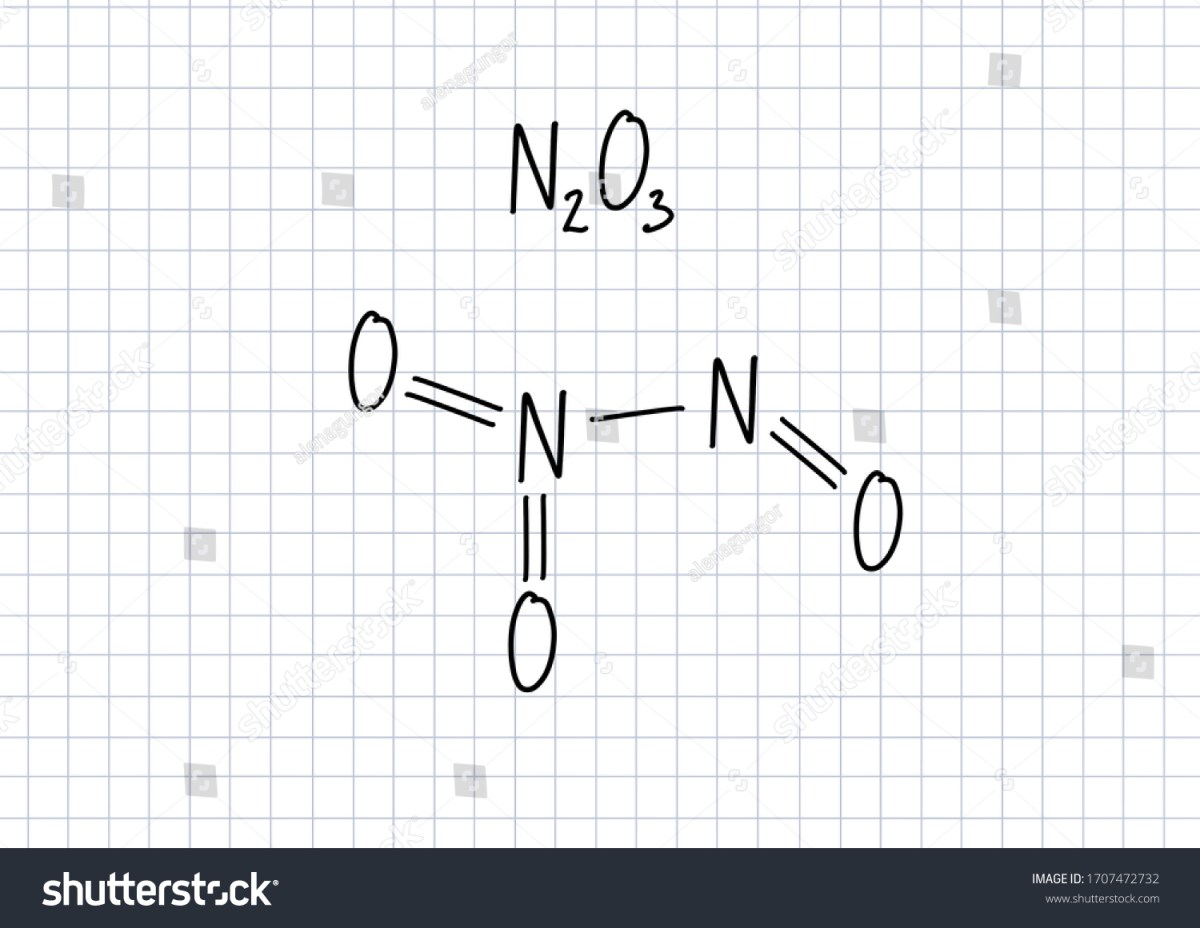
Rumus kimia dinitrogen trioksida adalah N₂O₃. Angka subskrip “2” dan “3” secara harfiah menunjukkan komposisi atom: dua atom nitrogen (N) dan tiga atom oksigen (O). Rumus ini bukan sekadar daftar atom, tetapi mencerminkan rasio stoikiometri dalam satu molekul senyawa tersebut.
Struktur Lewis N₂O₃ mengungkapkan kerumitan ikatannya. Molekul ini tidak simetris; ia dapat digambarkan sebagai struktur hibrid antara NO⁺ dan NO₂⁻, atau lebih tepatnya sebagai senyawa yang mengandung satu atom nitrogen dengan bilangan oksidasi +2 dan satu atom nitrogen dengan bilangan oksidasi +3. Struktur yang umum diterima adalah O=N–O–N=O, dengan ikatan N–O–N yang menghubungkan kedua bagian. Ikatan N–O tengah ini relatif panjang dan lemah, yang menjelaskan mengapa senyawa ini mudah terdisosiasi.
Geometri molekul di sekitar setiap atom nitrogen mendekati trigonal planar, tetapi secara keseluruhan molekulnya berbentuk seperti buku yang terbuka dengan sudut ikatan O–N–O yang tidak sama. Karena bentuknya yang tidak simetris dan distribusi muatan yang tidak merata, dinitrogen trioksida merupakan molekul polar. Kepolaran ini memengaruhi interaksinya dengan pelarut dan perilaku reaksinya.
Sintesis dan Pembuatan
Mensintesis dinitrogen trioksida murni merupakan tantangan tersendiri karena ketidakstabilan termalnya. Prosesnya umumnya dilakukan pada suhu rendah untuk meminimalkan dekomposisi. Sintesis di laboratorium lebih sering menghasilkan campuran kesetimbangan yang mengandung N₂O₃ daripada senyawa murninya.
Metode utama yang digunakan adalah pendinginan dan pencampuran nitrogen oksida (NO) dan nitrogen dioksida (NO₂) dalam kondisi yang sangat terkontrol. Pada suhu sekitar -20°C hingga -30°C, campuran gas ini akan terkondensasi membentuk cairan biru yang kaya akan N₂O₃. Distilasi fraksional pada suhu yang sangat rendah kemudian dapat digunakan untuk memisahkan dan memurnikannya.
| Metode | Bahan Baku | Kondisi Reaksi | Hasil Yield |
|---|---|---|---|
| Kondensasi Stoikiometri | Gas NO dan NO₂ murni | Pencampuran ekuimolar pada suhu -30°C hingga -50°C dalam atmosfer inert. | Rendah hingga sedang, sangat bergantung pada kontrol suhu dan kecepatan pendinginan. |
| Dekomposisi Dingin Asam Nitrit | Larutan Asam Nitrit (HNO₂) pekat | Pendinginan ekstrem (di bawah -80°C) menyebabkan pengendapan N₂O₃ dari larutan. | Rendah, karena asam nitrit sendiri tidak stabil. |
| Reaksi Logam dengan Asam Nitrat | Logam (misalnya Perak) dan Asam Nitrat encer dingin | Reaksi pada suhu mendekati 0°C menghasilkan campuran gas NO dan NO₂ yang kemudian dikondensasi. | Menyediakan prekursor, tetapi yield N₂O₃ murni tetap rendah. |
Prosedur keselamatan mutlak harus diterapkan. Seluruh proses harus dilakukan dalam lemari asam (fume hood) dengan ventilasi yang sangat baik karena toksisitas semua oksida nitrogen. Penggunaan alat pelindung diri (APD) lengkap—termasuk sarung tangan tahan suhu rendah, pelindung mata, dan jas lab—adalah keharusan. Silinder gas harus diikat dengan aman, dan kontak dengan bahan organik atau agen pereduksi kuat harus dihindari sepenuhnya untuk mencegah reaksi keras.
Sifat-Sifat Kimia dan Reaktivitas, Rumus Kimia Dinitrogen Trioksida
Reaktivitas dinitrogen trioksida didominasi oleh kemampuannya sebagai agen nitrosasi, yaitu mentransfer gugus nitrosonium (NO⁺). Reaksi paling khasnya adalah dengan air, di mana ia terhidrolisis membentuk asam nitrit, meskipun asam ini pun tidak stabil.
N₂O₃ (g) + H₂O (l) → 2 HNO₂ (aq)
Reaksi ini menjelaskan mengapa N₂O₃ bersifat asam. Dengan logam alkali, ia dapat bereaksi membentuk nitrit. Berdasarkan bilangan oksidasi nitrogen rata-ratanya yang +3, dinitrogen trioksida dapat bertindak baik sebagai pengoksidasi (terhadap reduktor kuat) maupun sebagai pereduksi (terhadap oksidator kuat), meskipun sifat nitrosasinya lebih menonjol.
Senyawa-senyawa yang bereaksi signifikan dengan dinitrogen trioksida antara lain:
- Air dan larutan basa, menghasilkan ion nitrit.
- Amina aromatik sekunder dan tersier, mengalami reaksi nitrosasi membentuk senyawa nitrosoamin.
- Logam alkali dan alkali tanah, membentuk garam nitrit.
- Hidrokarbon aromatik teraktivasi, dalam reaksi nitrosasi elektrofilik.
- Halida logam tertentu, dapat membentuk nitrosil halida.
Aplikasi dan Kegunaan
Source: shutterstock.com
Dalam skala industri besar, aplikasi langsung dinitrogen trioksida terbatas. Namun, perannya dalam sintesis kimia organik dan anorganik sangat berharga. Senyawa ini merupakan sumber nitrosonium (NO⁺) yang efektif, yang digunakan untuk mensintesis berbagai turunan nitroso, seperti diazonium salt tertentu dan nitrosoamin—senyawa yang berguna sebagai prekursor dalam industri pewarna dan farmasi.
Rumus kimia dinitrogen trioksida, N₂O₃, mengkristalkan hubungan atom nitrogen dan oksigen dalam proporsi yang pasti. Prinsip presisi ini juga vital dalam bidang lain, misalnya saat Menghitung Jarak antara Kota B dan Kota C Berdasarkan Koordinat yang memerlukan ketepatan formula matematika. Demikian halnya, memahami struktur N₂O₃ menuntut ketelitian setara untuk mengungkap sifat dan reaktivitas senyawa ini di laboratorium.
Sebagai perantara, N₂O₃ muncul dalam proses oksidasi nitrogen menjadi asam nitrat dalam proses Ostwald, meskipun bukan spesies yang dominan. Ia juga dipelajari dalam konteks kimia atmosfer, sebagai spesies reaktif yang mungkin terbentuk dalam kesetimbangan antara NO dan NO₂. Seorang ahli kimia anorganik terkemuka pernah menegaskan pentingnya senyawa ini dalam sebuah literatur klasik:
“Studi tentang dinitrogen trioksida memberikan jendela yang jelas ke dalam sifat ikatan N–N dan N–O yang tidak biasa, serta kesetimbangan dinamis yang terjadi antara berbagai oksida nitrogen. Pemahaman ini fundamental untuk menguraikan mekanisme reaksi yang melibatkan nitrogen dalam berbagai bilangan oksidasinya.”
Penanganan dan Penyimpanan
Penanganan dinitrogen trioksida memerlukan kewaspadaan tingkat tinggi. Prosedur aman mengharuskan pekerjaan dilakukan secara eksklusif dalam sistem tertutup atau lemari asam dengan aliran udara yang kuat. Transfer material harus menggunakan jalur yang disegel dan didinginkan. Paparan uapnya harus dihindari sama sekali karena bersifat toksik dan dapat menyebabkan iritasi parah pada saluran pernapasan serta edema paru.
Untuk penyimpanan, stabilitas hanya dapat dijaga pada suhu sangat rendah, biasanya di bawah -30°C, dalam wadah gelas yang tertutup rapat dan dilindungi dari cahaya. Penyimpanan dalam atmosfer gas inert seperti argon atau nitrogen sangat dianjurkan untuk mencegah kontaminasi dan reaksi yang tidak diinginkan. Wadah harus diberi label yang jelas menandakan bahaya toksisitas dan reaktivitas.
Dalam keadaan darurat seperti tumpahan, area harus segera dievakuasi dan hanya personel ber-APD lengkap dengan alat bantu pernapasan yang boleh melakukan pembersihan. Tumpahan kecil dapat dibiarkan menguap di dalam lemari asam dengan ventilasi maksimal. Tumpahan yang lebih besar mungkin memerlukan netralisasi dengan larutan basa encer (misalnya, soda abu) di bawah pengawasan ahli, dengan tetap memperhatikan potensi pelepasan gas nitrogen oksida yang berbahaya.
Data Fisik dan Termodinamika: Rumus Kimia Dinitrogen Trioksida
Data fisik dan termodinamika dinitrogen trioksida mengkonfirmasi sifatnya yang tidak stabil dan reaktif. Pengukuran yang akurat seringkali sulit dilakukan karena kecenderungan senyawa ini untuk terdisosiasi.
| Properti Fisik | Nilai | Kondisi / Keterangan |
|---|---|---|
| Titik Leleh | -100.1 °C | |
| Titik Didih | 3.5 °C (terdekomposisi) | Mendidih dengan disosiasi menjadi NO dan NO₂. |
| Densitas | ~1.447 g/cm³ | Pada suhu mendekati titik leleh. |
| Wujud dan Warna | Cairan, biru tua | Pada suhu di bawah 3.5°C. |
| Kelarutan dalam Air | Bereaksi | Terhidrolisis membentuk asam nitrit. |
Data termodinamika kunci mencakup entalpi pembentukan standar (ΔH°f) sebesar +82.1 kJ/mol, yang bernilai positif tinggi, mengindikasikan ketidakstabilan intrinsik senyawa terhadap unsur-unsur penyusunnya. Entropi standar (S°) adalah sekitar 312 J/(mol·K). Nilai-nilai ini jika dibandingkan dengan oksida nitrogen lain menunjukkan beberapa pola menarik:
- Dibandingkan NO (ΔH°f = +90.4 kJ/mol), N₂O₃ sedikit lebih stabil, tetapi jauh kurang stabil daripada N₂O (-82.1 kJ/mol) atau bahkan NO₂ (+33.2 kJ/mol).
- Nilai entalpi pembentukan yang positif untuk kebanyakan oksida nitrogen (kecuali N₂O) mencerminkan energi yang tersimpan dalam ikatannya, menjadikannya berpotensi sebagai pengoksidasi atau pereaksi energik.
- Kecenderungan terdisosiasi N₂O₃ tercermin dari keseimbangan yang sangat bergantung suhu antara N₂O₃, NO, dan NO₂.
Ilustrasi dan Representasi Visual
Visualisasi molekul dinitrogen trioksida dalam model bola dan tongkat akan menampilkan dua atom nitrogen (biasanya biru) yang dihubungkan oleh satu atom oksigen (merah) tunggal. Setiap atom nitrogen kemudian terikat ganda pada satu atom oksigen tambahan, sehingga struktur keseluruhannya adalah O=N–O–N=O. Sudut ikatan O–N–O di setiap pusat nitrogen akan sedikit kurang dari 120 derajat, dan molekulnya terlihat bengkok atau terlipat di sekitar ikatan N–O–N yang menjadi porosnya.
Model ruang terisi (space-filling) akan menunjukkan bentuk yang tidak beraturan, menegaskan sifat polarnya.
Dalam skema siklus nitrogen oksida, dinitrogen trioksida sering digambarkan sebagai cabang samping atau “simpul” dalam jaringan kesetimbangan antara NO dan NO₂. Diagram alur sederhana akan menempatkannya di antara dua senyawa tersebut, dengan panah dua arah yang diberi label “pendinginan” dan “pemanasan” atau “disosiasi”. Dari N₂O₃, panah lain dapat mengarah ke “HNO₂” (asam nitrit) melalui reaksi hidrolisis, menempatkannya sebagai perantara antara fase gas oksida dan fase larutan asam.
Spektrum Infra Merah (IR) N₂O₃ cukup kompleks karena adanya beberapa jenis ikatan N–O. Ia akan menunjukkan puncak tajam yang khas untuk regangan N=O sekitar 1600-1700 cm⁻¹ dan regangan N–O (ikatan tunggal) pada daerah 1000-1300 cm⁻¹. Spektrum NMR nitrogen-15 (¹⁵N NMR) akan sangat menarik karena menampilkan dua sinyal kimia yang berbeda dan jelas terpisah, secara langsung membuktikan keberadaan dua atom nitrogen dalam lingkungan kimia yang tidak setara—satu dengan bilangan oksidasi +2 dan satu dengan +3.
Rumus kimia dinitrogen trioksida, N₂O₃, mengungkap struktur molekul yang unik. Seperti halnya transformasi geometri pada konsep Bayangan Rotasi 180° terhadap Titik E (8, -3) dalam matematika, yang menghasilkan pencerminan sempurna, senyawa ini pun memiliki simetri tertentu dalam ikatan nitrogen dan oksigennya. Pemahaman mendalam terhadap kedua prinsip ini, baik rumus kimia maupun transformasi koordinat, sangat krusial untuk menguasai ilmu eksakta.
Ini adalah bukti spektroskopi langsung untuk struktur asimetrisnya.
Terakhir
Dari uraian mendalam tentang Dinitrogen Trioksida, terlihat jelas bahwa senyawa dengan rumus N₂O₃ ini jauh lebih dari sekadar zat berwarna biru yang eksotis. Ia merupakan puzzle penting dalam memahami perilaku oksida nitrogen, sebuah keluarga senyawa dengan dampak luas mulai dari atmosfer hingga sintesis kimia. Karakternya yang reaktif dan tidak stabil justru menjadi kunci mengapa ia penting dipelajari, mengajarkan prinsip kesetimbangan, keamanan laboratorium, dan strategi sintesis.
Pengetahuan mendalam tentang senyawa seperti N₂O₃, mulai dari rumus dan struktur hingga cara penanganannya, merupakan fondasi kokoh dalam kemajuan ilmu material dan kimia industri. Ia mengingatkan bahwa kemajuan sains seringkali berawal dari pemahaman mendalam terhadap zat-zat yang mungkin tidak selalu menjadi sorotan utama, namun memiliki cerita dan kegunaan yang tak ternilai dalam merakit pengetahuan yang lebih besar.
Dinitrogen trioksida, dengan rumus kimia N₂O₃, merupakan senyawa nitrogen yang menarik untuk dikaji. Meski fokus kita pada kimia, penting untuk diingat bahwa aktivitas fisik seperti berenang memerlukan persiapan tubuh yang matang, termasuk Otot yang Perlu Diregangkan Sebelum Berenang guna mencegah cedera. Dengan tubuh yang lebih lentur dan siap, kita pun bisa kembali fokus menganalisis struktur molekul dan sifat reaktif N₂O₃ dengan pikiran yang lebih jernih.
Panduan Pertanyaan dan Jawaban
Apakah Dinitrogen Trioksida (N₂O₃) ditemukan bebas di alam?
Tidak, N₂O₃ tidak ditemukan bebas di alam dalam jumlah signifikan karena sangat tidak stabil pada kondisi atmosfer dan mudah terurai menjadi nitrogen oksida (NO) dan nitrogen dioksida (NO₂). Keberadaannya biasanya hanya sebagai spesies kesetimbangan pada campuran oksida nitrogen atau disintesis secara khusus di laboratorium.
Mengapa warna biru pada N₂O₃ penting secara ilmiah?
Warna biru tua atau indigo yang muncul pada N₂O₃ dalam keadaan cair atau pada suhu rendah merupakan petunjuk visual mengenai struktur dan sifat elektroniknya. Warna ini berkaitan dengan penyerapan cahaya pada panjang gelombang tertentu akibat transisi elektron dalam molekul, yang dapat dikaitkan dengan ikatan N-N yang tidak biasa dalam strukturnya.
Bagaimana N₂O₃ berperan dalam polusi udara?
Meski bukan polutan primer yang langsung dilepaskan, N₂O₃ dapat terbentuk sebagai spesies reaktif perantara dalam serangkaian reaksi fotokimia di atmosfer antara NO dan NO₂. Keberadaannya yang cepat berubah ini mempengaruhi kesetimbangan dan dinamika oksida nitrogen di udara, yang pada akhirnya berkontribusi pada pembentukan kabut fotokimia dan hujan asam.
Apakah N₂O₃ sama dengan “gas tertawa” (nitrous oxide)?
Sama sekali berbeda. N₂O₃ adalah dinitrogen trioksida, senyawa berwarna biru yang sangat reaktif dan tidak stabil. Sementara “gas tertawa” adalah dinitrogen monoksida dengan rumus N₂O, sebuah gas tidak berwarna, stabil, dan memiliki efek anestetik. Perbedaan satu atom oksigen menghasilkan sifat yang bertolak belakang.
Bisakah N₂O₃ digunakan langsung sebagai bahan baku industri skala besar?
Sangat tidak umum dan cenderung tidak praktis karena ketidakstabilan dan bahayanya. Perannya lebih sebagai perantara reaksi atau reagen spesifik dalam sintesis kimia skala laboratorium atau pilot plant. Industri biasanya menggunakan prekursor yang lebih stabil untuk menghasilkan senyawa target, menghindari penanganan N₂O₃ secara langsung dalam jumlah besar.