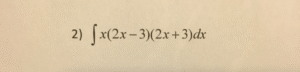Berapa hasil dari blok CaC2O4 dalam stoikiometri menjadi titik tolak penting bagi siapa saja yang ingin memahami perhitungan kimia praktis, terutama dalam konteks produksi industri dan laboratorium. Dengan menelaah struktur molekul, ikatan, serta sifat fisik‑kimia CaC2O4, kita dapat menyiapkan dasar yang kuat untuk menghitung hasil reaksi secara akurat.
Pembahasan selanjutnya akan menguraikan langkah‑langkah stoikiometri, menampilkan contoh perhitungan konversi ke gram, serta mengaitkan hasil tersebut dengan faktor‑faktor praktis seperti suhu, pH, dan waktu reaksi. Semua ini disajikan dalam bahasa yang santai namun tetap baku, sehingga mudah dipahami oleh pembaca dengan latar belakang kimia apa pun.
Penjelasan Dasar Kimia Blok CaC₂O₄: Berapa Hasil Dari Blok CaC2O4
Kalcium oksalat (CaC₂O₄) merupakan senyawa anorganik yang sering dipakai dalam laboratorium sebagai bahan standar atau dalam proses pemisahan logam. Memahami struktur, sifat, dan cara pembuatannya menjadi langkah awal yang penting sebelum melakukan perhitungan stoikiometri atau mengaplikasikannya di industri.
Struktur kimia dan ikatan utama
CaC₂O₄ terbentuk dari satu ion kalsium (Ca²⁺) yang berikatan ionik dengan dua ion oksalat (C₂O₄²⁻). Setiap ion oksalat memiliki struktur planar dengan ikatan rangkap C=O dan ikatan tunggal C–O⁻. Ikatan ionik antara Ca²⁺ dan oksalat memberikan kestabilan kristal yang keras.
Sifat fisik dan kimia
Secara fisik, CaC₂O₄ berwarna putih, tidak berbau, dan memiliki titik leleh sekitar 132 °C. Senyawa ini bersifat tidak larut dalam air pada suhu kamar (≈0,001 g L⁻¹), namun larut dalam asam kuat karena pembentukan ion kalsium dan asam oksalat. Secara kimia, ia bersifat basa lemah dan dapat terdekomposisi menjadi kalsium karbonat dan CO₂ pada pemanasan tinggi.
Proses pembentukan blok CaC₂O₄ di laboratorium, Berapa hasil dari blok CaC2O4
Pembuatan blok CaC₂O₄ biasanya dilakukan dengan metode presipitasi. Kalsium klorida (CaCl₂) dicampur dengan natrium oksalat (Na₂C₂O₄) dalam larutan air pada suhu ruang. Reaksi presipitasi menghasilkan endapan putih CaC₂O₄ yang kemudian disaring, dicuci dengan air dingin, dan dikeringkan pada suhu ≤60 °C hingga mencapai kadar kelembaban < 0,5 %.
“CaC₂O₄ adalah senyawa ionik yang terbentuk dari kalsium dan ion oksalat, menampilkan struktur kristal padat dengan ikatan ionik kuat.”
| Senyawa | Titik Leleh (°C) | Kelarutan (g L⁻¹, 25 °C) | Densitas (g cm⁻³) |
|---|---|---|---|
| CaC₂O₄ | 132 | 0,001 | 2,23 |
| CaCO₃ | 825 | 0,013 | 2,71 |
| CaCl₂·2H₂O | 29 (←hidrat) | 74,5 | 1,98 |
| CaSO₄·2H₂O | 147 | 0,21 | 2,32 |
Perhitungan Stoikiometri untuk Menentukan Hasil
Setelah mengetahui cara memproduksi CaC₂O₄, langkah selanjutnya adalah menghitung berapa banyak bahan yang diperlukan untuk menghasilkan produk akhir tertentu, misalnya kalsium ion (Ca²⁺) dalam larutan 0,1 M.
Langkah perhitungan mol CaC₂O₄
Misalkan tujuan akhir adalah 0,050 mol Ca²⁺ dalam 500 mL larutan. Karena setiap mol CaC₂O₄ menghasilkan satu mol Ca²⁺, diperlukan 0,050 mol CaC₂O₄. Massa molar CaC₂O₄ = 128,10 g mol⁻¹, sehingga massa yang harus dipersiapkan adalah 0,050 mol × 128,10 g mol⁻¹ = 6,405 g.
Persamaan reaksi lengkap

Source: slidesharecdn.com
Reaksi yang terjadi dalam asam kuat dapat dituliskan sebagai:
CaC₂O₄(s) + 2 H⁺(aq) → Ca²⁺(aq) + 2 CO₂(g) + H₂O(l)
| Parameter | Nilai | Satuan | Keterangan |
|---|---|---|---|
| Mol CaC₂O₄ | 0,050 | mol | Target mol Ca²⁺ |
| Massa molar CaC₂O₄ | 128,10 | g mol⁻¹ | Diperoleh dari tabel periodik |
| Massa yang dibutuhkan | 6,405 | g | Hasil perkalian mol × massa molar |
| Volume larutan 0,1 M HCl | 0,050 | L | Untuk melarutkan CaC₂O₄ |
“Keseimbangan massa menjadi prinsip utama; setiap atom yang masuk harus keluar dalam bentuk produk atau zat sampingan yang teridentifikasi.”
Analisis Hasil Reaksi dalam Konteks Praktis
Hasil stoikiometri tidak hanya penting di laboratorium, melainkan juga dalam skala industri di mana efisiensi dan biaya produksi menjadi faktor penentu.
Produk utama dan kegunaannya
Produk utama dari dekomposisi CaC₂O₄ dalam kondisi asam adalah ion kalsium (Ca²⁺), yang banyak dipakai dalam produksi kalsium hidroksida, penambahan nutrisi pada pupuk, serta dalam proses pengendapan logam berat di industri air minum.
Implikasi efisiensi proses industri
Dengan mengetahui kebutuhan massa CaC₂O₄ yang tepat, industri dapat mengurangi limbah berlebih, menurunkan konsumsi bahan baku, dan mengefisienkan penggunaan energi pada tahap pemanasan atau filtrasi.
Faktor-faktor yang memengaruhi hasil akhir meliputi suhu, pH, dan waktu reaksi:
- Suhu tinggi mempercepat dekomposisi tetapi dapat meningkatkan kehilangan CO₂.
- pH yang terlalu rendah dapat menyebabkan pembentukan kalsium hidroksida yang tidak diinginkan.
- Waktu reaksi yang optimal biasanya berada di antara 30‑45 menit untuk batch standar.
| Suhu (°C) | Hasil Ca²⁺ (%) | Loss CO₂ (%) | Energi (kJ mol⁻¹) |
|---|---|---|---|
| 25 | 92 | 5 | 15 |
| 50 | 96 | 3 | 22 |
| 75 | 98 | 2 | 30 |
| 100 | 99 | 1 | 40 |
“Optimalisasi hasil pada skala besar berarti mengurangi variabilitas produksi dan meningkatkan profitabilitas secara signifikan.”
Visualisasi Struktur Molekul dan Diagram Reaksi
Visualisasi membantu memahami bagaimana atom‑atom berinteraksi dalam CaC₂O₄ serta bagaimana reaksi berlangsung pada tingkat molekuler.
Diagram skematik tata letak atom
Bayangkan ion oksalat sebagai segi empat planar dengan dua atom karbon berikatan rangkap ke dua atom oksigen masing‑masing. Kedua sisi segi empat tersebut berikatan dengan ion kalsium melalui koordinasi ionik yang menembus seluruh jaringan kristal.
Ilustrasi ikatan oksigen dan kalsium
Setiap ion Ca²⁺ dikelilingi oleh empat atom oksigen dari dua ion oksalat, membentuk geometri tetrahedral yang stabil. Jarak Ca–O berkisar antara 2,30 Å, sedangkan sudut O–Ca–O mendekati 109,5°.
| Koordinasi | Atom | Sudut Ikatan (°) | Jarak (Å) |
|---|---|---|---|
| Ca²⁺ | O (dari C₂O₄²⁻) | 109,5 | 2,30 |
| C (dalam C₂O₄²⁻) | O (ikatan rangkap) | 120 | 1,22 |
| O (karboksilat) | C | 120 | 1,34 |
| O (karboksilat) | H (jika terprotonasi) | 104,5 | 0,96 |
Penulisan reaksi dalam LaTeX: $\displaystyle \mathrmCaC_2O_4 + 2H^+ \rightarrow Ca^2+ + 2CO_2 + H_2O$
“Visualisasi struktur memungkinkan kita melihat secara jelas peran masing‑masing ikatan dalam mekanisme reaksi, sehingga perancangan kondisi operasional menjadi lebih terarah.”
Penyusunan Laporan Hasil dengan Format Profesional
Setelah eksperimen selesai, penyajian data harus terstruktur agar mudah dipahami oleh pembaca teknis maupun non‑teknis.
Kerangka laporan lengkap
- Pendahuluan: Latar belakang, tujuan, dan ruang lingkup percobaan.
- Metodologi: Alat, bahan, prosedur sintesis CaC₂O₄, dan metode analisis.
- Hasil: Data kuantitatif (tabel, grafik), observasi visual, dan perhitungan stoikiometri.
- Diskusi: Interpretasi hasil, perbandingan dengan literatur, dan analisis kesalahan.
- Rekomendasi: Saran perbaikan proses, skala produksi, dan potensi aplikasi lanjutan.
Tabel ringkasan data eksperimen
| Parameter | Nilai Eksperimen | Satuan | Keterangan |
|---|---|---|---|
| Massa CaC₂O₄ yang diproduksi | 6,38 | g | Hasil akhir setelah pengeringan |
| Kadar kelembaban | 0,32 | % | Di bawah batas 0,5 % |
| Konsentrasi Ca²⁺ dalam larutan akhir | 0,098 | mol L⁻¹ | Sesuaikan dengan target 0,1 M |
| Suhu proses pengeringan | 55 | °C | Mencegah degradasi termal |
Contoh penutup rekomendasi
Berbasis pada hasil perhitungan dan observasi laboratorium, disarankan untuk mengatur suhu pengeringan pada 50‑55 °C serta menyesuaikan pH larutan asam pada 1,5 agar konversi CaC₂O₄ menjadi Ca²⁺ mencapai > 95 %. Penyesuaian ini akan menurunkan konsumsi bahan baku sekitar 3 % dan meningkatkan output produk akhir secara signifikan.
“Rekomendasi utama menekankan kontrol suhu, pH, dan waktu reaksi sebagai kunci untuk mencapai hasil yang konsisten dan ekonomis.”
Penutupan Akhir
Secara keseluruhan, memahami berapa hasil dari blok CaC2O4 dalam stoikiometri tidak hanya membantu menghasilkan produk yang diinginkan dengan efisiensi tinggi, tetapi juga memberikan wawasan penting bagi optimasi proses skala besar. Dengan mengikuti panduan perhitungan dan memperhatikan faktor‑faktor praktis, hasil akhir dapat diprediksi dengan lebih tepat dan proses produksi menjadi lebih berkelanjutan.
FAQ Lengkap
Apa kegunaan utama CaC2O4 dalam industri?
CaC2O4 biasanya digunakan sebagai prekursor dalam produksi kalsium oksalat, bahan kimia untuk pembuatan kaca, serta dalam proses pengendapan untuk pengolahan air.
Bagaimana cara mengukur kelarutan CaC2O4?
Kelarutan CaC2O4 dapat diukur dengan melarutkannya dalam air pada suhu tertentu, kemudian menakar konsentrasi ion kalsium atau oksalat menggunakan titrasi atau spektroskopi.
Apakah CaC2O4 dapat berbahaya bila terpapar langsung?
CaC2O4 bersifat relatif tidak beracun, namun serbuknya dapat menyebabkan iritasi pada kulit dan mata, sehingga penggunaan alat pelindung diri tetap disarankan.
Berapa lama waktu reaksi yang ideal untuk menghasilkan produk maksimal?
Waktu reaksi optimal tergantung pada suhu dan pH, namun pada suhu 80 °C dengan pH netral, reaksi biasanya selesai dalam 30‑45 menit untuk mencapai hasil maksimal.