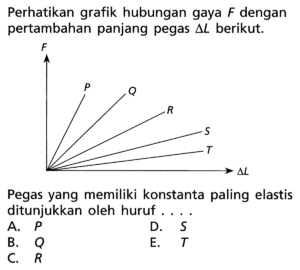
Energi transisi elektron L ke K dari tingkat dasar -13,6 eV – Energi transisi elektron L ke K dari tingkat dasar -13,6 eV itu bukan cuma deretan angka dan huruf di buku teks fisika kuantum, lho. Ini adalah cerita dramatis sebuah elektron di dalam atom hidrogen yang, setelah sempat melompat ke tingkat energi lebih tinggi, akhirnya “jatuh” kembali ke rumahnya sambil melepaskan terang. Proses kecil nan cepat ini adalah bahasa universal alam semesta, sebuah tanda tangan cahaya yang menjadi kunci kita memahami bintang-bintang yang jauh di langit malam.
Transisi spesifik dari kulit L (n=2) ke kulit K (n=1) pada atom hidrogen melepaskan energi tepat sebesar 10,2 elektronvolt, yang termanifestasi sebagai foton ultraviolet dengan panjang gelombang sekitar 121,6 nanometer. Garis spektrum ini merupakan anggota paling terang dalam Seri Lyman, dan menjadi fondasi bagi ilmu spektroskopi untuk mengidentifikasi keberadaan hidrogen di berbagai penjuru kosmos. Perhitungannya sendiri bersandar pada model atom Bohr dan konstanta Rydberg, yang secara elegan menghubungkan tingkat dasar -13,6 eV dengan energi setiap lompatan elektron.
Dasar Teori Transisi Elektron dan Tingkat Energi
Kalau kita bicara tentang atom, khususnya atom hidrogen yang sederhana, ada sebuah “peta” energi yang sangat rapi di dalamnya. Elektron tidak berkeliaran sembarangan di sekitar inti, melainkan menempati orbit-orbit tertentu yang disebut tingkat energi. Bayangkan ini seperti anak tangga: elektron hanya boleh berdiri di anak tangga tertentu, tidak boleh di antara anak tangga. Tingkat energi paling bawah, yang paling dekat dengan inti dan paling stabil, kita sebut kulit K.
Di atasnya ada kulit L, lalu M, dan seterusnya.
Dalam notasi spektroskopi, kulit-kulit ini direpresentasikan dengan bilangan kuantum utama (n). Kulit K adalah n=1, L adalah n=2, dan M adalah n=3. Nilai energi ikat untuk setiap tingkat ini pada atom hidrogen diberikan oleh rumus elegan dari model Bohr, yang diturunkan dari konstanta Rydberg. Untuk tingkat dasar (n=1), energi ikatnya adalah -13.6 eV. Tanda negatif ini penting, artinya elektron terikat; dibutuhkan energi sebesar 13.6 eV untuk melepaskannya dari atom.
En = -13.6 eV / n 2
Proses eksitasi dan emisi adalah dua sisi dari koin yang sama. Eksitasi terjadi ketika elektron menyerap energi persis sebesar selisih dua tingkat, lalu “meloncat” ke tingkat yang lebih tinggi (misal dari K ke L). Ini seperti mendorong bola ke anak tangga yang lebih tinggi. Sebaliknya, emisi terjadi ketika elektron yang sudah tereksitasi itu tidak betah lama-lama di posisi tinggi. Ia akan “jatuh” kembali ke tingkat yang lebih rendah, dan kelebihan energi itu dilepaskan dalam bentuk paket cahaya yang kita sebut foton.
Transisi dari L kembali ke K adalah contoh emisi yang sangat energik.
Perbandingan Karakteristik Kulit Atom Hidrogen
Untuk memahami perbedaan mendasar antara kulit-kulit elektron, tabel berikut merangkum karakteristik utama kulit K, L, dan M pada atom hidrogen berdasarkan model Bohr.
| Kulit Atom | Notasi (n) | Energi Relatif (eV) | Stabilitas |
|---|---|---|---|
| K | 1 | -13.6 | Sangat Stabil (Tingkat Dasar) |
| L | 2 | -3.4 | Kurang Stabil (Tereksitasi) |
| M | 3 | -1.51 | Lebih Tidak Stabil |
Analisis Proses Transisi Spesifik L → K
Mari kita zoom in pada satu peristiwa spesifik: saat elektron di kulit L (n=2) memutuskan untuk pulang ke rumahnya di kulit K (n=1). Dalam konteks atom hidrogen, ini adalah transisi yang paling dramatis karena perbedaan energinya paling besar. Elektron yang tadinya memiliki energi -3.4 eV di level L, akan stabil pada energi -13.6 eV di level K. Kelebihan energi sebesar 10.2 eV ini tidak boleh hilang begitu saja; ia harus dilepaskan.
Energi sebesar 10.2 eV itu kemudian dikonversi menjadi sebuah foton. Dengan menggunakan hubungan Planck (E = hc/λ), kita bisa menghitung panjang gelombang foton yang dipancarkan. Hasil perhitungannya akan menghasilkan panjang gelombang sekitar 121.6 nanometer. Ini adalah wilayah spektrum ultraviolet jauh. Transisi dari tingkat tinggi apapun menuju n=1 dalam atom hidrogen dikelompokkan ke dalam Seri Lyman, dan transisi dari n=2 ke n=1 adalah garis pertama (dan terkuat) dalam seri ini, disebut Lyman-alfa.
Mekanisme Relaksasi Elektron dan Emisi Foton
Proses fisik dari relaksasi elektron hingga terpancarnya cahaya dapat diuraikan dalam urutan logis berikut:
- Elektron berada dalam keadaan tereksitasi tidak stabil di kulit L (n=2).
- Secara spontan, elektron mengalami transisi ke tingkat energi yang lebih rendah dan lebih stabil, yaitu kulit K (n=1).
- Selisih energi antara kedua tingkat (ΔE = E K
-E L = -13.6 eV – (-3.4 eV) = -10.2 eV) dibawa pergi oleh sebuah foton yang tercipta pada saat yang bersamaan. - Foton tersebut dipancarkan keluar dari atom dengan energi yang persis sebesar 10.2 eV, yang setara dengan panjang gelombang spesifik 121.6 nm di daerah ultraviolet.
Implikasi dan Aplikasi Fenomena Transisi
Garis spektrum 121.6 nm dari transisi Lyman-alfa bukan sekadar angka di buku teks. Ia adalah penanda kosmik yang sangat powerful. Di astronomi, garis ini digunakan sebagai “sidik jari” untuk mendeteksi keberadaan atom hidrogen netral, yang merupakan materi paling melimpah di alam semesta. Dengan mengamati intensitas dan pergeseran garis Lyman-alfa dari cahaya bintang atau nebula, kita bisa mengetahui komposisi, suhu, kerapatan, bahkan kecepatan gerak objek tersebut.
Prinsip inilah yang mendasari spektroskopi emisi atom. Setiap elemen memiliki “peta” tingkat energi yang unik, sehingga menghasilkan pola garis spektrum yang unik pula, seperti barcode. Teknologi modern seperti laser juga berutang budi pada konsep ini. Laser bekerja berdasarkan emisi terstimulasi, dimana sebuah foton yang datang merangsang elektron yang sudah tereksitasi untuk melakukan transisi dan memancarkan foton kembar yang identik, menghasilkan cahaya yang koheren dan monokromatik.
“Analisis garis spektrum dari cahaya bintang adalah fondasi astrofisika modern. Melalui garis-garis itu, atom-atom di tempat yang tak terjangkau berbicara kepada kita, mengungkapkan komposisi dan dinamika alam semesta.” – Prinsip Dasar Astrofisika.
Dalam fisika atom, transisi elektron dari kulit L ke K dengan tingkat dasar -13,6 eV melibatkan perhitungan energi yang presisi. Nah, soal hitung-hitungan akar dan pangkat seperti Menentukan Nilai (√27)^(1/3) dari Pilihan Jawaban ini melatih ketelitian matematis yang sama pentingnya. Kembali ke atom, ketelitian numerik itu krusial untuk menghitung selisih energi foton yang dipancarkan dalam transisi tersebut secara akurat.
Visualisasi dan Deskripsi Konseptual: Energi Transisi Elektron L Ke K Dari Tingkat Dasar -13,6 eV
Bayangkan sebuah diagram dengan garis-garis horizontal yang mewakili tingkat energi. Di bagian paling bawah, sebuah garis tebal diberi label “Kulit K, n=1, -13.6 eV”. Agak ke atas, ada garis lain bertuliskan “Kulit L, n=2, -3.4 eV”. Sebuah panah melengkung yang mengarah ke bawah menghubungkan garis L ke garis K, dengan label di sampingnya: “ΔE = 10.2 eV, λ = 121.6 nm (UV)”.
Di ujung panah, digambarkan sebuah gelombang sinus kecil yang melambangkan foton yang dipancarkan.
Deskripsi konseptualnya begini: Elektron yang “jatuh” dari L ke K ini ibarat sebuah batu yang dijatuhkan dari ketinggian tertentu. Saat batu itu sampai di tanah, energi potensialnya berubah menjadi energi bunyi dan panas. Pada elektron, “tanah”-nya adalah kulit K, dan energi yang dilepaskan bukan bunyi, melainkan paket cahaya murni—sebuah foton dengan warna (atau lebih tepatnya, panjang gelombang) yang sangat spesifik.
Data Transisi pada Seri Lyman, Energi transisi elektron L ke K dari tingkat dasar -13,6 eV
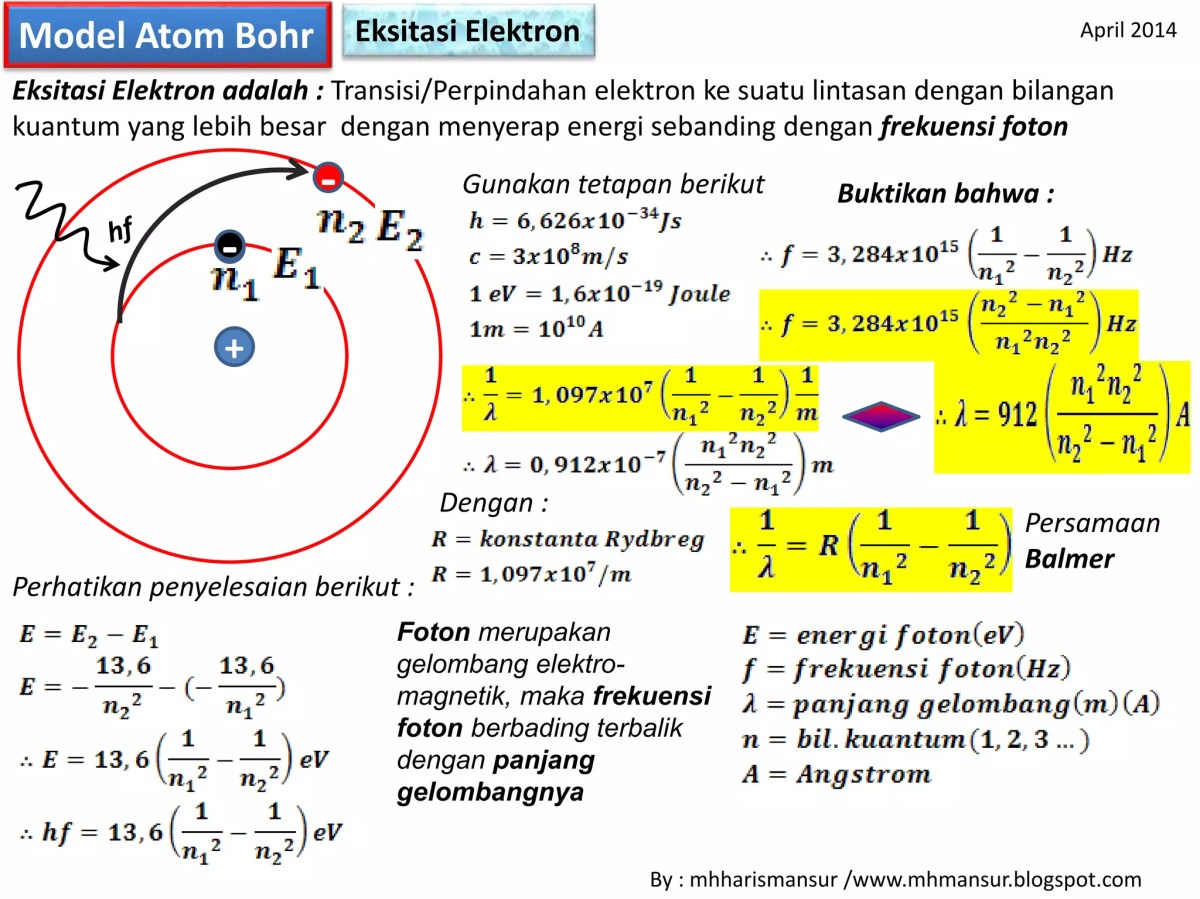
Source: slidesharecdn.com
Transisi elektron dari kulit L ke K, dengan energi dasar -13,6 eV, itu ibarat partikel yang melakukan lompatan energi spektakuler. Nah, untuk memahami seberapa jauh atau “jangkauan” perubahan energi seperti ini, kita perlu mengerti Pengertian Range dalam konteks fisika. Pemahaman tentang range ini kemudian memperkaya analisis kita terhadap besarnya energi yang dibutuhkan atau dilepaskan dalam transisi elektron yang fundamental tersebut.
Seri Lyman mencakup semua transisi elektron yang berakhir di tingkat dasar (n=1). Berikut adalah data untuk beberapa transisi pertama dalam seri tersebut, menunjukkan bagaimana energi dan panjang gelombang berubah seiring dengan tingkat awal yang lebih tinggi.
| n Awal | n Akhir | Energi Foton (eV) | Panjang Gelombang (nm) |
|---|---|---|---|
| 2 | 1 | 10.2 | 121.6 |
| 3 | 1 | 12.1 | 102.6 |
| 4 | 1 | 12.75 | 97.3 |
| ∞ | 1 | 13.6 | 91.2 |
Sebuah analogi sehari-hari: Proses transisi elektron ini mirip dengan kamu yang naik ke lantai dua rumahmu (butuh energi), lalu duduk sebentar sebelum memutuskan untuk meluncur kembali ke lantai satu melalui seluncuran. Saat kaki kamu menyentuh lantai satu, energi dari ketinggian tadi sudah terlepaskan—mungkin menjadi teriakan senang dan gesekan panas di tangan. Pada atom, “seluncuran” itu adalah transisi, dan “teriakan senang” yang dilepaskan itu adalah foton dengan warna tertentu yang bisa kita deteksi dan ukur.
Penutupan
Jadi, begitulah kisahnya. Dari sebuah persamaan sederhana yang lahir dari pikiran Niels Bohr, kita bisa menelusuri jejak cahaya yang dipancarkan elektron hidrogen dari jarak ribuan tahun cahaya. Fenomena transisi L ke K ini mengajarkan bahwa hukum fisika yang berlaku di laboratorium kita sama persis dengan yang mengatur cahaya bintang. Ia bukan sekadar materi ujian, melainkan sebuah alat pengintai yang ampuh untuk memetakan komposisi bintang dan nebula, serta prinsip dasar di balik teknologi seperti laser.
Pada akhirnya, memahami tarian elektron ini berarti memahami salah satu alfabet dasar yang digunakan alam semesta untuk bercerita.
Pertanyaan dan Jawaban
Apakah transisi L ke K hanya terjadi pada atom hidrogen?
Tidak. Transisi serupa dari kulit kedua ke kulit pertama juga terjadi pada atom lain, terutama atom-atom mirip hidrogen yang hanya memiliki satu elektron (seperti He+, Li2+). Namun, nilai energi dan panjang gelombang yang dipancarkan akan berbeda karena dipengaruhi oleh muatan inti yang lebih besar.
Mengapa energi transisinya 10,2 eV, padahal tingkat dasarnya -13,6 eV?
Energi -13,6 eV adalah energi tingkat dasar (n=1). Tingkat L (n=2) memiliki energi -3,4 eV. Saat elektron jatuh dari L (n=2, -3.4 eV) ke K (n=1, -13.6 eV), energi foton yang dipancarkan adalah selisih keduanya: (-3.4)
-(-13.6) = +10.2 eV.
Bisakah kita melihat cahaya dari transisi ini secara langsung?
Tidak bisa dengan mata telanjang. Foton dengan energi 10,2 eV berada dalam rentang ultraviolet jauh (far-UV), yang diserap oleh atmosfer Bumi dan tidak terdeteksi oleh retina manusia. Pengamatannya memerlukan teleskop khusus yang ditempatkan di luar atmosfer, seperti Teleskop Hubble.
Apa hubungannya transisi elektron dengan teknologi laser?
Laser bekerja berdasarkan prinsip emisi terstimulasi, yang merupakan “sepupu” dari emisi spontan pada transisi L ke K. Dalam laser, foton yang datang merangsang elektron di tingkat tinggi untuk jatuh dan memancarkan foton lain yang identik, menghasilkan cahaya yang koheren dan monokromatik. Pemahaman tentang transisi elektron antar tingkat energi adalah fondasi dari prinsip ini.