Hitung Persentase Hasil Reaksi Pembuatan Ammonium Sulfat bukan sekadar angka di kertas laboratorium, melainkan kunci untuk membuka efisiensi dalam dunia kimia praktis, dari skala akademik hingga industri pupuk yang masif. Memahami cara mengukur seberapa sukses sebuah reaksi sintesis adalah fondasi bagi siapa pun yang bergelut dengan proses kimia, baik untuk kepentingan penelitian, pendidikan, maupun optimasi produksi.
Melalui eksplorasi mendalam, kita akan menelusuri mulai dari reaksi antara amonia dan asam sulfat, perhitungan stoikiometri yang teliti, hingga analisis variabel percobaan yang memengaruhi hasil akhir. Panduan ini dirancang untuk memberikan peta jalan yang jelas, dilengkapi dengan contoh perhitungan dan latihan soal, agar Anda dapat menguasai konsep persentase hasil dengan otoritatif namun tetap aplikatif dalam konteks nyata.
Konsep Dasar dan Persamaan Reaksi
Ammonium sulfat, salah satu pupuk nitrogen yang sangat dikenal, lahir dari sebuah reaksi kimia yang relatif sederhana namun fundamental. Proses sintesisnya melibatkan penyatuan dua bahan baku utama, yaitu amonia (NH₃) dalam bentuk gas atau larutan, dengan asam sulfat (H₂SO₄). Reaksi ini merupakan contoh klasik dari netralisasi asam-basa, di mana senyawa asam dan basa bereaksi membentuk garam dan air.
Persamaan reaksi yang setara untuk pembentukan ammonium sulfat adalah sebagai berikut: 2NH₃(aq) + H₂SO₄(aq) → (NH₄)₂SO₄(aq). Persamaan ini menunjukkan bahwa dua molekul amonia bereaksi dengan satu molekul asam sulfat untuk menghasilkan satu molekul ammonium sulfat. Reaksi ini bersifat eksotermik, melepaskan sejumlah energi panas. Dalam skala industri, reaksi sering dilakukan dengan mengalirkan gas amonia ke dalam asam sulfat yang telah diencerkan, dengan kontrol ketat terhadap suhu dan laju alir untuk mencegah pembentukan aerosol dan memastikan keselamatan.
Jenis Reaksi dan Tahapan Pembentukan
Reaksi antara amonia dan asam sulfat dikategorikan sebagai reaksi netralisasi asam-basa sekaligus reaksi pembentukan garam. Amonia, meskipun dalam bentuk molekuler, bertindak sebagai basa karena dapat menerima proton (H⁺) dari asam sulfat. Secara konseptual, proses pembentukannya dapat divisualisasikan dalam sebuah diagram alur sederhana. Bayangkan dua aliran bahan baku, satu mengandung amonia dan satu lagi asam sulfat, yang bertemu dalam sebuah reaktor berpengaduk.
Di sana, terjadi kontak molekuler yang intens. Molekul asam sulfat melepaskan ion H⁺nya kepada molekul amonia, membentuk ion ammonium (NH₄⁺). Ion sulfat (SO₄²⁻) yang telah ada kemudian berikatan dengan dua ion ammonium tersebut, membentuk kristal garam ammonium sulfat yang dapat dipisahkan melalui proses kristalisasi dan pengeringan.
Perhitungan Stoikiometri dan Teoritis
Stoikiometri adalah peta jalan bagi seorang kimiawan untuk meramalkan jumlah produk yang akan dihasilkan dari sejumlah reaktan tertentu. Dalam konteks pembuatan ammonium sulfat, perhitungan ini menjadi kunci untuk merencanakan efisiensi bahan baku dan memprediksi hasil. Semua perhitungan dimulai dari persamaan reaksi yang telah setara, yang memberikan rasio mol yang tepat antar semua zat yang terlibat.
Langkah pertama adalah menghitung massa molar setiap senyawa. Massa molar amonia (NH₃) adalah 14 (N) + 3×1 (H) = 17 g/mol. Asam sulfat (H₂SO₄) memiliki massa molar 2×1 (H) + 32 (S) + 4×16 (O) = 98 g/mol. Sementara itu, produk ammonium sulfat ((NH₄)₂SO₄) memiliki massa molar 2x[14+4×1] (2NH₄) + 32 (S) + 4×16 (O) = 132 g/mol. Angka-angka ini adalah fondasi dari semua perhitungan teoritis selanjutnya.
Menentukan Reaktan Pembatas dan Hasil Teoritis
Dalam prakteknya, jarang sekali kedua reaktan tersedia dalam jumlah yang tepat sesuai rasio stoikiometri. Reaktan yang habis terlebih dahulu akan membatasi jumlah produk yang dapat terbentuk, dan itulah yang disebut reaktan pembatas. Untuk menentukannya, kita mengkonversi massa setiap reaktan yang diberikan menjadi mol, lalu membandingkan rasio mol aktual dengan rasio koefisien dari persamaan reaksi.
| Komponen | Koefisien Reaksi | Massa Molar (g/mol) | Contoh Massa (g) | Jumlah Mol (dari contoh) |
|---|---|---|---|---|
| Amonia (NH₃) | 2 | 17 | 34 | 2.0 |
| Asam Sulfat (H₂SO₄) | 1 | 98 | 98 | 1.0 |
| Ammonium Sulfat ((NH₄)₂SO₄) | 1 | 132 | – | – |
Misalkan kita memiliki 34 gram amonia (2 mol) dan 98 gram asam sulfat (1 mol). Rasio mol NH₃ : H₂SO₄ adalah 2:1, yang persis sama dengan rasio koefisien reaksinya (2:1). Ini berarti kedua reaktan tepat habis bereaksi, tidak ada yang sisa. Hasil teoritis ammonium sulfat dihitung dari mol reaktan pembatas (atau salah satunya, karena keduanya tepat). Dari 2 mol NH₃, menurut rasio koefisien 2:1 terhadap produk, akan dihasilkan 1 mol (NH₄)₂SO₄, yang setara dengan 132 gram.
Angka 132 gram inilah yang disebut hasil teoritis, yaitu massa maksimum produk yang mungkin dihasilkan dalam kondisi ideal.
Variabel dan Data Percobaan
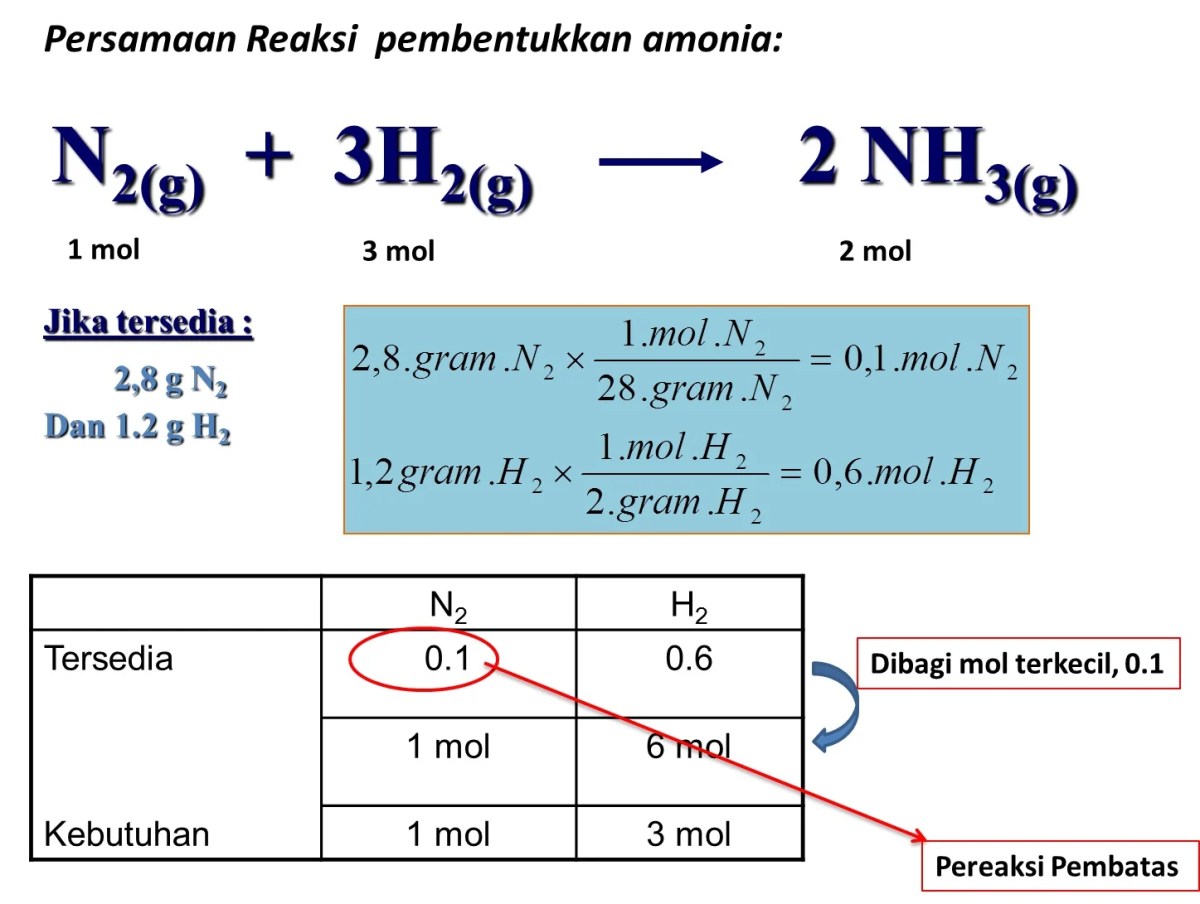
Source: materikimia.com
Di laboratorium atau pabrik, hasil aktual hampir tidak pernah mencapai 100% dari hasil teoritis. Banyak variabel yang berperan dalam menentukan persentase hasil reaksi. Faktor-faktor seperti kemurnian bahan kimia, suhu reaksi, tekanan, kecepatan pengadukan, dan bahkan teknik pemisahan produk (seperti kristalisasi dan penyaringan) dapat mempengaruhi jumlah produk akhir yang berhasil dikumpulkan.
Sebagai contoh, suhu yang terlalu tinggi mungkin menyebabkan penguapan sebagian amonia sebelum bereaksi. Kemurnian asam sulfat yang kurang dari 98% berarti massa yang kita timbang mengandung lebih sedikit molekul H₂SO₄ murni daripada yang kita kira. Selain itu, selama proses penyaringan dan pengeringan, selalu ada sejumlah kecil produk yang tertinggal di peralatan atau terbuang.
Data Percobaan Hipotetis dan Pencatatan, Hitung Persentase Hasil Reaksi Pembuatan Ammonium Sulfat
Berikut adalah contoh data hasil pengamatan dari sebuah sintesis ammonium sulfat di laboratorium pendidikan:
- Massa Awal Amonia (larutan): 50.0 g (dengan konsentrasi tertentu)
- Massa Asam Sulfat (encer) yang digunakan: 120.0 g
- Massa Kertas Saring + Gelas Arloji (sebelum): 45.2 g
- Massa Kertas Saring + Gelas Arloji + Kristal (setelah dikeringkan): 175.8 g
- Massa Kristal Ammonium Sulfat Aktual: 130.6 g (dihitung dari selisih)
- Pengamatan: Terbentuk kristal putih saat pendinginan, larutan awalnya hangat.
Format pencatatan data yang baik harus sistematis dan mencakup semua pengukuran mentah, kondisi percobaan (suhu ruang, konsentrasi larutan), serta perhitungan turunan. Buku catatan laboratorium biasanya memiliki kolom untuk tanggal, tujuan, prosedur, data pengamatan, dan perhitungan. Perbedaan antara hasil aktual (130.6 g) dan hasil teoritis (misalkan dihitung 142.0 g) disebut sebagai yield aktual, yang selalu lebih kecil. Selisih ini merepresentasikan inefisiensi dalam reaksi atau kehilangan selama proses.
Prosedur Perhitungan Persentase Hasil: Hitung Persentase Hasil Reaksi Pembuatan Ammonium Sulfat
Persentase hasil adalah metrik utama untuk mengevaluasi efisiensi sebuah reaksi kimia, baik di lab maupun industri. Nilai ini membandingkan hasil aktual yang berhasil diperoleh dengan hasil teoritis maksimum yang diprediksi oleh stoikiometri. Rumusnya elegan dan langsung pada inti persoalan.
Persentase Hasil = (Massa Produk Aktual / Massa Produk Teoritis) × 100%
Mari kita demonstrasikan dengan data hipotetis sebelumnya. Asumsikan setelah perhitungan stoikiometri berdasarkan reaktan pembatas, kita memperoleh hasil teoritis ammonium sulfat sebesar 142.0 gram. Dari percobaan, kita berhasil mengisolasi 130.6 gram kristal murni.
Langkah Demi Langkah dan Analisis Penyebab
Langkah 1: Tentukan hasil aktual dari data percobaan. (130.6 g)
Langkah 2: Hitung hasil teoritis melalui perhitungan stoikiometri. (142.0 g)
Langkah 3: Masukkan kedua nilai ke dalam rumus persentase hasil.
Langkah 4: Hitung: (130.6 g / 142.0 g) × 100% = 92.0%.Dalam sintesis kimia, menghitung persentase hasil reaksi pembuatan ammonium sulfat adalah kunci untuk mengevaluasi efisiensi proses. Layaknya memahami dinamika sebuah kota, misalnya menelusuri Asal Usul Surabaya yang kaya akan pertarungan antara buaya dan hiu, perhitungan stoikiometri ini juga melibatkan ‘pertarungan’ antara reaktan untuk mencapai hasil optimal. Dengan demikian, analisis yang cermat terhadap yield tersebut menjadi fondasi dalam mengoptimalkan produksi pupuk ini secara industri.
Persentase hasil 92.0% menunjukkan reaksi ini berjalan cukup efisien, namun tetap ada kehilangan sekitar 8%. Faktor-faktor yang dapat menyebabkan persentase hasil kurang dari 100% sangat beragam. Reaksi mungkin tidak berjalan hingga sempurna (kesetimbangan kimia). Produk dapat terlarut dalam pelarut selama penyaringan atau pencucian. Terjadi reaksi samping yang tidak diinginkan yang menghasilkan produk lain.
Kesalahan teknis seperti tumpahan, kristal yang tertinggal di dinding beaker, atau pengeringan yang tidak sempurna dimana kristal masih mengandung air juga berkontribusi besar terhadap rendahnya yield.
Aplikasi dan Contoh Soal Latihan
Penguasaan perhitungan hasil reaksi bukan sekadar latihan akademik. Dalam industri pupuk, perhitungan ini adalah napas dari kontrol proses dan analisis ekonomi. Mengetahui persentase yield yang realistis membantu insinyur kimia merancang pabrik dengan kapasitas yang tepat, mengestimasi kebutuhan bahan baku, mengontrol biaya produksi, dan meminimalkan limbah. Efisiensi yang meningkat beberapa persen saja dapat berarti penghematan yang sangat besar dalam skala produksi puluhan ribu ton per tahun.
Sebagai ilustrasi, sebuah pabrik ammonium sulfat harus terus-menerus memonitor konsumsi amonia dan asam sulfat terhadap tonase pupuk yang dihasilkan. Perhitungan stoikiometri yang real-time membantu mengidentifikasi apakah terjadi kebocoran, reaksi samping, atau inefisiensi pada tahap tertentu, seperti kristalisator atau sentrifugal, sehingga tindakan korektif dapat segera diambil.
Contoh Soal Latihan dengan Penyelesaian
Soal 1 (Dasar): Sebanyak 6.8 gram gas amonia (NH₃) dialirkan ke dalam larutan asam sulfat (H₂SO₄) berlebih. Hitunglah massa teoritis ammonium sulfat ((NH₄)₂SO₄) yang dihasilkan.
Perhitungan persentase hasil reaksi pembuatan ammonium sulfat, atau yield, merupakan indikator efisiensi proses sintesis kimia yang krusial. Nilai ini mengungkap seberapa jauh reaksi nyata mendekati teori, mirip seperti mencari Kata Khusus untuk Gadis yang tepat untuk mendeskripsikan keunikan seseorang. Dalam laboratorium, presisi perhitungan yield ini menentukan optimalisasi produksi dan analisis ekonomi industri pupuk, menjadikannya parameter fundamental yang tak terbantahkan.
Penyelesaian:
1. Mol NH₃ = massa / MM = 6.8 g / 17 g/mol = 0.4 mol.
2. Dari persamaan: 2 mol NH₃ → 1 mol (NH₄)₂SO₄.
3. Mol (NH₄)₂SO₄ teoritis = (0.4 mol NH₃) × (1 mol (NH₄)₂SO₄ / 2 mol NH₃) = 0.2 mol.
4.
Massa teoritis = mol × MM = 0.2 mol × 132 g/mol = 26.4 gram.
Soal 2 (Menengah): Seorang siswa mereaksikan 10.0 gram amonia (NH₃) dengan 40.0 gram asam sulfat (H₂SO₄). Tentukan reaktan pembatas dan hitung massa teoritis ammonium sulfat.
Penyelesaian:
1. Mol NH₃ = 10.0 / 17 ≈ 0.588 mol. Mol H₂SO₄ = 40.0 / 98 ≈ 0.408 mol.
2. Cek kebutuhan: Untuk 0.588 mol NH₃, dibutuhkan H₂SO₄ = (1/2) × 0.588 = 0.294 mol.
3. Karena H₂SO₄ tersedia 0.408 mol (> 0.294 mol), maka NH₃ adalah reaktan pembatas.
4.
Mol (NH₄)₂SO₄ dari NH₃ pembatas = (1/2) × 0.588 mol = 0.294 mol.
5. Massa teoritis = 0.294 mol × 132 g/mol ≈ 38.8 gram.
Soal 3 (Terintegrasi): Dari soal nomor 2, jika setelah sintesis dan pemurnian siswa tersebut memperoleh 35.0 gram kristal ammonium sulfat kering, berapakah persentase hasil reaksinya?
Menghitung persentase hasil reaksi pembuatan ammonium sulfat bukan sekadar teori, melainkan aplikasi prinsip stoikiometri yang ketat. Prinsip perhitungan yang presisi ini juga terlihat dalam analisis Tegangan T pada dua balok di bidang licin dengan gaya 40 N , di mana hukum Newton memberikan kepastian numerik. Demikian pula, dalam sintesis kimia, akurasi perhitungan reaktan menentukan efisiensi proses dan nilai persentase yield yang diperoleh.
Penyelesaian:
1. Hasil aktual = 35.0 g.
2. Hasil teoritis (dari soal 2) = 38.8 g.
3.
Persentase Hasil = (35.0 g / 38.8 g) × 100% ≈ 90.2%.
| Langkah Kunci | Deskripsi | Catatan Penting |
|---|---|---|
| 1. Baca Soal | Identifikasi reaktan, produk, dan data massa/ mol yang diberikan. | Perhatikan kata kunci “berlebih” atau data massa kedua reaktan. |
| 2. Tulis & Setarakan Reaksi | Pastikan persamaan reaksi kimia sudah setara. | Ini adalah fondasi semua perhitungan rasio mol. |
| 3. Konversi ke Mol | Ubah massa semua reaktan menjadi mol menggunakan massa molar. | Gunakan satuan gram per mol (g/mol) dengan teliti. |
| 4. Tentukan Reaktan Pembatas | Bandingkan rasio mol aktual dengan rasio koefisien reaksi. | Reaktan yang memberikan jumlah mol produk paling kecil adalah pembatas. |
| 5. Hitung Hasil Teoritis | Hitung mol produk berdasarkan mol reaktan pembatas, lalu konversi ke massa. | Ini adalah angka maksimum yang mungkin dihasilkan. |
| 6. Hitung Persentase Hasil | Bagi hasil aktual (dari soal) dengan hasil teoritis, kalikan 100%. | Jawaban akhir biasanya dalam bentuk persentase. |
Simpulan Akhir
Menguasai perhitungan persentase hasil pembuatan ammonium sulfat pada akhirnya adalah tentang mengukur jarak antara harapan teoritis dan realita praktis di laboratorium atau pabrik. Keterampilan ini tidak hanya menajamkan analisis ilmiah tetapi juga membentuk mindset efisiensi yang kritis. Dengan demikian, setiap angka persen yang dihitung bukan akhir, melainkan awal untuk investigasi yang lebih mendalam guna menyempurnakan proses dan mendongkrak produktivitas dalam berbagai aplikasi, terutama di industri yang mengandalkan presisi seperti pembuatan pupuk.
Pertanyaan Umum (FAQ)
Apakah persentase hasil bisa lebih dari 100%?
Tidak, dalam konteks ini tidak mungkin. Persentase hasil dihitung dari hasil aktual dibagi hasil teoritis. Nilai di atas 100% biasanya mengindikasikan kesalahan, seperti produk yang belum benar-benar kering atau terkontaminasi zat lain sehingga massanya tampak lebih besar.
Bagaimana jika saya hanya tahu volume larutan reaktan, bukan massanya?
Anda perlu mengonversi volume menjadi massa terlebih dahulu menggunakan data densitas (massa jenis) larutan. Kemudian, gunakan konsentrasi larutan (jika diketahui) untuk mencari mol zat murni yang bereaksi sebelum masuk ke perhitungan stoikiometri.
Mengapa dalam industri, persentase hasil sering kali sangat tinggi mendekati 100%?
Di industri, proses telah dioptimalkan secara ketat. Kondisi reaksi (suhu, tekanan, katalis) dikontrol presisi, bahan baku dimurnikan, dan sistem dirancang untuk meminimalkan kehilangan produk, sehingga efisiensi sangat tinggi dibandingkan percobaan laboratorium skala kecil.
Apakah jenis wadah reaksi memengaruhi persentase hasil?
Tidak secara langsung, tetapi material dan desain wadah dapat memengaruhi. Misalnya, reaksi yang melibatkan gas seperti amonia memerlukan sistem tertutup yang baik untuk mencegah kebocoran, yang jika terjadi akan mengurangi hasil aktual dan menurunkan persentase hasil.


