Hitung volume N2 dan H2 untuk 15 L NH3 pada tekanan sama bukan sekadar angka di kertas, ini adalah kunci membuka pabrik mini amonia di imajinasi kita. Bayangkan kita adalah arsitek reaksi kimia, merancang fondasi gas nitrogen dan hidrogen untuk membangun 15 liter molekul amonia yang kokoh. Prinsipnya elegan seperti resep kue: dari koefisien ajaib N₂ + 3H₂ → 2NH₃, kita bisa mengukur bahan baku gas layaknya menakar tepung dan gula, asalkan semua berada dalam tekanan dan suhu yang setara.
Perjalanan dari teori ke aplikasi ini penuh dengan logika yang memikat dan visualisasi molekuler yang membuat stoikiometri gas terasa hidup dan sangat aplikatif.
Pada tekanan dan suhu yang identik, hubungan volume gas dalam reaksi menjadi sederhana dan langsung mengikuti perbandingan bilangan bulat koefisiennya. Artinya, untuk setiap 2 volume amonia yang dihasilkan, kita membutuhkan 1 volume nitrogen dan 3 volume hidrogen. Dengan target 15 liter NH₃ di garis finish, kita bisa mundur selangkah demi selangkah menghitung berapa liter N₂ dan H₂ yang harus disiapkan di garis start.
Konsep ini, yang didukung oleh Hukum Gay-Lussac, menjadi fondasi penting tidak hanya dalam latihan soal tetapi juga dalam skala industri kecil, misalnya untuk memahami kebutuhan dasar dalam produksi pupuk atau aplikasi laboratorium.
Mengurai Reaksi Kimia Sintesis Amonia dari Sudut Pandang Volume Gas
Bayangkan kita sedang merakit sebuah meja dari kit furnitur. Petunjuknya menyebutkan: untuk membuat 2 bagian meja (NH₃), kamu butuh 1 bagian rangka utama (N₂) dan 3 bagian kaki penyangga (H₂). Sekarang, ganti bagian-bagian fisik itu dengan gelembung gas. Prinsipnya tetap sama. Inilah keindahan stoikiometri gas, di mana peta perakitannya bukan massa, tetapi volume, selama kita bekerja pada ruang yang tekanannya sama.
Reaksi sintesis amonia, N₂ + 3H₂ → 2NH₃, menjadi lebih intuitif ketika kita baca sebagai petunjuk volume: 1 volume nitrogen bergabung dengan 3 volume hidrogen untuk menghasilkan 2 volume amonia.
Hubungan ini bukanlah kebetulan. Pada suhu dan tekanan yang identik, volume gas sebanding dengan jumlah molekulnya (Hukum Avogadro). Koefisien dalam persamaan reaksi yang sudah setara secara otomatis menjadi perbandingan volume gas yang bereaksi dan dihasilkan. Jadi, angka 1, 3, dan 2 pada reaksi tersebut bisa kita artikan sebagai 1 liter, 3 liter, dan 2 liter; atau 1 meter kubik, 3 meter kubik, dan 2 meter kubik.
Ini menyederhanakan perhitungan secara dramatis. Kita tidak perlu melalui konversi mol terlebih dahulu jika data yang diketahui dan ditanyakan sudah dalam volume pada kondisi yang sama.
Perbandingan Volume Reaktan dan Produk dalam Berbagai Skenario
Untuk melihat pola hubungan ini dengan jelas, tabel berikut membandingkan volume gas yang terlibat untuk berbagai target produksi amonia. Perhatikan bagaimana proporsinya selalu tetap, sesuai dengan koefisien reaksi.
| Volume NH₃ yang Dihasilkan (L) | Volume N₂ yang Diperlukan (L) | Volume H₂ yang Diperlukan (L) | Total Volume Reaktan (L) |
|---|---|---|---|
| 1 | 0.5 | 1.5 | 2 |
| 2 | 1 | 3 | 4 |
| 5 | 2.5 | 7.5 | 10 |
| 10 | 5 | 15 | 20 |
| 15 | 7.5 | 22.5 | 30 |
| 20 | 10 | 30 | 40 |
Langkah Perhitungan untuk 15 Liter Amonia
Mari kita terapkan prinsip ini untuk kasus spesifik: menghasilkan 15 liter gas amonia. Perhitungannya menjadi sangat langsung karena kita hanya perlu menggunakan perbandingan senilai.
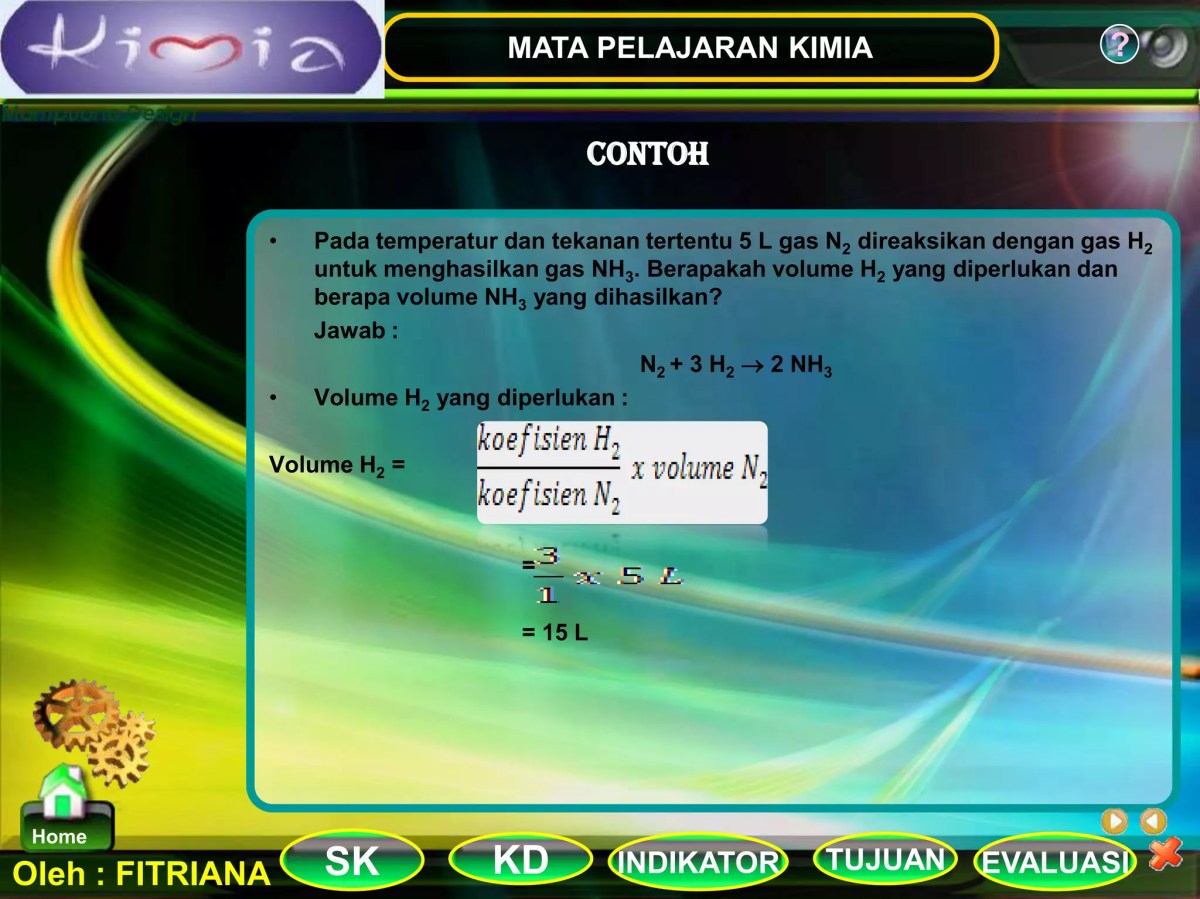
Dari persamaan N₂ + 3H₂ → 2NH₃, kita tahu bahwa 2 volume NH₃ berasal dari 1 volume N₂ dan 3 volume H₂. Untuk menemukan volume N₂ yang menghasilkan 15 L NH₃, kita buat perbandingan: (Koefisien N₂ / Koefisien NH₃) = (Volume N₂ / Volume NH₃). Jadi, (1/2) = (Volume N₂ / 15 L). Volume N₂ = (1/2)
– 15 L = 7.5 L.
Dengan logika yang sama untuk hidrogen: (Koefisien H₂ / Koefisien NH₃) = (Volume H₂ / Volume NH₃). (3/2) = (Volume H₂ / 15 L). Volume H₂ = (3/2)
– 15 L = 22.5 L.
Pada tekanan dan suhu yang tetap, perbandingan volume gas-gas yang bereaksi dan hasil reaksi merupakan bilangan bulat dan sederhana, sesuai dengan koefisien reaksinya.
Analogi Memasak untuk Memvisualisasikan Konsep
Agar konsep ini melekat, mari kita gunakan analogi resep membuat jus jeruk. Resepnya menyatakan: untuk membuat 2 gelas jus jeruk (NH₃), kamu perlu 1 buah jeruk (N₂) dan 3 sendok makan gula (H₂). Jika kamu ingin membuat 15 gelas jus untuk pesta, berapa banyak jeruk dan gula yang dibutuhkan? Kamu akan langsung menghitung: untuk 15 gelas, butuh (1/2)*15 = 7.5 buah jeruk dan (3/2)*15 = 22.5 sendok makan gula.
“Resep” reaksi kimia bekerja persis seperti itu. Volume gas adalah seperti “gelas” dalam resep kita, dan koefisien adalah takaran bahannya. Selama semua bahan diukur dalam wadah yang ukuran “gelas”-nya sama (tekanan dan suhu sama), perhitungannya akan selalu akurat.
Implikasi Praktis Hukum Gay-Lussac dalam Industri Pupuk Skala Kecil
Hukum perbandingan volume yang dipelajari Gay-Lussac pada awal abad ke-19 bukan hanya kuriositas laboratorium. Hukum ini adalah tulang punggung perencanaan praktis di industri, termasuk dalam unit produksi pupuk skala kecil yang mengandalkan sintesis amonia. Prinsip bahwa gas bereaksi dalam perbandingan volume bilangan bulat memungkinkan operator menghitung kebutuhan bahan baku gas secara cepat dan efisien, langsung dari diagram alir proses.
Relevansinya dalam menghasilkan 15 liter amonia sangat langsung. Sebuah koperasi tani dengan generator amonia kecil dapat merancang sistem pasokan gasnya berdasarkan hukum ini. Mengetahui bahwa reaktor mereka dapat menampung proses untuk menghasilkan 15 liter amonia per batch, mereka dapat secara tepat menentukan ukuran tabung penyimpan nitrogen dan hidrogen, atau mengatur laju alir kompresor. Perhitungan 7.5 L N₂ dan 22.5 L H₂ menjadi dasar teknis untuk mengisi order pupuk cair mereka, meminimalkan pemborosan gas yang mahal dan memastikan reaksi berjalan sempurna tanpa sisa reaktan yang menganggur.
Kutipan Prinsip Dasar
“Saya telah menyimpulkan dari eksperimen saya bahwa gas-gas selalu bergabung dalam perbandingan volume yang sangat sederhana… dan volume produk gas, jika ada, juga memiliki hubungan yang sederhana dengan volume reaktan.” – Joseph Louis Gay-Lussac, 1808.
Pernyataan Gay-Lussac ini adalah fondasi dari perhitungan kita. Konteks penerapannya pada sintesis amonia mengonfirmasi bahwa hubungan volume 1:3:2 yang kita gunakan bukanlah pendekatan, tetapi hukum alam yang dapat diandalkan selama kondisi dijaga. Ini memberikan kepastian bagi insinyur dan teknisi dalam mendesain proses.
Prosedur Laboratorium Simulasi
Untuk memahami penerapan hukum ini secara nyata, sebuah prosedur laboratorium simulasi dapat dirancang. Tujuannya adalah membuktikan secara visual perbandingan volume untuk reaksi pembentukan amonia (dalam simulasi, sering digunakan reaksi gas lain dengan prinsip serupa karena amonia bersifat toksik).
Peralatan hipotetis yang dibutuhkan meliputi beberapa tabung ukur berskala yang dilengkapi dengan katup, terbuat dari kaca tebal, sebuah wadah penampung gas yang fleksibel, sumber gas nitrogen dan hidrogen murni dalam silinder kecil bertekanan rendah, serta pelindung wajah dan sarung tangan tahan bahan kimia.
Langkah keselamatan imajiner yang ketat harus diterapkan: prosedur ini hanya simulasi konseptual; kerja dengan gas hidrogen memerlukan ruang berventilasi baik jauh dari sumber api karena sangat mudah terbakar. Penggunaan alat pelindung diri adalah wajib, dan silinder gas harus diikat dengan kuat.
Langkah percobaannya adalah: pertama, ukur dan masukkan 50 mL gas nitrogen ke dalam tabung reaksi berskala. Kedua, ukur 150 mL gas hidrogen ke dalam tabung terpisah. Ketiga, gabungkan kedua gas ke dalam sebuah wadah reaksi yang telah dikosongkan. Keempat, dengan bantuan katalis dan kondisi yang tepat (dalam simulasi ini, kita asumsikan reaksi berjalan sempurna), amati bahwa volume campuran akan berkurang, dan setelah gas amonia yang terbentuk dipisahkan, volume yang tersisa (jika ada) akan menunjukkan apakah perbandingannya tepat.
Hasil idealnya adalah semua gas habis bereaksi membentuk produk, membuktikan ketepatan perbandingan volume 1:3.
Faktor Deviasi dalam Setting Industri Kecil
Dalam praktik lapangan industri skala kecil, sering ditemui deviasi antara perhitungan teoritis 7.5 L N₂ dan 22.5 L H₂ dengan hasil aktual. Faktor pertama adalah ketidakmurnian bahan baku. Gas nitrogen atau hidrogen dari generator sederhana mungkin mengandung uap air atau gas inert lain yang ikut terhitung sebagai volume tetapi tidak bereaksi. Faktor kedua adalah ketidaksempurnaan reaksi. Tanpa katalis yang optimal atau pada suhu dan tekanan yang kurang tepat, reaksi tidak berjalan hingga tuntas, meninggalkan sebagian reaktan tidak terpakai.
Faktor ketiga adalah kebocoran pada sistem perpipaan atau reaktor sederhana, yang menyebabkan kehilangan volume gas sebelum sempat bereaksi. Terakhir, pengukuran volume pada kondisi industri seringkali tidak dilakukan pada tekanan dan suhu persis yang sama, terutama jika gas dipasok dari tangki bertekanan berbeda, sehingga konversi yang tepat perlu memperhitungkan hukum gas ideal.
Visualisasi Molekuler dan Konseptual Aliran Gas Menuju Pembentukan NH₃: Hitung Volume N2 Dan H2 Untuk 15 L NH3 Pada Tekanan Sama
Melampaui angka dan rasio, ada sebuah tarian molekuler yang elegan di balik perhitungan volume untuk sintesis amonia. Setiap liter gas, pada kondisi yang sama, mengandung jumlah molekul yang sama. Jadi, ketika kita mengatakan membutuhkan 1 liter N₂, sebenarnya kita membutuhkan sejumlah tertentu molekul diatomik N₂ yang sangat kuat terikat ikatan rangkap tiganya. Untuk 3 liter H₂, kita membutuhkan tiga kali lipat jumlah molekul H₂ yang lebih kecil dan reaktif.
Tujuan dari proses sintesis adalah memecah ikatan kuat pada N₂ dan H₂, lalu merakit ulang atom-atomnya menjadi 2 liter molekul NH₃ yang baru.
Transformasi ini bersifat kuantitatif yang ketat. Satu molekul N₂ (mengandung 2 atom N) harus bergabung dengan tiga molekul H₂ (mengandung total 6 atom H) untuk menghasilkan dua molekul NH₃ (masing-masing berisi 1 atom N dan 3 atom H, sehingga total 2 atom N dan 6 atom H). Keseimbangan atom ini adalah hukum kekekalan massa dalam wujud molekuler. Ketika diterjemahkan ke dalam volume, karena setiap “paket” volume berisi jumlah molekul yang proporsional, maka perbandingan volume yang dibutuhkan untuk memastikan tidak ada atom yang tersisa pasti mengikuti perbandingan jumlah “paket” molekul tersebut, yaitu 1:3:2.
Deskripsi Diagram Alir dalam Reaktor Tabung
Bayangkan sebuah reaktor tabung horizontal sederhana yang dirancang untuk menghasilkan 15 liter amonia. Di ujung kiri reaktor, terdapat dua saluran masuk. Saluran pertama mengalirkan gas nitrogen dengan laju terkontrol yang setara dengan 7.5 liter pada kondisi proses. Saluran kedua mengalirkan gas hidrogen dengan laju tiga kali lebih besar, setara dengan 22.5 liter. Kedua aliran gas ini bertemu di sebuah ruang pencampur, membentuk aliran gabungan bertekanan yang kemudian dialirkan melalui sebuah bed yang dipenuhi dengan katalis besi (Fe) yang telah diaktivasi.
Saat campuran gas 1:3 ini bersentuhan dengan katalis panas di dalam tabung reaktor, molekul-molekul N₂ dan H₂ teradsorpsi, terpecah, dan bereaksi di permukaan katalis. Molekul amonia yang baru terbentuk kemudian dilepaskan. Aliran keluar dari reaktor adalah campuran yang mengandung amonia produk, bersama dengan sisa nitrogen dan hidrogen yang belum bereaksi karena kesetimbangan. Setelah melalui unit pemisahan dan pendinginan, gas amonia murni diambil dan diukur akumulasinya.
Ketika akumulator menunjukkan tepat 15 liter amonia terkumpul, kita tahu bahwa jumlah molekul N₂ dan H₂ yang telah dikonsumsi persis sesuai dengan “resep” stoikiometri, yang divisualisasikan sebagai volume aliran masuk tadi.
Asumsi Dasar Perhitungan Volume, Hitung volume N2 dan H2 untuk 15 L NH3 pada tekanan sama
Agar perhitungan volume berdasarkan koefisien reaksi ini valid dan dapat dipercaya, beberapa asumsi mendasar harus dipenuhi. Asumsi-asumsi ini seringkali menjadi batasan dalam penerapan praktis.
- Suhu dan Tekanan Konstan: Seluruh volume gas yang dibandingkan harus diukur pada suhu dan tekanan yang identik. Jika berbeda, hukum gas ideal (PV=nRT) harus digunakan untuk menormalkan volumenya ke kondisi yang sama sebelum perbandingan dilakukan.
- Keadaan Gas Ideal: Perhitungan mengasumsikan gas berperilaku mendekati gas ideal, di mana interaksi antarmolekul diabaikan dan volume molekul sendiri sangat kecil dibanding volume wadah. Pada tekanan sangat tinggi, asumsi ini mulai meleset.
- Reaksi Berjalan Sempurna: Perhitungan stoikiometri mengasumsikan reaksi berlangsung tuntas 100% hingga reaktan pembatas habis. Dalam kenyataannya, sintesis amonia adalah reaksi kesetimbangan, sehingga konversi tidak pernah sempurna dan selalu ada sisa reaktan.
- Tekanan Sistem Tetap: Selama reaksi berlangsung, jika volume wadah tetap, tekanan sistem akan berubah karena jumlah molekul gas berkurang (dari 4 molekul reaktan menjadi 2 molekul produk). Perbandingan volume biasanya mengacu pada volume awal reaktan dan volume produk jika keduanya diukur pada tekanan yang sama, bukan tekanan selama reaksi.
Konsep Volume Stoikiometri dan Efisiensi
Konsep “volume stoikiometri” merujuk pada volume tepat setiap reaktan gas yang dibutuhkan agar tidak ada yang berlebih atau kurang sesuai dengan persamaan reaksi. Dalam contoh kita, 7.5 L N₂ dan 22.5 L H₂ adalah volume stoikiometri untuk menghasilkan 15 L NH₃. Konsep ini sangat penting dalam mendesain proses yang efisien. Jika hidrogen yang disuplai kurang dari volume stoikiometri, nitrogen akan berlebih dan terbuang percuma, meningkatkan biaya.
Menghitung volume N₂ dan H₂ untuk menghasilkan 15 L NH₃ pada tekanan sama itu seru, lho! Prinsip perbandingan volume gas dalam reaksi kimia mirip dengan mencari titik temu yang pas dalam matematika, seperti saat kita Cari nilai a agar garis x+y=a menyinggung parabola y=-1/3x^2+x+2. Setelah memahami konsep singgung itu, kita kembali ke stoikiometri: dari reaksi N₂ + 3H₂ → 2NH₃, untuk 15 L NH₃ dibutuhkan 7,5 L N₂ dan 22,5 L H₂.
Jadi, logika analitis dari kedua topik ini saling memperkaya pemahaman kita.
Sebaliknya, jika nitrogen yang kurang, hidrogen berlebih yang mahal akan terbuang. Menghitung dan mengontrol aliran gas mendekati rasio volume stoikiometri adalah inti dari optimasi bahan baku dalam sintesis kimia berbasis gas, memastikan biaya produksi minimal dan yield produk yang maksimal.
Eksplorasi Numerik Variasi Kondisi Reaksi terhadap Kebutuhan Volume Awal
Source: slidesharecdn.com
Menghitung volume N₂ dan H₂ untuk menghasilkan 15 L NH₃ pada tekanan sama ternyata seru lho, kayak menyelesaikan teka-teki kimia yang rapi. Prinsip perbandingan volume gas ini mirip dengan logika geometri saat kita mencari Panjang Diagonal HB pada Gambar , di mana hubungan antar bagian harus tepat. Nah, dari reaksi N₂ + 3H₂ → 2NH₃, kita bisa temukan bahwa untuk 15 L NH₃, dibutuhkan 7,5 L N₂ dan 22,5 L H₂—semuanya selaras dan presisi.
Hubungan antara volume produk amonia dengan volume reaktan yang dibutuhkan bersifat linier langsung, bukan non-linear. Ini adalah konsekuensi langsung dari perbandingan koefisien yang tetap. Jika kita menggandakan target produksi amonia, volume nitrogen dan hidrogen yang dibutuhkan juga akan berlipat dua dengan proporsi yang persis sama. Namun, yang menarik untuk dieksplorasi adalah bagaimana perubahan pada kondisi operasi, atau penyimpangan dari rasio stoikiometri, dapat mempengaruhi hasil.
Variasi jumlah produk yang diinginkan memberikan gambaran yang jelas tentang skalabilitas proses berdasarkan prinsip dasar ini.
Misalnya, sebuah bengkel pertanian kecil mungkin perlu memproduksi amonia dalam jumlah yang berbeda-beda tergantung musim. Memahami bagaimana kebutuhan bahan baku gas berubah secara proporsional memungkinkan perencanaan logistik yang fleksibel. Dari perhitungan kecil untuk percobaan hingga produksi batch yang lebih besar, rumus dasarnya tetap identik, hanya skalanya yang berubah. Ini menunjukkan kekuatan dan kesederhanaan hukum perbandingan volume dalam perencanaan praktis.
Tabel Variasi Volume untuk Berbagai Target Produksi
Tabel berikut memperlihatkan skalabilitas linier dari proses sintesis amonia berdasarkan perhitungan volume stoikiometri. Data ini dapat menjadi referensi cepat bagi operator.
| Target Volume NH₃ (L) | Volume N₂ Stoikiometri (L) | Volume H₂ Stoikiometri (L) | Rasio N₂:H₂:NH₃ |
|---|---|---|---|
| 5 | 2.5 | 7.5 | 1:3:2 |
| 10 | 5 | 15 | 1:3:2 |
| 15 | 7.5 | 22.5 | 1:3:2 |
| 25 | 12.5 | 37.5 | 1:3:2 |
Perbandingan Metode Rasio dan Konsep Mol
Perhitungan untuk 15 L NH₃ menggunakan metode rasio langsung telah ditunjukkan: Volume N₂ = (1/2)*15 L = 7.5 L. Pendekatan ini sangat cepat karena mengabaikan konversi ke mol. Sebagai perbandingan, mari kita gunakan konsep mol dengan asumsi kondisi standar (STP: 0°C, 1 atm, di mana 1 mol gas = 22.4 L). Pertama, hitung mol NH₃ yang ingin dihasilkan: 15 L / (22.4 L/mol) ≈ 0.6696 mol.
Dari koefisien reaksi, mol N₂ yang dibutuhkan adalah setengah dari mol NH₃: 0.5
– 0.6696 mol ≈ 0.3348 mol. Volume N₂ pada STP adalah: 0.3348 mol
– 22.4 L/mol ≈ 7.5 L. Hasilnya identik. Metode mol lebih universal karena dapat menangani kondisi suhu dan tekanan apa pun dengan menggunakan PV=nRT, sedangkan metode rasio volume hanya berlaku jika semua volume dibandingkan pada kondisi yang sama.
Skenario Kelebihan Reaktan dan Dampaknya
Dalam praktik, seringkali salah satu reaktan sengaja diberikan berlebih untuk mendorong reaksi kesetimbangan ke arah produk atau memastikan reaktan mahal lainnya habis bereaksi. Misalkan untuk menghasilkan 15 L NH₃, kita menyuplai 10 L N₂ (berlebih) dan 22.5 L H₂ (stoikiometri). Hidrogen menjadi reaktan pembatas. Volume H₂ yang tersedia (22.5 L) hanya cukup untuk bereaksi dengan (1/3)*22.5 = 7.5 L N₂.
Jadi, hanya 7.5 L N₂ yang akan terpakai, menghasilkan (2/3)*22.5 = 15 L NH₃. Sisa N₂ yang tidak bereaksi adalah 10 L – 7.5 L = 2.5 L. Volume produk akhir NH₃ tetap 15 L, tidak bertambah, karena ditentukan oleh reaktan pembatas (H₂). Kelebihan N₂ ini akan tetap ada sebagai gas inert dalam campuran keluaran reaktor, yang kemudian harus dipisahkan atau didaur ulang.
Konstruksi Alat Bantu Hitung Sederhana Berbasis Prinsip Dasar Stoikiometri Gas
Prinsip perbandingan volume gas yang sederhana ini dapat dikemas menjadi sebuah “kalkulator mental” atau alat bantu hitung manual yang sangat powerful. Intinya adalah mengingat bahwa koefisien reaksi adalah “faktor pengali” volume. Untuk reaksi N₂ + 3H₂ → 2NH₃, faktor pengali dari NH₃ ke N₂ adalah 1/2, dan dari NH₃ ke H₂ adalah 3/
2. Kalkulator ini bekerja dengan satu langkah perkalian.
Jika kamu mengetahui volume produk amonia (V_NH₃), maka kebutuhan reaktan adalah: V_N₂ = (1/2)
– V_NH₃ dan V_H₂ = (3/2)
– V_NH₃. Begitu pula sebaliknya, jika kamu mengetahui volume suatu reaktan, kamu bisa mencari volume produk atau reaktan lain dengan faktor pengali yang sesuai.
Membangun alat bantu seperti ini tidak memerlukan software canggih. Sebuah diagram panah sederhana pada catatan atau poster di dinding workshop sudah cukup. Diagram itu menunjukkan panah dari NH₃ ke N₂ dengan label “× ½”, dan panah dari NH₃ ke H₂ dengan label “× 1.5”. Dengan demikian, siapa pun dapat melakukan perhitungan cepat tanpa harus mengingat rumus setiap saat. Ini adalah contoh bagaimana pemahaman konseptual yang mendalam melahirkan solusi praktis yang elegan dan mudah diakses.
Prosedur untuk Reaksi Gas Lainnya
Prinsip yang sama dapat diterapkan pada berbagai reaksi gas sederhana. Berikut adalah prosedur umum untuk menggunakan perbandingan koefisien sebagai perbandingan volume.
- Pastikan Persamaan Reaksi Setara: Langkah pertama dan terpenting adalah memiliki persamaan reaksi kimia yang sudah setara. Koefisiennya akan menjadi dasar perbandingan.
- Identifikasi Zat yang Diketahui dan Ditanyakan: Tentukan volume gas apa yang sudah diketahui (bisa reaktan atau produk) dan volume gas apa yang ingin dicari.
- Gunakan Rasio Koefisien Langsung: Buat perbandingan sederhana: (Koefisien zat yang ditanya / Koefisien zat yang diketahui) = (Volume zat yang ditanya / Volume zat yang diketahui). Kemudian selesaikan untuk volume yang tidak diketahui.
- Verifikasi Kondisi Pengukuran: Selalu ingat bahwa perhitungan ini hanya valid jika semua volume dibandingkan pada suhu dan tekanan yang sama. Jika tidak, konversi ke kondisi yang sama diperlukan terlebih dahulu.
Contoh Penerapan Kontekstual dan Tips
Sebuah kelompok tani hidroponik ingin membuat larutan pupuk nitrogen dengan menglarutkan amonia dalam air. Mereka merancang sebuah generator kecil yang dapat menghasilkan 8 liter gas amonia per batch untuk dilarutkan ke dalam tangki air. Berapa volume gas nitrogen dan hidrogen yang harus mereka siapkan dalam tabung gas untuk satu batch produksi?
Menggunakan kalkulator mental kita: V_N₂ = (1/2)
– 8 L = 4 L. V_H₂ = (3/2)
– 8 L = 12 L. Jadi, mereka perlu mencampurkan 4 liter nitrogen dengan 12 liter hidrogen pada tekanan proses yang sama.
Tips menghindari kesalahan umum: Selalu periksa kembali apakah persamaan reaksinya sudah setara. Kesalahan paling fatal adalah menggunakan koefisien yang tidak setara. Kedua, pastikan satuan volume konsisten dan semua data mengacu pada kondisi tekanan dan suhu yang identik. Jangan mencampur volume pada kondisi berbeda tanpa melakukan koreksi.
Batasan Utama Pendekatan Volume
Meski sangat berguna, pendekatan yang hanya mengandalkan perbandingan koefisien volume memiliki batasan utama. Batasan pertama adalah ketergantungan mutlak pada kondisi suhu dan tekanan yang sama. Dalam industri, gas sering disimpan dan diangkut pada tekanan tinggi, sementara reaksi berjalan pada tekanan berbeda. Batasan kedua adalah asumsi gas ideal. Pada tekanan sangat tinggi, volume riil gas bisa menyimpang dari prediksi hukum gas ideal, sehingga perhitungan volume menjadi kurang akurat.
Batasan ketiga adalah ketidakmampuan metode ini untuk memperhitungkan reaksi yang tidak tuntas (kesetimbangan). Perhitungan stoikiometri memberikan volume teoritis maksimum, sementara volume aktual produk selalu lebih kecil karena kesetimbangan, dan volume reaktan yang harus disuplai harus lebih besar dari stoikiometri untuk mencapai yield yang diinginkan. Oleh karena itu, pendekatan ini adalah fondasi yang kuat, tetapi dalam desain proses nyata, harus dilengkapi dengan pertimbangan termodinamika kesetimbangan dan perilaku gas riil.
Pemungkas
Jadi, setelah menjelajahi langkah perhitungan dan menyelami analogi yang menyenangkan, kita sampai pada kesimpulan yang solid. Menghitung volume N₂ dan H₂ untuk 15 liter NH₃ pada tekanan sama akhirnya mengkristal menjadi aplikasi langsung dari hukum dasar kimia gas yang elegan. Perhitungan ini bukan akhir, melainkan pintu gerbang untuk bereksperimen lebih jauh—bagaimana jika suhu berubah? Apa yang terjadi jika salah satu gas berlebih?
Eksplorasi numerik dan konseptual yang telah kita lalui memberikan alat bantu yang powerful. Dengan pemahaman ini, kita tidak hanya menjawab satu soal, tetapi memperlengkapi diri dengan logika untuk memecahkan berbagai teka-teki stoikiometri gas lainnya di masa depan.
Tanya Jawab Umum
Apakah hasil perhitungan ini selalu akurat di dunia nyata?
Tidak selalu 100% akurat. Perhitungan teoritis ini mengasumsikan gas bersifat ideal, reaksi berjalan sempurna hingga tuntas, dan tekanan serta suhu benar-benar konstan. Dalam praktiknya, faktor seperti reaksi tidak sempurna, kehilangan gas, atau fluktuasi kondisi dapat menyebabkan deviasi.
Mengapa harus pada tekanan dan suhu yang sama?
Karena hubungan volume yang sederhana (sesuai koefisien) hanya berlaku ketika semua gas diukur pada kondisi tekanan dan suhu yang identik. Jika berbeda, hukum gas (seperti PV=nRT) harus diterapkan untuk menormalkan volumenya terlebih dahulu sebelum membandingkan.
Bagaimana jika yang diketahui adalah volume H₂, bukan NH₃?
Prinsipnya sama, gunakan perbandingan koefisien. Misalnya, jika ada 30 liter H₂, maka volume NH₃ yang dihasilkan adalah (2/3) x 30 = 20 liter, dan volume N₂ yang dibutuhkan adalah (1/3) x 30 = 10 liter (pada P dan T sama).
Apakah metode ini hanya berlaku untuk reaksi pembuatan amonia?
Tidak, prinsip perbandingan volume gas berdasarkan koefisien ini berlaku universal untuk semua reaksi yang melibatkan gas, asalkan diukur pada kondisi tekanan dan suhu yang sama. Contoh lain adalah pembakaran hidrogen (2H₂ + O₂ → 2H₂O dalam bentuk uap).

