Isotop 15/17Cl: Proton, Elektron, dan Neutron dalam Inti mengajak kita menyelami dunia kecil yang luar biasa kompleks, tepat di jantung atom klorin yang kita kenal sehari-hari. Dibalik simbol Cl yang sederhana, tersembunyi kisah tentang dua saudara kembar yang hampir identik: Klorin-35 dan Klorin-37. Mereka berbagi sifat kimia yang sama, namun menyimpan rahasia berbeda dalam inti atomnya, sebuah perbedaan kecil yang justru membuka jendela besar untuk memahami alam semesta pada skala paling fundamental.
Perjalanan menelusuri komposisi subatomik kedua isotop ini bukan sekadar hafalan jumlah proton, neutron, dan elektron. Ini adalah eksplorasi untuk menjawab mengapa klorin di alam selalu hadir sebagai campuran, bagaimana tambahan beberapa neutron dapat memengaruhi stabilitas inti tanpa mengganggu kereaktifan kimianya, serta bagaimana ilmuwan memanfaatkan perbedaan halus ini dalam berbagai bidang, mulai dari melacak polusi air hingga memahami proses geologi purba.
Setiap digit nomor massa menyimpan cerita tentang kekuatan yang mengikat materi.
Pengenalan Dasar Isotop Klorin-35 dan Klorin-37
Dalam tabel periodik, klorin (Cl) dikenal sebagai unsur halogen dengan nomor atom
17. Namun, jika kita mengamati lebih dekat, atom klorin di alam sebenarnya adalah campuran dari dua jenis utama yang memiliki massa berbeda: Klorin-35 dan Klorin-37. Keduanya adalah isotop, yakni varian dari unsur yang sama yang memiliki jumlah proton identik tetapi jumlah neutron berbeda dalam intinya. Keberadaan mereka adalah contoh sempurna untuk memahami bagaimana satu unsur bisa memiliki beberapa “bentuk” dengan sifat kimia yang sama persis.
Komposisi Subatomik Isotop Klorin
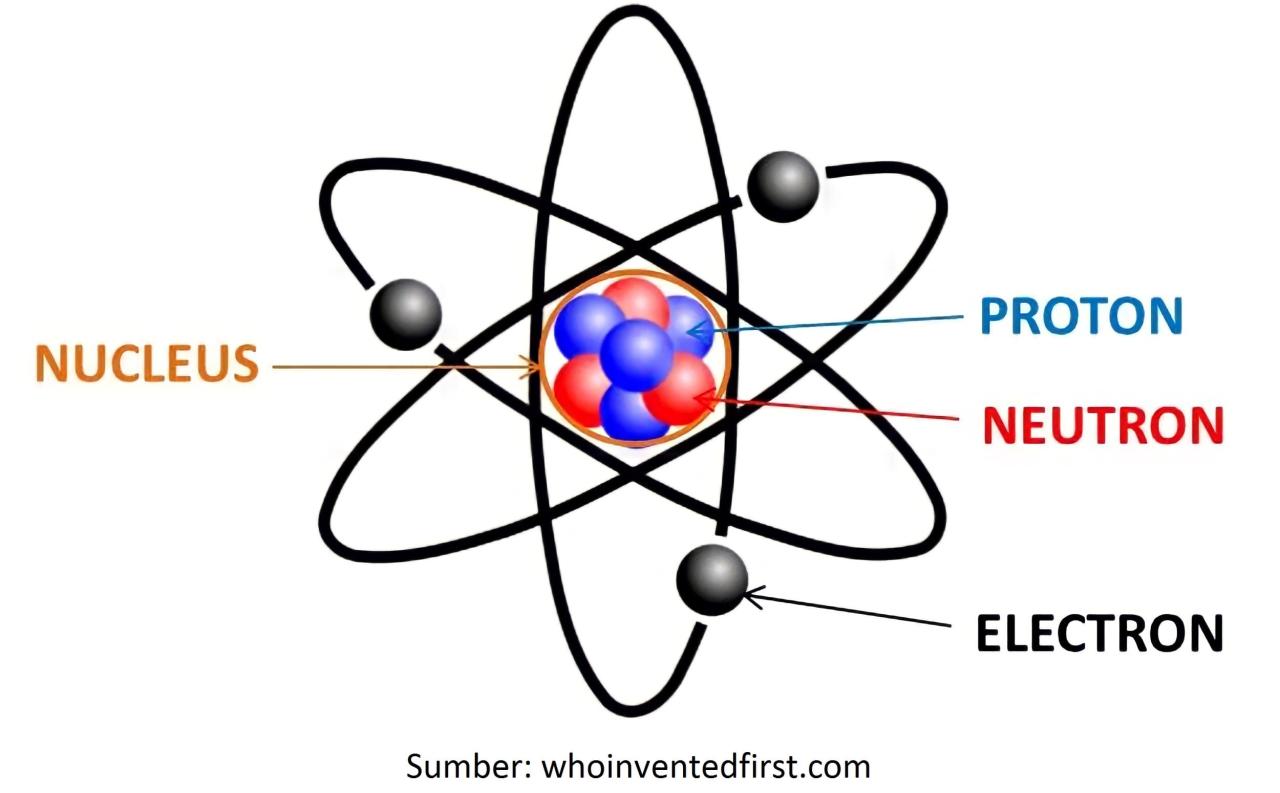
Perbedaan mendasar antara 35Cl dan 37Cl terletak pada komposisi partikel subatomik di intinya. Keduanya memiliki 17 proton, yang mendefinisikan identitasnya sebagai klorin, dan dalam keadaan netral, juga memiliki 17 elektron yang menentukan sifat kimianya. Titik pembedanya adalah jumlah neutron. Perbandingan ini dapat dilihat dengan jelas dalam tabel berikut.
| Isotop | Proton | Neutron | Elektron (netral) |
|---|---|---|---|
| Klorin-35 (35Cl) | 17 | 18 | 17 |
| Klorin-37 (37Cl) | 17 | 20 | 17 |
Sifat Kimia Identik dan Kelimpahan Alami
Meskipun massanya berbeda sekitar dua satuan massa atom, kedua isotop ini menunjukkan sifat kimia yang identik. Hal ini karena sifat kimia suatu atom sepenuhnya dikendalikan oleh konfigurasi elektron valensinya, yang hanya bergantung pada jumlah proton (muatan inti) dan elektron. Karena keduanya sama, maka cara mereka berikatan dengan unsur lain pun sama persis.
Memahami komposisi inti atom, seperti pada isotop klorin-35 dan klorin-37 yang ditandai 15/17Cl, melibatkan penghitungan proton, elektron, dan neutron yang presisi. Proses ilmiah ini mengingatkan kita bahwa ketepatan waktu, termasuk dalam mempelajari Daftar Waktu dalam Bahasa Inggris , adalah fondasi dalam mengukur dan mendeskripsikan fenomena, termasuk peluruhan radioaktif suatu isotop yang terjadi dalam skala waktu tertentu di alam semesta.
Di alam, 35Cl jauh lebih melimpah dibandingkan 37Cl. Kelimpahan alami 35Cl sekitar 75.77%, sementara 37Cl sekitar 24.23%. Massa atom rata-rata klorin yang tercantum di tabel periodik (sekitar 35.45 u) adalah rata-rata tertimbang dari massa kedua isotop ini, yang lebih mendekati 35 karena kelimpahan 35Cl yang dominan.
Konfigurasi dan Struktur Inti Atom
Memahami klorin tidak hanya berhenti pada jumlah partikelnya. Bagaimana partikel-partikel ini tersusun, baik elektron di kulit maupun nukleon di inti, menentukan sifat fisika dan stabilitasnya. Konfigurasi elektron yang spesifik membuatnya sangat reaktif, sedangkan komposisi inti yang seimbang menjadikan kedua isotop ini stabil.
Konfigurasi Elektron dan Stabilitas Inti
Source: akupintar.id
Atom klorin netral memiliki konfigurasi elektron [Ne] 3s² 3p⁵. Tujuh elektron di kulit terluar (valensi) inilah yang menyebabkan klorin sangat elektrofilik dan mudah membentuk ion Cl⁻ untuk mencapai konfigurasi gas mulia. Jumlah elektron ini secara langsung ditentukan oleh jumlah proton (+17) yang harus dinetralkan.
Stabilitas inti bergantung pada rasio neutron terhadap proton. Untuk unsur ringan seperti klorin, rasio stabil adalah sekitar 1:
1. Pada 35Cl, rasio neutron-proton adalah 18:17 (≈1.06), sedangkan pada 37Cl adalah 20:17 (≈1.18). Kedua rasio ini masih berada dalam “pulau kestabilan”, meskipun 37Cl dengan neutron ekstra memiliki energi ikat per nukleon yang sedikit berbeda. Isotop dengan jumlah neutron terlalu banyak atau terlalu sedikit akan menjadi radioaktif, seperti halnya Klorin-36.
Defisit Massa dan Energi Ikat Inti
Massa inti atom selalu sedikit lebih kecil dari jumlah massa proton dan neutron penyusunnya. Selisih ini disebut defisit massa, yang diubah menjadi energi ikat inti yang sangat besar menurut persamaan Einstein, E = Δm c². Sebagai contoh, untuk 35Cl:
Massa 17 proton = 17 × 1.00728 u = 17.12376 u
Massa 18 neutron = 18 × 1.00866 u = 18.15588 u
Jumlah massa partikel = 35.27964 u
Massa aktual inti 35Cl = ≈34.96885 u
Defisit Massa (Δm) = 35.27964 u – 34.96885 u = 0.31079 u
Energi Ikat = Δm × 931.5 MeV/u ≈ 289.5 MeV
Energi ikat inilah “lem” yang menyatukan nukleon di dalam inti, mengatasi tolakan elektrostatik antar proton.
Ilustrasi Struktur Inti Isotop
Bayangkan inti atom 35Cl sebagai sebuah bola padat yang berisi 17 bola merah (proton) dan 18 bola biru (neutron) yang tersusun rapat dan terus bergerak. Pada 37Cl, gambarnya serupa, tetapi di dalam bola yang ukurannya hampir sama, terdapat dua bola biru tambahan. Neutron ekstra ini menempati ruang di antara proton, membantu menstabilkan tolakan listrik dengan meningkatkan jarak rata-rata antar proton dan melalui interaksi nuklir kuat.
Meskipun massanya lebih besar, ukuran inti kedua isotop ini hampir identik, yang menjelaskan mengapa sifat kimianya tidak terpengaruh.
Aplikasi dan Peran Isotop Klorin dalam Sains: Isotop 15/17Cl: Proton, Elektron, Dan Neutron Dalam Inti
Isotop klorin bukan hanya materi pelajaran teori. Perbedaan halus antara 35Cl dan 37Cl, serta isotop radioaktifnya, dimanfaatkan sebagai alat penyelidikan yang canggih dalam berbagai bidang ilmu. Mereka berperan sebagai penanda alami yang dapat melacak pergerakan dan sejarah suatu materi.
Klorin-36 dan Pemanfaatan sebagai Penanda
Sebagai pembanding, Klorin-36 ( 36Cl) yang radioaktif dengan waktu paruh 301.000 tahun, menyoroti kestabilan 35Cl dan 37Cl. Keberadaan 36Cl di alam (dihasilkan dari sinar kosmik atau aktivitas nuklir) justru dimanfaatkan sebagai “jam” geologis. Isotop stabil klorin ( 35Cl dan 37Cl) sendiri digunakan sebagai penanda (tracer) dalam hidrologi untuk melacak sumber dan usia air tanah, serta dalam geokimia untuk mempelajari siklus klorin di laut dan atmosfer.
Pemisahan Isotop di Laboratorium
Di laboratorium, isotop klorin dapat dipisahkan berdasarkan perbedaan massanya yang kecil. Metode yang umum adalah distilasi isotopik atau menggunakan sentrifugasi gas. Dalam distilasi, senyawa klorin seperti HCl didistilasi berulang kali; molekul yang mengandung 35Cl (lebih ringan) akan sedikit lebih mudah menguap dibandingkan yang mengandung 37Cl, sehingga terkonsentrasi di fase uap setelah banyak tahap.
Aplikasi dalam Studi Lingkungan
Rasio isotop klorin ( 37Cl/ 35Cl) menjadi alat forensik lingkungan yang andal. Berikut adalah beberapa penerapannya:
- Melacak sumber pencemaran organoklorin (seperti PCB dan pestisida) di tanah dan air.
- Mempelajari proses degradasi senyawa klorin berbahaya oleh mikroba, karena reaksi biokimia seringkali memilih isotop ringan.
- Menyelidiki sirkulasi air laut purba dan proses evaporasi pada formasi batuan sedimen.
- Mengidentifikasi asal usul klorida dalam sistem air tanah, apakah dari curah hujan, intrusi air laut, atau aktivitas industri.
Analisis Komparatif dan Data Numerik
Untuk mendapatkan gambaran yang komprehensif, data numerik yang akurat sangat diperlukan. Perbandingan ini tidak hanya mencakup jumlah partikel dasar, tetapi juga implikasi dari perbedaan kecil tersebut terhadap sifat fisika dan teknik analisis modern seperti spektroskopi NMR.
Data Numerik Isotop Klorin Stabil
| Parameter | Klorin-35 (35Cl) | Klorin-37 (37Cl) |
|---|---|---|
| Nomor Atom (Z) | 17 | 17 |
| Nomor Massa (A) | 35 | 37 |
| Jumlah Proton | 17 | 17 |
| Jumlah Neutron (N) | 18 | 20 |
| Jumlah Elektron (netral) | 17 | 17 |
| Massa Atom (u) | 34.968852 | 36.965903 |
| Kelimpahan Alami (%) | 75.77 | 24.23 |
Pengaruh pada Sifat Fisika dan Spektroskopi NMR
Secara teoritis, senyawa yang hanya mengandung satu isotop murni, seperti 35Cl 2 atau 37Cl 2, akan memiliki sifat fisika yang sedikit berbeda. Misalnya, titik didih 37Cl 2 akan sedikit lebih tinggi karena molekulnya lebih berat dan gaya dispersi London-nya sedikit lebih kuat, meskipun perbedaannya sangat kecil dan sulit diukur secara praktis.
Perbedaan yang lebih terukur muncul dalam spektroskopi Resonansi Magnetik Nuklir (NMR). Inti 35Cl dan 37Cl memiliki spin inti yang sama (I=3/2), namun momen magnetik dan frekuensi resonansinya berbeda. Akibatnya, dalam NMR khusus untuk klorin, setiap isotop akan menghasilkan sinyal pada frekuensi yang berbeda. Selain itu, keberadaan momen kuadrupol inti yang besar membuat garis sinyal NMR klorin sangat lebar, yang menjadi tantangan sekaligus informasi dalam analisis struktur.
Dalam proses fisika dan kimia, isotop yang lebih berat seperti Klorin-37 sering kali mengalami fraksinasi, terkonsentrasi pada fase atau senyawa tertentu. Misalnya, dalam reaksi evaporasi, molekul air yang mengandung 35Cl lebih mudah menguap, meninggalkan air sisa yang sedikit diperkaya dengan 37Cl. Prinsip serupa berlaku pada pembentukan mineral, di mana ikatan yang lebih kuat dengan 37Cl dapat membuatnya sedikit lebih banyak terkandung dalam fase padat.
Simulasi dan Representasi Visual Konseptual
Membayangkan dunia atom membutuhkan analogi dan deskripsi yang kuat. Meskipun tidak dapat dilihat langsung, kita dapat membangun model mental yang akurat tentang bagaimana isotop klorin “tampak” dan berperilaku, serta bagaimana ilmuwan membedakan mereka dalam instrumen.
Visualisasi Atom Klorin-35
Bayangkan sebuah titik pusat yang sangat padat, itulah inti 35Cl, sekumpulan 17 proton dan 18 neutron yang bergerak cepat terikat menjadi satu. Di sekelilingnya, pada jarak yang sangat jauh relatif terhadap ukuran inti, terdapat 17 elektron yang membentuk awan elektron. Tiga pasang elektron menempati orbital dalam, sementara di kulit terluar, lima elektron valensi bergerak dalam pola awan berbentuk dumbbell (orbital p) yang kurang lebih simetris.
Awan elektron inilah yang akan terdistorsi ketika atom klorin mendekati atom lain untuk berikatan.
Pengaruh Neutron Ekstra pada Awan Elektron, Isotop 15/17Cl: Proton, Elektron, dan Neutron dalam Inti
Pada 37Cl, penambahan dua neutron di inti tidak mengubah muatan positif total. Oleh karena itu, gaya tarik elektrostatik antara inti dan awan elektron tetap sama persis. Akibatnya, konfigurasi dan kerapatan awan elektron praktis identik. Perbedaan massal inti yang sangat kecil dapat mempengaruhi frekuensi vibrasi molekul dalam spektroskopi inframerah resolusi tinggi, tetapi tidak mengubah distribusi muatan elektronik yang menentukan sifat kimia.
Analogi Perbedaan Massa Isotop
Anggaplah Anda memiliki dua sepeda yang identik secara model, warna, dan fungsi. Sepeda pertama ( 35Cl) memiliki rangka dari aluminium biasa. Sepeda kedua ( 37Cl) memiliki rangka dari campuran aluminium yang sedikit lebih padat, sehingga total massanya 2 kg lebih berat. Kedua sepeda itu akan dikendarai dengan cara yang sama, belok di tempat yang sama, dan membutuhkan tenaga pedal yang serupa untuk rute datar.
Namun, sepeda yang lebih berat akan lebih sulit untuk diakselerasi atau diangkat—analogi dari perbedaan dalam sifat fisika seperti difusi atau vibrasi molekuler.
Prinsip Pembedaan dalam Spektrometer Massa
Dalam spektrometer massa, sampel senyawa klorin diionisasi menjadi ion positif, seperti Cl⁺. Ion-ion ini kemudian dipercepat oleh medan listrik dan dibelokkan oleh medan magnet. Gaya belok magnetik bergantung pada rasio massa terhadap muatan (m/z). Karena muatan ion Cl⁺ sama (+1), ion 35Cl⁺ yang lebih ringan akan dibelokkan lebih mudah dibandingkan ion 37Cl⁺ yang lebih berat. Akibatnya, kedua isotop akan menempuh jalur yang berbeda dan mengenai detektor pada posisi yang berbeda, menghasilkan dua puncak terpisah dalam spektrum massa.
Isotop klorin-35 dan klorin-37, dengan jumlah proton dan elektron yang sama namun neutron berbeda, menunjukkan kestabilan inti atom yang unik. Stabilitas ini, seperti halnya fenomena Energi yang ditimbulkan oleh benda yang digesek , berakar pada interaksi partikel di tingkat mikroskopis. Energi gesekan yang muncul dari interaksi permukaan, secara konseptual, paralel dengan energi ikat yang menyatukan proton dan neutron dalam inti atom klorin tersebut, menentukan sifat dan perilaku isotopnya di alam.
Jarak antara dua puncak itu, yang sesuai dengan selisih 2 satuan massa atom, adalah bukti langsung dari keberadaan isotop.
Ulasan Penutup
Dengan demikian, penjelajahan kita terhadap Isotop 15/17Cl: Proton, Elektron, dan Neutron dalam Inti mengungkap bahwa keunikan alam sering kali terletak pada detail yang tersembunyi. Klorin-35 dan Klorin-37, dengan komposisi nukleonnya yang berbeda, menjadi bukti nyata bahwa kimia adalah permainan elektron, sementara fisika inti adalah drama proton dan neutron. Pemahaman mendalam tentang kedua isotop stabil klorin ini tidak hanya memuaskan rasa ingin tahu akademis, tetapi juga menjadi landasan teknologi analitis mutakhir yang menjaga lingkungan dan mendorong inovasi sains.
Inti atom, meski kecil, ternyata menyimpan pengaruh yang sangat besar.
Jawaban yang Berguna
Apakah mungkin menemukan isotop Klorin-35 atau Klorin-37 dalam keadaan murni di alam?
Tidak mungkin secara alami. Di alam, klorin selalu ditemukan sebagai campuran dari kedua isotop stabil tersebut dengan perbandingan kelimpahan yang tetap (sekitar 75.77% Cl-35 dan 24.23% Cl-37). Pemisahan untuk mendapatkan satu jenis isotop murni memerlukan proses industri atau laboratorium yang kompleks dan mahal, seperti difusi gas atau pemisahan elektromagnetik.
Dalam analisis isotop klorin, 15/17Cl, kita menemukan inti atom dengan 17 proton dan jumlah neutron yang bervariasi. Prinsip pencarian faktor bersama ini mengingatkan pada logika matematika dalam menentukan KPK 21 dan 49 , di mana kita mencari kelipatan persekutuan terkecil. Sama halnya, mempelajari konfigurasi proton, elektron, dan neutron dalam inti 15/17Cl memberikan pemahaman mendasar tentang stabilitas dan sifat kimiawi unsur tersebut di alam.
Bagaimana cara membedakan Klorin-35 dan Klorin-37 dalam sebuah senyawa secara praktis?
Secara praktis dalam analisis kimia, perbedaan massa ini dapat dideteksi menggunakan Spektrometri Massa (MS). Instrumen ini akan menghasilkan dua puncak yang terpisah untuk ion yang mengandung Cl-35 dan Cl-37, dengan perbandingan intensitas yang mencerminkan kelimpahan alaminya. Teknik lain adalah Resonansi Magnetik Nuklir (NMR), di mana perbedaan spin inti menyebabkan pergeseran kimia yang sedikit berbeda.
Apakah ada isotop klorin lain selain Cl-35 dan Cl-37?
Ya, klorin memiliki beberapa isotop radioaktif, dengan yang paling dikenal adalah Klorin-36. Isotop ini memiliki waktu paruh sekitar 300.000 tahun dan digunakan sebagai penanda (tracer) dalam studi geologi dan hidrologi untuk melacak usia air tanah atau proses pelarutan batuan. Namun, kelimpahan Cl-36 di alam sangat-sangat kecil dibandingkan dua isotop stabilnya.
Mengapa perbedaan jumlah neutron tidak memengaruhi sifat kimia suatu unsur?
Sifat kimia suatu atom sangat ditentukan oleh konfigurasi elektron valensinya, yang jumlahnya sama dengan jumlah proton (nomor atom). Karena kedua isotop klorin memiliki jumlah proton (17) dan elektron (17) yang sama, maka susunan elektron dan cara berinteraksinya dengan atom lain pun identik. Neutron berada di inti dan tidak terlibat langsung dalam ikatan kimia.

