Jumlah elektron maksimum yang dapat menempati tingkat energi ketiga adalah pertanyaan mendasar yang membuka gerbang memahami struktur atom, fondasi dari segala materi di alam semesta. Konsep ini bukan sekadar angka, melainkan kunci untuk memprediksi sifat kimia suatu unsur, dari yang paling stabil hingga yang paling reaktif. Mari kita selami rahasia kulit elektron ketiga ini, yang kapasitasnya jauh lebih besar daripada pendahulunya, dan bagaimana ia mengatur “tempat tinggal” bagi elektron-elektron dalam atom.
Dalam konfigurasi elektron, tingkat energi ketiga (n=3) dapat menampung maksimal 18 elektron, sebuah aturan dasar yang patut dipahami. Namun, pemahaman konsep yang baik juga memerlukan lingkungan belajar yang mendukung, yang bisa diawali dengan menyusun Pertanyaan untuk Pengenalan Lingkungan Sekolah. Dengan fondasi lingkungan yang kondusif, eksplorasi mendalam tentang jumlah elektron maksimum di kulit ketiga pun akan menjadi lebih efektif dan terstruktur.
Dalam model atom mekanika kuantum, elektron tidak berputar secara sembarangan, tetapi menempati daerah tertentu yang disebut tingkat energi atau kulit, dinomori dari dalam keluar (n=1, 2, 3, dst). Setiap kulit memiliki kapasitas maksimum yang dihitung dengan rumus 2n². Untuk kulit ketiga (n=3), perhitungannya menjadi 2 x (3)² = 18 elektron. Namun, pengisian aktualnya mengikuti prinsip Aufbau yang lebih kompleks, di mana subkulit 3d baru terisi setelah 4s, menjadikan pemahaman ini menarik dan penuh nuansa.
Konsep Dasar Tingkat Energi dan Konfigurasi Elektron
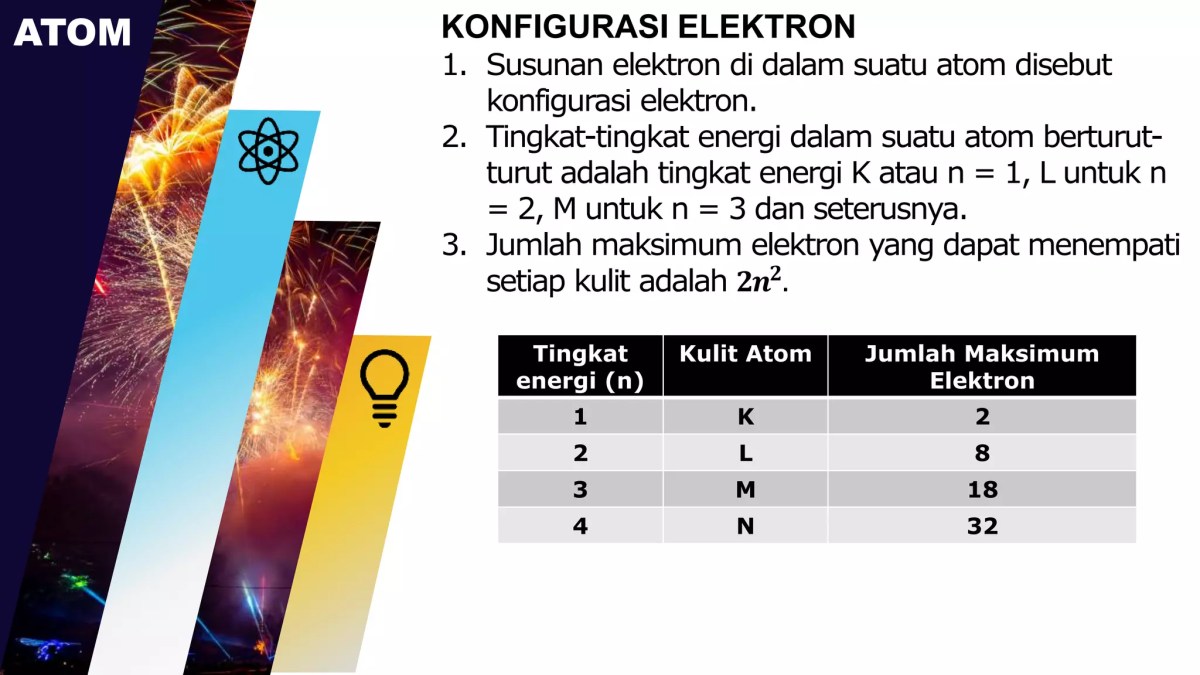
Dalam memahami struktur atom, konsep tingkat energi atau kulit elektron merupakan fondasi yang krusial. Model atom mekanika kuantum modern menggambarkan elektron tidak berputar pada lintasan pasti seperti planet, melainkan menempati wilayah ruang dengan probabilitas tertentu yang disebut orbital. Orbital-orbit ini dikelompokkan ke dalam tingkat-tingkat energi utama, yang sering kita sebut sebagai kulit elektron dan dilambangkan dengan bilangan kuantum utama (n) atau huruf K, L, M, dan seterusnya.
Nomor kulit (n) memiliki hubungan langsung dengan kapasitasnya menampung elektron. Semakin besar nilai n, semakin tinggi tingkat energinya dan semakin banyak elektron yang dapat ditampung. Kapasitas maksimum elektron untuk setiap kulit dihitung dengan sebuah rumus yang elegan dan fundamental.
Rumus umum untuk menentukan jumlah maksimum elektron pada suatu kulit adalah 2n², di mana n adalah nomor kulit (bilangan kuantum utama).
Berikut adalah perbandingan kapasitas untuk tiga kulit pertama, yang memberikan gambaran jelas tentang perkembangan kompleksitas struktur atom.
| Nomor Kulit (n) | Notasi | Jumlah Orbital Maksimum (n²) | Jumlah Elektron Maksimum (2n²) |
|---|---|---|---|
| 1 | K | 1 | 2 |
| 2 | L | 4 | 8 |
| 3 | M | 9 | 18 |
Analisis Detail Kulit Ketiga (n=3): Jumlah Elektron Maksimum Yang Dapat Menempati Tingkat Energi Ketiga
Kulit ketiga, dengan notasi M dan n=3, menandai titik di mana struktur elektronik atom mulai menunjukkan kerumitan yang menarik. Dengan menerapkan rumus 2n², perhitungan kapasitasnya menjadi 2 x (3)² = 2 x 9 = 18 elektron. Angka ini bukanlah angka acak, melainkan penjumlahan dari kapasitas subtingkat energi yang menyusunnya.
Kulit ketiga terdiri dari tiga subtingkat energi yang ditandai oleh bilangan kuantum azimuth (l), yaitu s (l=0), p (l=1), dan d (l=2). Setiap subtingkat memiliki jumlah orbital yang berbeda-beda, di mana satu orbital dapat diisi maksimal dua elektron dengan spin berlawanan.
- Subtingkat 3s: Memiliki 1 orbital, sehingga dapat menampung maksimal 2 elektron.
- Subtingkat 3p: Memiliki 3 orbital, sehingga dapat menampung maksimal 6 elektron.
- Subtingkat 3d: Memiliki 5 orbital, sehingga dapat menampung maksimal 10 elektron.
Total elektron maksimum kulit M adalah 2 + 6 + 10 = 18 elektron, yang sesuai dengan hasil perhitungan rumus 2n². Lonjakan kapasitas ini sangat signifikan jika dibandingkan dengan kulit-kulit sebelumnya.
Kulit pertama (K) hanya mampu menampung 2 elektron, membentuk atom yang sangat stabil seperti helium. Kulit kedua (L) menampung hingga 8 elektron, sebuah pola yang sering terlihat dalam kestabilan gas mulia seperti neon. Kulit ketiga (M), dengan kapasitas 18 elektron, memperkenalkan subtingkat d dan menjadi fondasi bagi periode ketiga dan keempat dalam tabel periodik, memungkinkan keberagaman unsur yang jauh lebih luas.
Distribusi Elektron dan Prinsip Aufbau
Elektron tidak mengisi kulit dan subtingkat energi secara sembarangan. Mereka mengikuti prinsip Aufbau, yaitu mengisi dari tingkat energi terendah ke tertinggi. Urutan pengisian ini dapat divisualisasikan sebagai sebuah tangga energi. Bayangkan anak tangga terendah adalah orbital 1s, kemudian naik ke 2s, lalu 2p, kemudian 3s, dan seterusnya. Yang menarik, meskipun subtingkat 3d secara nominal berada di kulit ketiga (n=3), energi aktualnya justru sedikit lebih tinggi daripada orbital 4s.
Oleh karena itu, elektron akan mengisi 4s terlebih dahulu sebelum mengisi 3d.
Konfigurasi elektron untuk 18 unsur pertama dengan jelas menunjukkan perkembangan pengisian kulit ketiga. Misalnya, natrium (Na, nomor atom 11) memiliki konfigurasi 1s² 2s² 2p⁶ 3s¹. Di sini, kulit ketiga baru mulai terisi. Unsur argon (Ar, nomor atom 18) menandai titik di mana kulit ketiga terisi subtingkat s dan p secara penuh: 1s² 2s² 2p⁶ 3s² 3p⁶.
Meski aturan umum berlaku, terdapat pengecualian yang didorong oleh stabilitas. Konfigurasi dengan subkulit d yang terisi penuh (d¹⁰) atau setengah penuh (d⁵) memiliki kestabilan ekstra. Contoh klasik adalah kromium (Cr, nomor atom 24). Alih-alih memiliki konfigurasi [Ar] 4s² 3d⁴, atom kromium mengambil konfigurasi [Ar] 4s¹ 3d⁵ untuk mencapai stabilitan setengah penuh pada subkulit 3d. Fenomena serupa terjadi pada tembaga (Cu, nomor atom 29) yang memilih [Ar] 4s¹ 3d¹⁰ untuk mencapai konfigurasi penuh.
Aplikasi dan Contoh Soal
Memahami kapasitas kulit ketiga menjadi keterampilan praktis dalam menentukan konfigurasi elektron dan sifat unsur. Berikut adalah contoh soal bertingkat untuk mengasah pemahaman.
Contoh Mudah: Berapa jumlah elektron maksimum yang dapat menempati kulit ketiga (n=3)?
Penyelesaian: Gunakan rumus 2n². Untuk n=3, maka 2 x (3)² = 2 x 9 = 18 elektron.
Contoh Sedang: Unsur belerang (S) memiliki nomor atom 16. Tentukan jumlah elektron yang menempati kulit ketiga pada atom netral belerang.
Penyelesaian: Konfigurasi elektron S adalah 1s² 2s² 2p⁶ 3s² 3p⁴. Elektron pada kulit ketiga (n=3) adalah yang berada pada orbital 3s dan 3p. Jumlahnya adalah 2 (dari 3s²) + 4 (dari 3p⁴) = 6 elektron.
Contoh Sulit: Suatu ion X²⁺ memiliki konfigurasi elektron [Ne] 3s² 3p⁶ 3d⁸. Tentukan jumlah elektron yang semula menempati kulit keempat (n=4) pada atom netral X.
Penyelesaian: Konfigurasi ion X²⁺ adalah 1s² 2s² 2p⁶ 3s² 3p⁶ 3d⁸ (total 28 elektron). Ion ini bermuatan +2, berarti atom netral X memiliki 28 + 2 = 30 elektron. Konfigurasi penuh atom X adalah [Ar] 4s² 3d⁸.
Kulit keempat (n=4) hanya terisi subkulit 4s, yang berisi 2 elektron. Jadi, jawabannya adalah 2 elektron.
Tabel berikut memberikan gambaran nyata bagaimana elektron mendistribusikan diri pada kulit ketiga untuk beberapa unsur.
| Unsur | Nomor Atom | Konfigurasi Elektron | Elektron di Kulit M (n=3) |
|---|---|---|---|
| Natrium (Na) | 11 | 1s² 2s² 2p⁶ 3s¹ | 1 |
| Fosfor (P) | 15 | 1s² 2s² 2p⁶ 3s² 3p³ | 5 |
| Argon (Ar) | 18 | 1s² 2s² 2p⁶ 3s² 3p⁶ | 8 |
| Kalsium (Ca) | 20 | 1s² 2s² 2p⁶ 3s² 3p⁶ 4s² | 8 |
| Besi (Fe) | 26 | 1s² 2s² 2p⁶ 3s² 3p⁶ 3d⁶ 4s² | 14 |
Prosedur menentukan sisa elektron setelah kulit ketiga penuh cukup sistematis. Jika kulit ketiga (maksimal 18 elektron) telah terisi penuh, seperti pada ion Kalsium (Ca²⁺: [Ar]), maka elektron berikutnya akan mulai mengisi kulit keempat, dimulai dari orbital 4s yang energinya lebih rendah daripada 3d. Pola ini menjelaskan mengapa unsur-unsur periode keempat, seperti kalium dan kalsium, mengutamakan pengisian elektron di kulit keempat sebelum melanjutkan mengisi subkulit 3d pada kulit ketiga.
Perbandingan dengan Model Atom Lain
Source: slidesharecdn.com
Konsep kulit elektron mengalami evolusi yang signifikan dari model Bohr ke model mekanika kuantum. Dalam model Bohr, kulit ketiga dianggap sebagai lintasan melingkar ketiga yang dapat menampung tepat 8 elektron, sebuah angka yang didasarkan pada pola empiris saat itu. Model ini gagal menjelaskan keberadaan unsur-unsur transisi yang elektronnya melebihi 8 di kulit ketiga. Model mekanika kuantum, dengan memperkenalkan subtingkat energi (s, p, d), berhasil memecahkan teka-teki ini.
Kapasitas 18 elektron untuk kulit ketiga dari rumus 2n² menjadi prediksi teoretis yang terbukti secara eksperimen.
Dalam konfigurasi elektron, tingkat energi ketiga (n=3) mampu menampung maksimum 18 elektron, sebuah aturan yang diturunkan dari rumus 2n². Pemahaman tentang simbol dan notasi ilmiah semacam ini sangat krusial, sebagaimana halnya memahami Arti Simbol Stv dalam konteks yang berbeda untuk interpretasi yang tepat. Kembali ke dunia atom, pengetahuan tentang kapasitas elektron ini menjadi fondasi untuk memprediksi sifat kimia suatu unsur.
Perbandingan antara kapasitas teoritis 2n² dan urutan pengisian aktual berdasarkan prinsip Aufbau mengungkap nuansa penting. Meskipun kulit ketiga secara teori dapat menampung 18 elektron, urutan energi yang tumpang tindih menyebabkan pengisiannya tidak linear. Subkulit 4s memiliki energi yang lebih rendah daripada subkulit 3d. Oleh karena itu, setelah 3s dan 3p terisi (total 8 elektron, seperti pada argon), dua elektron berikutnya justru mengisi 4s, bukan 3d.
Baru setelah 4s terisi, elektron mulai memasuki orbital 3d.
Alasan di balik fenomena ini terletak pada efek perlindungan dan penetrasi orbital. Orbital s (seperti 4s) memiliki probabilitas yang lebih tinggi untuk ditemukan sangat dekat dengan inti dibandingkan orbital d (seperti 3d) pada tingkat energi yang sama nominalnya. Kemampuan “menembus” ini membuat elektron pada orbital 4s merasakan tarikan inti yang lebih efektif, sehingga menurunkan energinya di bawah orbital 3d. Inilah sebabnya subkulit 3d, meski bagian dari kulit ketiga, baru terisi setelah subkulit 4s, dan unsur-unsur dengan elektron 3d yang terisi dikategorikan sebagai unsur transisi periode keempat.
Ringkasan Akhir
Dengan demikian, angka 18 sebagai jumlah elektron maksimum di kulit ketiga bukanlah sekadar hasil hitungan matematis 2n², melainkan sebuah konsekuensi logis dari aturan main kuantum yang elegan. Pemahaman ini menjadi fondasi kokoh untuk menerjemahkan konfigurasi elektron menjadi sifat periodik unsur. Dari reaktivitas logam alkali hingga kestabilan gas mulia, semuanya berawal dari bagaimana elektron, termasuk yang berada di kulit ketiga, mengisi orbital-orbitalnya.
Menguasai konsep ini berarti memiliki kunci awal untuk membuka misteri perilaku materi di tingkat paling fundamental.
Pertanyaan dan Jawaban
Apakah kulit ketiga (n=3) selalu terisi penuh dengan 18 elektron pada unsur-unsur yang stabil?
Tidak selalu. Pada unsur-unsur golongan utama (blok s dan p), kulit ketiga dianggap “penuh” setelah menampung 8 elektron (konfigurasi gas mulia Argon). Subkulit 3d (yang dapat menampung 10 elektron) baru mulai terisi pada unsur-unsur transisi periode ke-4, meskipun secara nominal masih berada di kulit n=3.
Mengapa subkulit 4s terisi lebih dulu daripada 3d padahal 3d bagian dari kulit ketiga?
Ini karena urutan pengisian elektron ditentukan oleh energi orbital, bukan semata-mata nomor kulitnya. Karena efek pelindung dan tolakan antar elektron, energi subkulit 4s menjadi sedikit lebih rendah daripada 3d untuk atom netral, sehingga 4s terisi terlebih dahulu menurut prinsip Aufbau.
Dalam atom, tingkat energi ketiga mampu menampung hingga 18 elektron, sebuah konfigurasi yang menopang kestabilan struktur materi. Prinsip keseimbangan ini pun tercermin dalam ekosistem, di mana Interaksi Makhluk Hidup dan Komponen Abiotik dalam Lingkungan membentuk suatu jaringan yang dinamis dan saling bergantung. Sama halnya dengan elektron yang mengisi orbital secara teratur, interaksi harmonis tersebut menjadi fondasi utama bagi keberlangsungan sistem, baik di dunia mikroskopis atom maupun dalam skala makro sebuah bioma.
Bagaimana cara cepat mengetahui jumlah elektron di kulit ketiga suatu unsur tanpa menulis konfigurasi penuh?
Untuk unsur periode 1-3, elektron di kulit ketiga sama dengan nomor atom dikurangi 10 (elektron di kulit K dan L). Untuk periode 4 ke atas, perlu diperhatikan bahwa setelah 4s terisi, elektron mulai mengisi 3d. Cara paling akurat adalah dengan memahami konfigurasi elektron berdasarkan tabel periodik.
Apa perbedaan kapasitas kulit ketiga menurut model Bohr dan model mekanika kuantum?
Model Bohr memberikan rumus kapasitas 2n² yang sama, namun menganggap elektron mengorbit dalam lintasan pasti. Mekanika kuantum memperhalus konsep ini dengan memperkenalkan orbital (s, p, d) dalam subkulit, menjelaskan mengapa pengisian 3d tertunda setelah 4s, sesuatu yang tidak bisa dijelaskan model Bohr.

