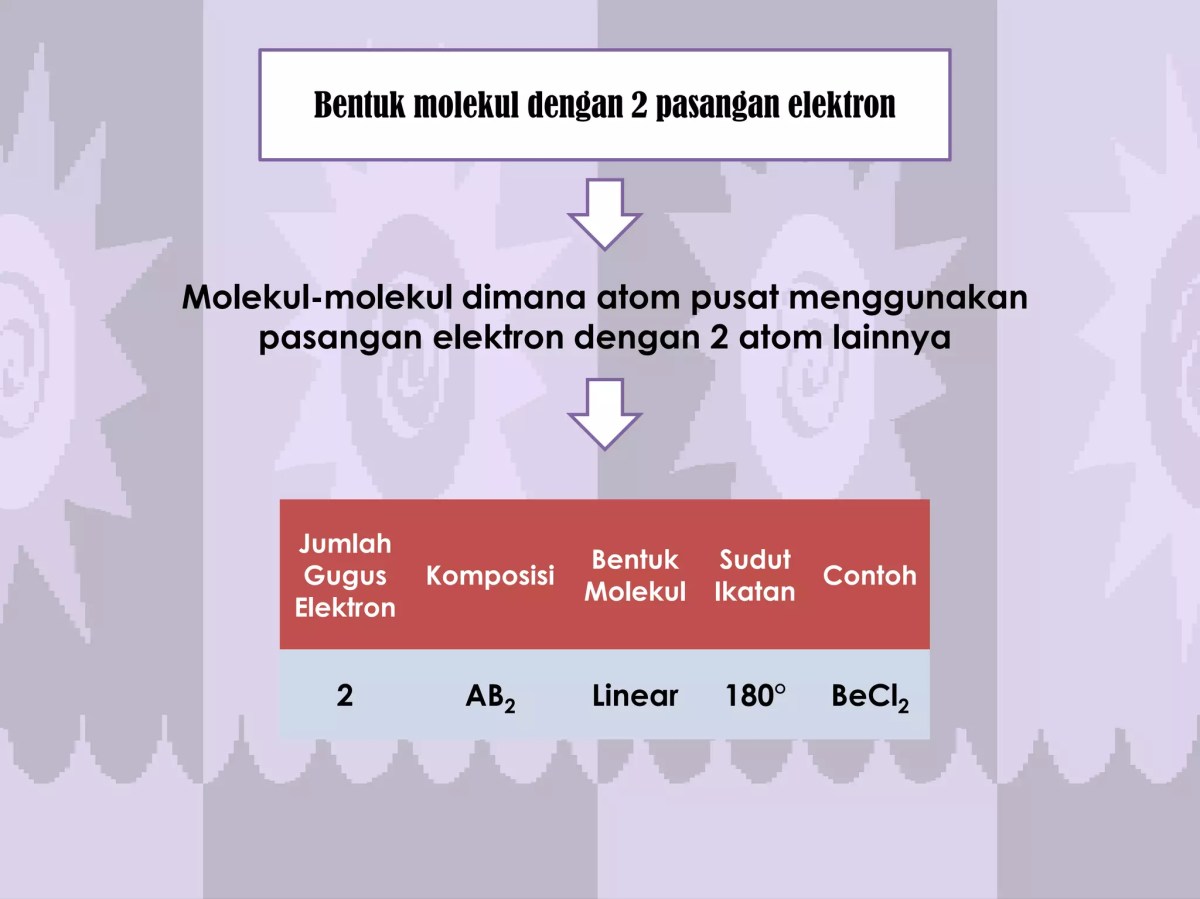
Jumlah gugus donor pasangan elektron dalam struktur senyawa itu ibarat jumlah tangan yang siap menjabat untuk membangun hubungan. Dalam dunia molekuler yang rumit, tangan-tangan tak kasat mata inilah yang menentukan nasib suatu senyawa: apakah dia akan menjadi ligan yang setia mengelilingi logam, katalis yang handal, atau sekadar penonton dalam reaksi kimia. Pemahaman tentang hal ini bukan cuma urusan teori di buku teks yang kaku, tapi fondasi untuk mendesain material baru, obat-obatan, hingga katalis industri.
Bayangkan saja, dengan menghitung dan mengenali “tangan donor” ini, kita bisa memprediksi bagaimana suatu molekul akan bersikap, bereaksi, dan berinteraksi dengan lingkungannya.
Secara mendasar, gugus donor adalah atom atau sekelompok atom yang memiliki pasangan elektron bebas yang rela ia sumbangkan untuk membentuk ikatan koordinasi. Ini berbeda dengan ikatan kovalen biasa di mana elektron berasal dari kedua pihak. Proses pendonoran ini sangat dipengaruhi oleh si atom donor sendiri—seperti nitrogen yang dermawan, oksigen yang selektif, atau sulfur yang lebih lunak—serta bentuk dan geometri rumah molekulnya.
Hibridisasi orbital, tolakan antar elektron, hingga pengaruh pelarut dan pH, semua berkolaborasi menentukan berapa banyak gugus donor yang benar-benar aktif dan siap bekerja dalam suatu struktur senyawa yang kompleks.
Menguraikan Prinsip Dasar Pasangan Elektron Bebas dan Atom Pusat
Dalam dunia kimia koordinasi, kemampuan suatu senyawa untuk berikatan dengan ion logam sering kali bergantung pada keberadaan pasangan elektron bebas. Pasangan elektron bebas ini, yang tidak terlibat dalam ikatan kovalen, bertindak sebagai semacam “modal” yang dapat dipinjamkan kepada atom atau ion lain yang kekurangan elektron. Proses peminjaman ini membentuk ikatan koordinasi, sebuah hubungan khusus di mana satu pihak mendonorkan kedua elektron sekaligus.
Pemahaman mendalam tentang sifat atom yang membawa pasangan elektron bebas ini sangat krusial untuk meramalkan dan merancang senyawa koordinasi dengan sifat yang diinginkan.
Atom pusat yang berperan sebagai donor elektron biasanya berasal dari golongan non-logam, khususnya unsur-unsur yang memiliki kerapatan elektron tinggi pada kulit valensinya. Ketersediaan pasangan elektron bebas ini tidaklah statis; ia sangat dipengaruhi oleh konteks kimiawi atom tersebut dalam molekul. Salah satu faktor penentu utama adalah hibridisasi orbital. Sebagai contoh, atom nitrogen dalam amonia (NH₃) mengalami hibridisasi sp³. Dari empat orbital hibrida ini, tiga digunakan untuk berikatan sigma dengan atom hidrogen, sementara satu orbital lagi ditempati oleh pasangan elektron bebas.
Hibridisasi sp³ ini memberikan geometri tetrahedral yang terdistorsi, dengan pasangan elektron bebas menempati salah satu sudutnya. Posisi pasangan elektron bebas yang menonjol ini membuatnya sangat mudah diakses dan reaktif untuk didonorkan.
Karakteristik Atom Donor Utama
Kemampuan dan kecenderungan atom yang berbeda untuk mendonorkan pasangan elektronnya bervariasi secara signifikan. Perbedaan ini dapat ditelusuri dari sifat-sifat intrinsik seperti keelektronegatifan dan ukuran atom. Kelektronegatifan yang tinggi cenderung menarik elektron lebih kuat, sehingga menyulitkan atom untuk melepaskan pasangan elektronnya. Sementara itu, atom yang lebih besar memiliki orbital valensi yang lebih terdelokalisasi, sering kali membuat pasangan elektronnya lebih mudah didonorkan karena tolakan inti atom yang lebih rendah.
| Atom Donor | Keelektronegatifan | Kerapatan Elektron & Ukuran | Kecenderungan Mendonor |
|---|---|---|---|
| Nitrogen (N) | Sedang (3.04) | Kerapatan tinggi, ukuran kecil hingga sedang. | Donor yang baik dan umum, pasangan elektron terarah dengan baik (mis., pada amina). |
| Oksigen (O) | Tinggi (3.44) | Kerapatan sangat tinggi, ukuran sangat kecil. | Donor kuat tetapi lebih selektif; elektron terikat kuat, lebih umum pada kondisi basa. |
| Sulfur (S) | Rendah (2.58) | Kerapatan lebih rendah, ukuran atom besar (orbital 3p). | Donor lunak (soft) yang sangat baik; pasangan elektron dalam orbital lebih besar dan mudah terpolarisasi. |
| Fosforus (P) | Rendah (2.19) | Kerapatan rendah, ukuran besar (orbital 3p). | Donor lunak yang kuat; kecenderungan mendonor sangat tinggi karena ukuran dan keelektronegatifan rendah. |
Visualisasi Pasangan Elektron Bebas pada Molekul Sederhana, Jumlah gugus donor pasangan elektron dalam struktur senyawa
Mari kita bayangkan struktur tiga molekul sederhana. Amonia (NH₃) digambarkan seperti sebuah piramida segitiga, dengan tiga atom H membentuk dasar dan atom N di puncak. Di puncak atom N tersebut, terdapat sebuah “awan” elektron yang padat yang menonjol keluar, itulah pasangan elektron bebasnya. Pada molekul air (H₂O), bentuknya menyerupai huruf V. Di titik sudut dimana atom O berada, terdapat dua awan elektron bebas yang menempati ruang, membuat sudut ikatan antar atom H menyempit akibat tolakan yang lebih besar dari pasangan elektron bebas.
Fosfin (PH₃) memiliki geometri piramidal yang mirip dengan amonia, tetapi pasangan elektron bebas pada atom P yang lebih besar terletak pada orbital 3p yang lebih terdelokalisasi dan kurang terarah secara kaku dibandingkan pada nitrogen.
Hibridisasi memainkan peran kunci dalam menentukan aksesibilitas pasangan elektron bebas. Orbital hibrida dengan karakter s yang lebih tinggi (seperti sp atau sp²) memiliki pasangan elektron yang lebih dekat ke inti atom dan lebih terarah secara kaku. Sebaliknya, orbital dengan karakter p yang lebih tinggi (seperti sp³ atau orbital p murni) memungkinkan pasangan elektron menempati ruang yang lebih luas dan lebih mudah terdelokalisasi.
Ini menjelaskan mengapa sulfur dalam tioeter (R₂S), dengan orbital 3p yang relatif murni, merupakan donor yang lebih lunak dan fleksibel dibandingkan oksigen dalam eter (R₂O).
Menelusuri Metode Penghitungan Gugus Donor dalam Molekul Organik Kompleks
Ketika molekul organik menjadi lebih kompleks, seperti pada ligan pengkelat atau makrosiklik, menghitung jumlah gugus donor potensial menjadi sebuah teka-teki yang menarik. Ini bukan sekadar menghitung semua atom nitrogen atau oksigen yang ada. Prosesnya memerlukan analisis mendalam terhadap struktur Lewis, pertimbangan sterik, dan pemahaman tentang bagaimana konformasi molekul mempengaruhi ketersediaan situs donor. Ligan seperti EDTA (asam etilendiaminatetraasetat) adalah contoh klasik di mana potensi donor maksimum teoretis tidak selalu sama dengan jumlah donor yang berfungsi secara efektif dalam suatu kompleks.
Prosedur sistematis dimulai dengan menggambar struktur Lewis yang akurat untuk seluruh molekul. Langkah ini penting untuk memetakan semua elektron valensi dan mengidentifikasi atom-atom yang memiliki pasangan elektron bebas. Selanjutnya, penentuan muatan formal pada setiap atom membantu mengklarifikasi status elektroniknya. Atom dengan muatan formal negatif sering kali merupakan kandidat donor yang sangat kuat. Setelah itu, kita melacak semua atom hetero (seperti N, O, S, P) dan mengevaluasi lingkungan kimianya.
Sebuah atom oksigen dalam gugus karbonil (C=O) memiliki pasangan elektron bebas, tetapi sifatnya berbeda dengan oksigen dalam gugus hidroksil (-OH) atau eter (-O-).
Langkah-Langkah Analisis Struktur Lewis
Untuk memastikan tidak ada gugus donor yang terlewat, berikut adalah langkah-langkah analitis yang dapat diikuti secara berurutan.
- Gambarkan kerangka molekul dan hubungkan semua atom dengan ikatan tunggal berdasarkan pengetahuan tentang valensi umum.
- Hitung total elektron valensi dari semua atom dalam molekul netral. Untuk ion, tambahkan atau kurangi elektron sesuai muatannya.
- Distribusikan elektron sisa sebagai pasangan elektron bebas untuk memenuhi aturan oktet (atau duplet untuk H) pada setiap atom.
- Periksa muatan formal setiap atom. Usahakan untuk struktur dengan muatan formal nol atau yang paling kecil, dan hindari pemisahan muatan yang besar jika memungkinkan.
- Identifikasi semua atom dengan pasangan elektron bebas. Prioritaskan atom nitrogen (dalam amina, nitro, dll.), oksigen (dalam hidroksil, eter, karbonil), sulfur (dalam tiol, tioeter), dan fosforus.
- Evaluasi kemungkinan delokalisasi elektron (resonansi) yang dapat mengubah kerapatan elektron pada suatu atom dan mempengaruhi potensi donornya.
Pengaruh Konformasi dan Kekakuan Struktur
Pada ligan makrosiklik seperti siklen atau porfirin, kekakuan cincin membatasi gerakan bebas gugus donor. Sebagai contoh, dalam molekul porfirin, empat atom nitrogen donor terkunci dalam sebuah bidang datar yang kaku. Konformasi ini sangat menguntungkan karena keempat donor dapat mengarah secara simultan ke pusat logam yang sama, memanfaatkan semua situs donor potensialnya. Sebaliknya, pada ligan rantai terbuka yang fleksibel seperti turunan EDTA tertentu, meskipun memiliki enam donor potensial (empat O karboksilat dan dua N amina), tidak semua dapat mengkoordinasi logam tunggal pada saat yang sama karena kendala sudut ikatan dan tolakan sterik.
Jumlah donor efektif sering kali lebih rendah, mungkin hanya empat atau lima, tergantung pada ukuran ion logam.
Aturan praktis membedakan gugus donor: Donor primer adalah atom yang pasangan elektron bebasnya langsung tersedia untuk koordinasi tanpa perlu perubahan struktural sebelumnya (contoh: nitrogen amina -NH₂, oksigen air H₂O). Donor sekunder memerlukan deprotonasi atau perubahan konformasi terlebih dahulu untuk menjadi donor yang efektif (contoh: oksigen dalam gugus karboksil -COOH yang harus menjadi -COO⁻, atau nitrogen dalam amida yang terlibat dalam resonansi dengan karbonil).
Memetakan Dampak Geometri Molekul terhadap Efisiensi Pendonoran Elektron
Bentuk suatu molekul bukan hanya estetika; ia adalah cetak biru yang menentukan bagaimana dan berapa banyak gugus donor dapat menjangkau pusat logam. Geometri molekul, yang dihasilkan dari tolakan antar pasangan elektron (baik ikatan maupun bebas), secara langsung mempengaruhi kapasitas koordinasi. Sebuah molekul dengan geometri tetrahedral yang kaku akan menyusun gugus donornya dengan sudut sekitar 109.5°, sebuah pengaturan yang mungkin ideal untuk mengelilingi logam dengan bilangan koordinasi empat.
Namun, jika molekul itu sendiri terlalu besar atau gugus donornya terlalu dekat satu sama lain, efisiensi pendonoran bisa terhambat oleh tolakan sterik antar ligan itu sendiri.
Hubungan antara bentuk dan fungsi ini sangat jelas dalam kimia kompleks logam transisi. Ambil contoh ligan bidentat seperti etilendiamin (en). Dua atom nitrogen donornya dipisahkan oleh rantai dua karbon, yang memaksa mereka untuk mengkoordinasi logam yang sama dari posisi yang berdekatan, membentuk cincin khelat yang stabil. Susunan spasialnya kontras dengan dua ligan monodentat independen seperti amonia, yang dapat mendekati logam dari arah mana pun yang diizinkan oleh geometri kompleks.
Efisiensi ligan bidentat lebih tinggi karena ia menggunakan dua donor sekaligus untuk mengikat satu logam, meningkatkan stabilitas kompleks secara signifikan dibandingkan jika menggunakan dua donor terpisah.
Kategori Senyawa Koordinasi Berdasarkan Bilangan Koordinasi
Source: slidesharecdn.com
Mengidentifikasi jumlah gugus donor pasangan elektron dalam struktur senyawa itu seperti memahami sifat dasar suatu ikatan. Nah, prinsip dasar dalam kimia ini punya kemiripan dengan menganalisis energi dalam sistem fisika, misalnya saat kita mengamati Energi Kinetik pada Simpangan 3 cm Benda 2 kg pada Pegas. Keduanya sama-sama bicara soal potensi dan perubahan. Jadi, setelah melihat energi kinetik pegas, wawasan kita kembali menguat untuk mendefinisikan gugus donor elektron dengan lebih tepat, karena keduanya adalah fondasi untuk memprediksi perilaku materi.
Bilangan koordinasi logam pusat sering kali menjadi faktor pembatas utama dalam memanfaatkan gugus donor dari ligan. Sebuah ligan yang memiliki enam situs donor potensial tidak akan berguna jika berikatan dengan logam yang hanya dapat mengkoordinasi empat ligan. Tabel berikut mengkategorikan beberapa geometri umum dan hubungannya dengan pemanfaatan gugus donor.
| Bilangan Koordinasi | Geometri Umum | Contoh Kompleks | Jumlah Gugus Donor Aktual yang Dapat Diakomodasi |
|---|---|---|---|
| 2 | Linear | [Ag(NH₃)₂]⁺ | Maksimal 2 donor (biasanya monodentat). |
| 4 | Tetrahedral / Square Planar | [NiCl₄]²⁻ (tetrahedral) / [Pt(NH₃)₄]²⁺ (planar) | Maksimal 4 donor. Ligan bidentat menghabiskan 2 situs, jadi bisa ada 2 ligan bidentat. |
| 6 | Oktahedral | [Co(NH₃)₆]³⁺ | Maksimal 6 donor. Dapat diisi oleh kombinasi ligan mono-, bi-, atau tridentat. |
| 8 | Dodecahedral / Square Antiprismatic | [Mo(CN)₈]⁴⁻ | Maksimal 8 donor, umum dari ligan kecil seperti CN⁻ atau dari ligan polidentat yang sangat besar. |
Analisis tolakan elektron menggunakan teori VSEPR memberikan wawasan mendalam. Pasangan elektron bebas menimbulkan tolakan yang lebih kuat daripada pasangan elektron ikatan. Akibatnya, keberadaan pasangan elektron bebas pada atom pusat ligan (seperti pada NH₃ atau H₂O) akan menyempitkan sudut ikatan di sekitarnya. Penyempitan ini, seperti sudut 107° pada NH₃ dibandingkan 109.5° tetrahedral sempurna, sebenarnya dapat menguntungkan karena memusatkan arah pendonoran. Namun, jika suatu molekul memiliki banyak pasangan elektron bebas yang saling berdekatan, tolakan antar mereka bisa mendistorsi geometri sedemikian rupa sehingga menggeser posisi gugus donor relatif satu sama lain, mengurangi kecocokannya dengan geometri koordinasi logam target.
Mengevaluasi Pengaruh Lingkungan Kimia terhadap Potensi Gugus Donor
Potensi suatu gugus donor bukanlah sifat yang mutlak dan tetap. Ia sangat rentan terhadap perubahan lingkungan kimia di sekitarnya. Sebuah atom nitrogen yang merupakan donor kuat dalam larutan basa mungkin menjadi sama sekali tidak reaktif dalam larutan asam. Demikian pula, pelarut yang berbeda dapat menyolvasi atau melindungi situs donor, mengubah kecenderungannya untuk berinteraksi dengan logam. Faktor-faktor eksternal seperti pH, sifat pelarut, dan keberadaan ion pesaing bertindak seperti saklar yang dapat mengaktivasi atau menonaktifkan gugus donor tertentu dalam struktur yang kompleks.
Pengaruh pH adalah yang paling dramatis. Gugus donor yang berasal dari asam konjugat lemah, seperti gugus karboksilat (-COO⁻) atau amina tersier (>N:), bersifat laten dalam kondisi asam. Pada pH rendah, gugus karboksil akan terprotonasi menjadi -COOH, di mana pasangan elektron bebas pada oksigen digunakan untuk berikatan dengan proton, sehingga tidak tersedia untuk logam. Amonia (NH₃) akan berubah menjadi ion amonium (NH₄⁺), yang tidak memiliki pasangan elektron bebas.
Sebaliknya, dalam kondisi basa, deprotonasi terjadi, mengungkap atau bahkan menciptakan situs donor baru. Asam sitrat adalah contoh bagus: dalam kondisi sangat asam, ia mungkin hanya bertindak sebagai donor melalui oksigen eter. Pada pH netral hingga basa, tiga gugus karboksilnya terdeprotonasi, menyediakan hingga enam situs donor potensial (dari dua oksigen setiap karboksilat).
Indikasi Spektroskopi Kesiapan Donor
Teknik spektroskopi dapat digunakan sebagai mata untuk mengintip kesiapan suatu gugus mendonorkan elektron. Dalam Spektroskopi Infra Merah (IR), pergeseran frekuensi regangan gugus fungsi dapat mengindikasikan perubahan kerapatan elektron. Sebagai contoh, frekuensi regangan C=O pada gugus karboksilat bebas (-COO⁻) berbeda dengan yang terkoordinasi ke logam; koordinasi biasanya menyebabkan pergeseran dan pemisahan pita karena simetri yang berubah. Dalam Spektroskopi NMR, pergeseran kimia proton atau karbon yang terikat pada atom donor (seperti proton pada -OH atau -NH₂) sangat sensitif terhadap lingkungan.
Deprotonasi atau koordinasi ke logam akan menyebabkan pergeseran kimia yang signifikan, menandakan bahwa pasangan elektron bebas sekarang terlibat dalam ikatan.
Strategi Modifikasi Kimia pada Situs Donor
Kimiawan sering memodifikasi struktur ligan untuk secara sengaja mengatur jumlah dan kekuatan situs donornya. Tujuannya bisa untuk meningkatkan selektivitas terhadap logam tertentu atau mengontrol sifat katalitik kompleks yang dihasilkan.
- Alkilasi atau Asilasi: Menambahkan gugus alkil atau asil pada atom donor seperti nitrogen (membentuk amina tersier atau amida) dapat secara permanen mengurangi atau menghilangkan kemampuannya mendonor, karena pasangan elektron bisa terdelokalisasi atau terhalang sterik.
- Pengenalan Gugus Penarik Elektron (EWG): Menempelkan gugus seperti nitro atau trifluorometil (-CF₃) dekat atom donor akan menarik kerapatan elektron menjauh dari situs donor, melemahkan kekuatan donornya.
- Pengenalan Gugus Penderma Elektron (EDG): Sebaliknya, gugus seperti metoksi (-OCH₃) atau amina dapat meningkatkan kerapatan elektron pada atom donor tetangga, memperkuat kemampuannya sebagai donor.
- Pembentukan Makrosiklik atau Sangkar: Menyusun banyak donor dalam sebuah cincin kaku, seperti pada koronand atau kriptand, tidak hanya meningkatkan jumlah donor tetapi juga pra-mengaturnya dalam geometri yang ideal untuk mengapit logam, meningkatkan afinitas dan selektivitas secara drastis.
Merancang Kerangka Konseptual untuk Prediksi Kapasitas Donor Senyawa Anorganik: Jumlah Gugus Donor Pasangan Elektron Dalam Struktur Senyawa
Memprediksi jumlah gugus donor dalam senyawa anorganik yang lebih eksotis, seperti polimer koordinasi atau kluster logam, memerlukan pendekatan yang lebih holistik. Di sini, kita tidak lagi hanya melihat molekul tunggal, tetapi jaringan yang saling terhubung dimana satu atom dapat bertindak sebagai donor untuk beberapa logam sekaligus (bridging ligand). Kerangka logis harus mempertimbangkan konsep seperti dentisitas, mode pengikatan (μ₁, μ₂, μ₃ untuk menunjukkan berapa banyak logam yang diikat), dan sifat dari kerangka logam itu sendiri.
Konfigurasi elektron logam pusat, terutama pada senyawa kluster, menentukan berapa banyak ikatan logam-logam yang terbentuk, yang pada gilirannya mempengaruhi jumlah situs koordinasi yang tersisa untuk ligan donor eksternal.
Sebuah pendekatan yang berguna adalah dengan menganalisis dari tingkat unit pembangun. Identifikasi semua ligan dan klasifikasikan berdasarkan atom donor dan dentisitas potensialnya. Kemudian, pertimbangkan stoikiometri logam-to-ligan. Rasio yang tinggi sering menunjukkan bahwa ligan bertindak sebagai jembatan. Selanjutnya, terapkan teori medan ligan untuk memperkirakan preferensi geometri logam dalam keadaan oksidasi tertentu.
Misalnya, logam d⁸ seperti Ni(II) atau Pt(II) cenderung planar kuadrat, yang hanya menyisakan empat situs koordinasi di bidang tersebut, sementara logam d⁶ seperti Co(III) sangat menyukai geometri oktahedral yang menyediakan enam situs.
Pola Pendonoran pada Senyawa Karbonil dan Hidrida Logam
Perbandingan antara dua kelas senyawa organologam yang umum, karbonil dan hidrida, mengungkapkan perbedaan mendasar dalam sifat donor ligan mereka. Karbonil (CO) adalah ligan yang unik karena dapat mendonorkan elektron melalui karbon (σ-donor) dan juga menerima densitas elektron balik ke orbital π* antibonding-nya (π-akseptor). Sementara itu, hidrida (H⁻) adalah donor σ yang kuat dan hampir murni.
| Jenis Senyawa | Sifat Donor Utama | Jumlah Donor per Ligan | Pengaruh pada Logam |
|---|---|---|---|
| Karbonil Logam (e.g., Fe(CO)₅) | σ-donor dan π-akseptor (ligan bidang) | 1 (monodentat melalui C), tetapi dapat bridging (μ₂-CO). | Mengurangi kerapatan elektron pada logam, menstabilkan keadaan oksidasi rendah. |
| Hidrida Logam (e.g., [ReH₉]²⁻) | σ-donor kuat (ligan bidang) | 1 (monodentat), sering bridging (μ₂-H atau μ₃-H) dalam kluster. | Meningkatkan kerapatan elektron pada logam, sering ditemukan pada logam dengan keadaan oksidasi tinggi atau netral. |
Teori medan ligan memberikan penjelasan elegan untuk variasi kekuatan donor dalam deret homolog. Dalam deret ligan halida untuk logam transisi yang sama, kekuatan donor meningkat seiring penurunan keelektronegatifan: I⁻ > Br⁻ > Cl⁻ > F⁻. Ligan bidang yang kuat seperti CO atau CN⁻ menyebabkan pemisahan medan kristal (Δ) yang besar, yang mempengaruhi energi stabilisasi medan kristal dan preferensi geometri. Dalam sebuah deret kompleks oktahedral dengan ligan yang semakin kuat, kecenderungan untuk mengadopsi bilangan koordinasi yang lebih rendah (seperti planar kuadrat) dapat meningkat, yang secara efektif mengurangi jumlah ligan yang dapat diikat.
Prinsip umum menghubungkan konfigurasi elektron logam dengan kapasitas donor: Logam dengan konfigurasi elektron d yang lebih terisi (seperti d¹⁰: Zn²⁺, Cd²⁺, Hg²⁺) tidak memiliki preferensi geometri yang kuat dari efek medan kristal dan cenderung mengakomodasi bilangan koordinasi dan geometri yang ditentukan oleh ukuran dan kecenderungan donor ligan. Sebaliknya, logam dengan konfigurasi d⁴ hingga d⁷ memiliki preferensi geometri yang kuat (oktahedral vs. tetrahedral vs. planar kuadrat) yang membatasi jumlah dan susunan ligan donor yang dapat terikat secara stabil.
Gambaran deskriptif untuk kluster logam, misalnya [Os₅(CO)₁₆], akan menunjukkan bahwa molekul ini bukan sekadar kumpulan ligan yang melekat pada satu logam. Beberapa molekul CO menjembatani dua atom Os (μ₂), bertindak sebagai donor untuk dua logam sekaligus. Atom Os itu sendiri juga saling terikat langsung (ikatan logam-logam), yang merupakan bentuk lain dari berbagi elektron. Dalam konteks ini, menghitung “gugus donor” berarti memahami jaringan interkoneksi yang kompleks ini, di mana satu atom oksigen dari CO yang bridging dihitung sebagai satu unit donor, tetapi kontribusinya melayani dua pusat logam.
Ringkasan Penutup
Jadi, menelusuri jumlah gugus donor pasangan elektron dalam struktur senyawa itu seperti membuka peta harta karun reaktivitas kimia. Dari molekul organik sederhana seperti amonia hingga polimer koordinasi yang super kompleks, kemampuan mendonorkan elektron ini adalah jiwanya. Dengan kerangka konseptual yang tepat—mempertimbangkan geometri, lingkungan kimia, dan sifat atom pusat—kita bukan cuma bisa menghitung, tapi juga memprediksi dan bahkan merekayasa kapasitas donor suatu senyawa.
Pada akhirnya, memahami bahasa bisu pasangan elektron bebas ini membuka pintu untuk menciptakan material dengan sifat yang kita inginkan, membuktikan bahwa dalam dunia yang kecil sekalipun, detail seperti jumlah “tangan” yang terulur bisa mengubah segalanya.
Pertanyaan dan Jawaban
Apakah semua atom yang memiliki pasangan elektron bebas pasti menjadi gugus donor?
Tidak selalu. Keberadaan pasangan elektron bebas adalah prasyarat, tetapi kemampuan mendonorkannya bergantung pada faktor lain seperti keelektronegatifan, hibridisasi, dan lingkungan sterik (kerumitan ruang di sekitarnya) yang mungkin menghalangi pendekatan atom akseptor.
Bagaimana pH mempengaruhi jumlah gugus donor yang aktif?
pH sangat krusial. Pada kondisi asam yang tinggi, gugus donor seperti amina (-NH2) dapat terprotonasi menjadi -NH3+ yang kehilangan pasangan elektron bebanya, sehingga “non-aktif”. Sebaliknya, dalam kondisi basa, gugus tersebut akan kembali bebas dan siap mendonor.
Apakah bilangan koordinasi logam selalu sama dengan jumlah gugus donor?
Tidak sama. Bilangan koordinasi merujuk pada jumlah ikatan koordinasi yang terbentuk pada logam pusat. Satu ligan yang multidentat (seperti EDTA) memiliki beberapa gugus donor dalam satu molekul, sehingga bisa memenuhi bilangan koordinasi yang tinggi hanya dengan satu atau beberapa ligan.
Dapatkah jumlah gugus donor efektif dalam suatu senyawa berubah?
Bisa sekali. Perubahan konformasi (bentuk ruang) molekul, pergantian pelarut, atau adanya ion pesaing dapat mengaktifkan gugus donor yang sebelumnya tersembunyi atau menonaktifkan gugus donor yang sebelumnya mudah diakses.
Bagaimana cara membedakan kekuatan donor antara dua gugus yang sama jenis atomnya?
Kekuatan donor dipengaruhi oleh hal-hal di sekitar atom tersebut. Misalnya, gugus -OH yang terikat pada rantai karbon yang menarik elektron akan menjadi donor yang lebih lemah dibanding -OH yang terikat pada gugus yang mendorong elektron. Analisis spektroskopi seperti NMR dapat mengungkap perbedaan kerapatan elektron ini.