Jumlah gugus donor pasangan elektron dalam struktur senyawa itu ibarat daftar tamu istimewa di pesta molekul, yang kehadirannya bakal mengubah seluruh tata ruang dan suasana. Kalau kita bicara kimia, konsep ini nggak cuma sekadar hitung-hitungan teoritis, tapi benar-benar kunci untuk memahami dari bentuk suatu molekul yang bengkok sampai ke kecanggihan material di gadget kita. Dari reaksi katalisis yang rumit hingga cahaya pada layar LED, semuanya berawal dari bagaimana pasangan elektron yang ‘sendiri’ ini memutuskan untuk berbagi.
Pada dasarnya, gugus donor ini merujuk pada pasangan elektron bebas atau tidak terikat yang dimiliki oleh suatu atom, yang siap disumbangkan untuk membentuk ikatan koordinasi atau memengaruhi geometri ruang di sekitarnya. Keberadaannya menciptakan tolakan tambahan yang bisa menyimpangkan sudut ikatan dari bentuk ideal, seperti yang terjadi pada molekul air atau amonia. Lebih jauh lagi, dalam dunia kompleks logam, ligan-ligan dengan kemampuan donor yang berbeda—mulai dari yang sederhana seperti amonia hingga yang kompleks seperti EDTA—menentukan kestabilan dan sifat suatu senyawa koordinasi.
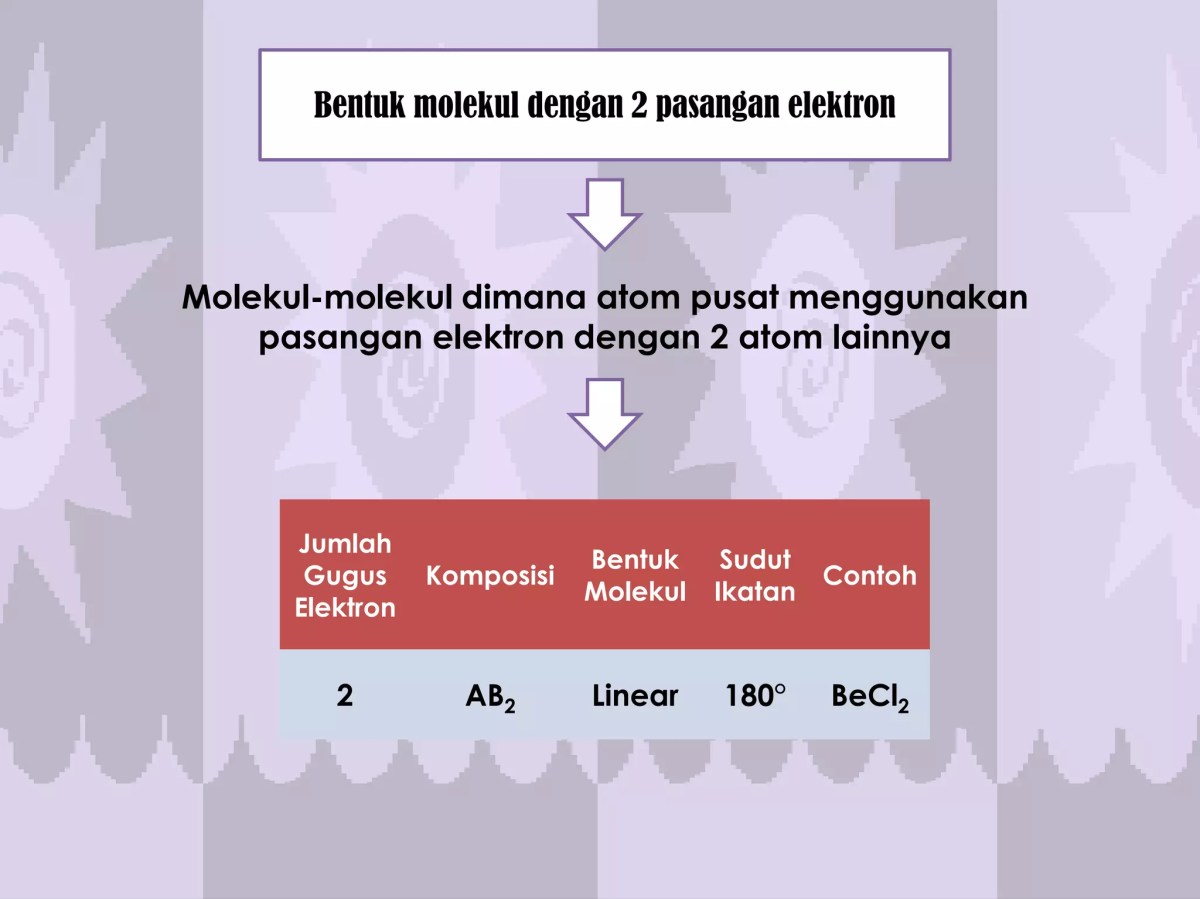
Peta Konseptual Pasangan Elektron Sunyi dan Geometri Molekul
Dalam dunia kimia, bentuk suatu molekul tidak sekadar gambar dua dimensi yang statis; ia adalah cerita tiga dimensi yang ditulis oleh gaya tolakan antar elektron. Di sini, pasangan elektron bebas atau “sunyi” pada atom pusat memainkan peran sebagai penulis skenario yang ulung, seringkali mengubah alur cerita dari yang ideal menjadi bentuk yang nyata dan sedikit bengkok. Memahami peta konsep ini adalah kunci untuk memprediksi bagaimana suatu molekul akan berinteraksi dengan dunia di sekitarnya.
Teori VSEPR (Valence Shell Electron Pair Repulsion) memberikan fondasi yang elegan: setiap domain elektron—baik itu ikatan tunggal, rangkap, maupun pasangan elektron bebas—akan saling tolak-menolak untuk meminimalkan energi. Namun, daya tolak ini tidak setara. Pasangan elektron bebas, yang hanya terikat pada satu inti atom, menempati wilayah ruang yang lebih luas dan memiliki kerapatan elektron yang lebih tinggi dibandingkan pasangan elektron ikatan yang ditarik oleh dua inti.
Akibatnya, urutan kekuatan tolakan adalah: Bebas-Bebas > Bebas-Ikatan > Ikatan-Ikatan. Keberadaan pasangan bebas ini secara kausal memaksa pasangan elektron ikatan untuk saling mendekat. Bayangkan sebuah molekul dengan empat domain elektron yang idealnya akan membentuk tetrahedral sempurna dengan sudut 109.5°. Jika satu domain adalah pasangan bebas, seperti pada amonia (NH3), maka tolakan kuat dari pasangan bebas itu akan mendorong tiga ikatan N-H lebih berdekatan satu sama lain.
Hasilnya, sudut ikatan H-N-H menyempit dari 109.5° menjadi sekitar 107°, membentuk geometri piramida trigonal. Efek ini semakin dramatis pada air (H2O) yang memiliki dua pasangan bebas, menyempitkan sudut H-O-H menjadi sekitar 104.5° dan menghasilkan bentuk bengkok atau “V”. Analisis tolakan yang dimodifikasi ini menjelaskan mengapa bentuk “nyata” molekul hanya didasarkan pada posisi atom-atomnya (geometri molekul), sementara bentuk “teoritis” mencakup semua domain elektron (geometri elektron).
Perbandingan Geometri Teoritis dan Nyata pada Beberapa Senyawa
Tabel berikut mengilustrasikan bagaimana jumlah pasangan elektron ikatan dan bebas memengaruhi bentuk geometri akhir beberapa molekul, termasuk yang melibatkan orbital d seperti SF4 dan ClF3.
| Senyawa | PE Ikatan | PE Bebas | Geometri Teoritis (Domain) | Geometri Nyata & Sudut Ikatan |
|---|---|---|---|---|
| NH3 | 3 | 1 | Tetrahedral | Piramida Trigonal (~107°) |
| H2O | 2 | 2 | Tetrahedral | Bengkok atau V (~104.5°) |
| SF4 | 4 | 1 | Bipiramida Trigonal | See-Saw (2 aksial ~173°, 2 ekuatorial ~102°) |
| ClF3 | 3 | 2 | Bipiramida Trigonal | Bentuk T (~87.5° antar ligan ekuatorial) |
Prosedur Prediksi Gugus Donor dengan Teori VSEPR
Untuk memprediksi keberadaan dan pengaruh gugus donor pasangan elektron bebas secara sistematis, kita dapat mengikuti langkah-langkah berdasarkan teori VSEPR. Pertama, gambarlah struktur Lewis dari molekul yang ditinjau, pastikan jumlah elektron valensi sudah benar dan oktet (atau oktet diperluas untuk periode 3 ke bawah) terpenuhi. Kedua, hitung jumlah total domain elektron di sekitar atom pusat. Satu domain bisa berupa ikatan tunggal, rangkap dua, rangkap tiga, atau satu pasangan elektron bebas.
Ketiga, tentukan geometri elektron berdasarkan jumlah domain ini—misalnya, dua domain linear, tiga domain trigonal planar, empat domain tetrahedral, dan seterusnya. Keempat, identifikasi domain mana yang merupakan pasangan elektron bebas (gugus donor potensial) dan mana yang merupakan ikatan. Terakhir, turunkan geometri molekul dengan hanya mempertimbangkan posisi atom-atom yang terikat, di mana pasangan elektron bebas akan menyebabkan penyimpangan sudut dari bentuk geometri elektron yang ideal.
Pengaruh Pasangan Sunyi terhadap Konsep Hibridisasi
Konsep hibridisasi, yang menjelaskan pencampuran orbital untuk membentuk orbital baru dengan bentuk dan energi yang sesuai, juga sangat dipengaruhi oleh kehadiran pasangan elektron sunyi. Pasangan bebas ini menempati salah satu orbital hibrida, sehingga secara langsung menentukan jenis hibridisasi atom pusat.
Sebagai contoh, atom belerang dalam SF4 memiliki lima domain elektron (empat ikatan dan satu bebas). Untuk mengakomodasi ini, orbital valensi belerang (3s dan 3p) “mempromosikan” satu elektron ke orbital 3d dan mengalami hibridisasi sp 3d, menghasilkan satu set orbital bipiramida trigonal. Pasangan elektron bebas tersebut kemudian akan menempati salah satu posisi ekuatorial dalam geometri elektron karena tolakan bebas-bebas yang minimal, yang pada akhirnya menghasilkan bentuk molekul see-saw.
Dengan demikian, pasangan sunyi bukan hanya penumpang pasif, tetapi merupakan donor yang menentukan konfigurasi orbital atom inangnya.
Dinamika Pasangan Elektron Donor dalam Kompleks Koordinasi
Melangkah dari molekul sederhana ke dunia kompleks kompleks koordinasi, pasangan elektron donor menemukan panggung yang lebih luas. Di sini, mereka bertindak sebagai jembatan antara ligan, molekul atau ion yang kaya elektron, dengan logam transisi yang lapar elektron. Dinamika donasi ini tidak hanya menentukan bagaimana kompleks terbentuk, tetapi juga warna, kestabilan, dan reaktivitasnya, menari di atas panggung teori medan kristal.
Mekanisme donasi elektron berpusat pada orbital logam yang kosong, khususnya orbital-orbital dengan energi yang sesuai seperti orbital d, s, dan p. Ligan monodentat seperti amonia (NH 3) atau ion klorida (Cl –) menyumbangkan satu pasangan elektronnya dari atom donor (N atau Cl) ke dalam satu orbital kosong pada logam, membentuk ikatan koordinasi atau datif. Ligan polidentat, seperti etilendiamin (en) yang bidentat atau EDTA yang heksadentat, menyumbangkan beberapa pasangan elektron dari beberapa atom donor sekaligus ke logam yang sama, membentuk struktur cincin yang disebut kelat.
Efek kelat ini secara dramatis meningkatkan kestabilan kompleks karena prinsip entropi—pelepasan banyak molekul ligan monodentat yang setara membutuhkan gangguan yang lebih besar terhadap sistem. Dalam teori medan kristal, jumlah dan sifat donor ligan menentukan besar pemisahan medan kristal (Δ). Ligan donor kuat seperti CN – menyebabkan splitting orbital d yang besar, menempatkan elektron pada orbital d tingkat rendah (t 2g) dan seringkali menghasilkan kompleks berwarna dan stabil (spin rendah).
Sebaliknya, ligan donor lemah seperti I – menghasilkan Δ kecil, memungkinkan populasi elektron pada orbital d tingkat tinggi (e g) dan cenderung membentuk kompleks spin tinggi. Dengan demikian, setiap pasangan elektron yang disumbangkan adalah sebuah langkah dalam koreografi yang rumit yang menentukan sifat magnetik dan optik material.
Klasifikasi Ligan Berdasarkan Jumlah Gugus Donor, Jumlah gugus donor pasangan elektron dalam struktur senyawa
Berikut adalah pengelompokan ligan berdasarkan kemampuan mendonorkan pasangan elektronnya, yang secara langsung memengaruhi bilangan koordinasi dan geometri kompleks.
| Jenis Ligan | Jumlah Donor | Contoh Ligan | Contoh Kompleks (Bilangan Koordinasi) |
|---|---|---|---|
| Unidentat (Monodentat) | 1 | H2O, NH3, Cl–, CO | [Co(NH3)6]3+ (BK=6) |
| Bidentat | 2 | Etilendiamin (en), Oksalat (ox) | [Co(en)3]3+ (BK=6) |
| Polidentat (Multidentat) | ≥3 | Dietilen triamin (dien), EDTA4- | [Fe(EDTA)]2- (BK=6) |
| Ligan Jembatan | 1 per atom logam | OH–, Cl– | [(NH3)5Cr-OH-Cr(NH3)5]5+ |
Perbedaan Ligan Netral dan Bermuatan
Sumber pasangan elektron donor—apakah dari ligan netral atau bermuatan—memiliki implikasi langsung pada kimia kompleks. Ligan netral seperti NH 3 atau H 2O menyumbangkan pasangan elektron tanpa mengubah muatan formal logam pusat. Muatan kompleks hasilnya hanya bergantung pada muatan ion logam awalnya. Sebaliknya, ligan bermuatan seperti Cl – atau CN – tidak hanya menyumbangkan pasangan elektron, tetapi juga membawa serta muatan negatifnya ke dalam sphere koordinasi.
Muatan ini secara langsung berkontribusi pada muatan keseluruhan kompleks. Misalnya, ion Co 3+ yang mengikat enam ligan NH 3 netral akan membentuk kompleks kation [Co(NH 3) 6] 3+. Namun, jika mengikat enam ligan Cl –, akan terbentuk kompleks anion [CoCl 6] 3-. Perbedaan muatan ini memengaruhi kelarutan, stabilitas elektrostatik, dan jalur reaksi substitusi ligan.
Dalam kimia koordinasi, memahami jumlah gugus donor pasangan elektron dalam struktur senyawa itu krusial banget, lho. Ini menentukan sifat dan reaktivitas kompleks logam. Nah, supaya analisis seperti ini bisa dipahami dengan baik, seorang peneliti perlu menyajikan pembahasan yang runtut. Di sinilah pentingnya menguasai Materi yang Harus Disajikan Peneliti dalam Pembahasan dan Analisis Hasil Penelitian. Dengan struktur pembahasan yang tepat, interpretasi terhadap jumlah gugus donor dan pengaruhnya terhadap geometri molekul bisa dijelaskan secara lebih komprehensif dan meyakinkan.
Identifikasi Total Gugus Donor dalam Kompleks Polinuklir
Kompleks polinuklir, yang mengandung lebih dari satu atom logam, sering melibatkan ligan jembatan yang mendonorkan elektron ke lebih dari satu logam. Untuk mengidentifikasi total gugus donor dalam sistem yang rumit ini, diperlukan pendekatan sistematis.
- Identifikasi setiap atom logam pusat secara terpisah dalam struktur.
- Analisis setiap ligan yang terikat pada setiap logam. Tentukan apakah ligan tersebut terminal (hanya terikat pada satu logam) atau jembatan (terikat pada dua atau lebih logam).
- Untuk ligan terminal, hitung kontribusi pasangan elektron donor seperti biasa (misalnya, NH 3 = 1 donor ke satu logam).
- Untuk ligan jembatan, satu atom donor (misalnya atom O dalam OH –) dapat menyumbangkan satu pasangan elektron ke setiap logam yang dihubungkannya. Jadi, satu ligan jembatan μ 2-OH dapat dihitung sebagai menyumbang satu gugus donor untuk masing-masing dari dua logam.
- Jumlahkan semua kontribusi donor ke setiap logam untuk mendapatkan lingkungan koordinasi individual, dan jumlahkan secara keseluruhan untuk memahami kepadatan elektron total dalam kompleks.
Interferensi Pasangan Elektron Inert dan Efek Stereokimia
Ventura kimia tidak hanya milik logam transisi. Unsur-unsur blok-p, khususnya golongan 13 dan 14, memamerkan drama elektronik yang unik dengan pasangan elektron “inert” mereka. Pasangan ini seringkali tidak terlibat dalam ikatan, namun kehadirannya mendikte stereokimia dan membuka pintu bagi sifat donor yang tak terduga, terutama dalam senyawa organologam dan metaloid.
Fenomena yang menarik terjadi pada unsur-unsur seperti boron (golongan 13) dan timah (golongan 14). Boron dalam senyawa seperti BF 3 kekurangan elektron—hanya memiliki enam elektron di kulit valensinya. Kekosongan orbital p-nya yang rendah energi membuatnya menjadi asam Lewis yang kuat, siap menerima pasangan elektron donor dari basa Lewis seperti amonia, membentuk aduk H 3N→BF 3. Di sisi lain, unsur golongan 14 seperti timah(II) memiliki pasangan elektron valensi yang tidak terikat—pasangan stereoaktif.
Pasangan ini menolak pasangan elektron ikatan, menyebabkan distorsi geometri yang signifikan. Misalnya, SnCl 2 berbentuk bengkok dengan sudut ikatan kurang dari 120°, bukannya trigonal planar seperti yang diharapkan untuk tiga domain elektron. Pasangan stereoaktif ini sendiri dapat bertindak sebagai donor, meskipun lemah, dalam ikatan koordinasi sekunder atau interaksi non-ikatan. Dalam kimia organologam, peran pasangan elektron bebas pada metaloid seperti fosfor dalam ligan fosfin (PR 3) sangat krusial.
Pasangan elektron pada fosfor tersier inilah yang didonorkan ke logam transisi, dan sifat elektronik (donor/keterimaannya) dari gugus R akan memodifikasi kekuatan ikatan logam-fosfor, yang pada akhirnya memengaruhi aktivitas katalitik kompleks tersebut.
Contoh Senyawa Organologam dan Konfigurasi Elektronnya
Tabel berikut menunjukkan variasi peran pasangan elektron bebas pada beberapa senyawa organologam dan metaloid.
| Senyawa/Unsur Pusat | Jumlah PE Bebas | Jenis Orbital yang Terlibat | Geometri yang Dihasilkan |
|---|---|---|---|
| B dalam BF3 | 0 (Kekurangan elektron) | orbital p kosong (akseptor) | Trigonal Planar |
| Sn dalam SnCl2 | 1 (Stereoaktif) | Orbital hibrida dengan karakter s tinggi | Bengkok (~95°) |
| P dalam PPh3 (sebagai ligan) | 1 | Orbital sp3 hibrida | Piramida Trigonal (pada P) |
| Si dalam SiCl4 | 0 | orbital sp3 hibrida (semua untuk ikatan) | Tetrahedral |
Pengaruh Pasangan Elektron pada Fosfin sebagai Ligan
Pasangan elektron bebas pada atom fosfor dalam ligan fosfin tersier (seperti PPh 3 atau PMe 3) adalah jantung dari fungsinya dalam katalisis. Pasangan ini terletak pada orbital hibrida sp 3 dengan karakter s yang cukup tinggi, membuatnya sangat terarah dan “keras”. Saat mendonorkan elektron ke logam, sifat orbital ini memengaruhi sudut ikatan M-P-R. Gaya tolakan antara pasangan ikatan M–P dan tiga ikatan P–R yang besar menyebabkan sudut ikatan C–P–C melebar hingga lebih dari 100°, melebihi sudut tetrahedral ideal.
Kereaktifannya sebagai donor dimodifikasi oleh substituen R. Gugus alkil seperti -CH 3 bersifat mendonorkan elektron, meningkatkan kerapatan elektron pada P, menjadikan fosfin tersebut sebagai donor yang lebih kuat. Sebaliknya, gugus aromatik atau yang menarik elektron seperti -C 6F 5 mengurangi kerapatan elektron, membuat fosfin menjadi donor yang lebih lemah tetapi mungkin penerima π (acceptor) yang lebih baik melalui orbital d kosong pada P.
Keseimbangan sifat donor-akseptor inilah yang dapat disetel untuk mengoptimalkan kompleks logam untuk reaksi katalitik tertentu, seperti hidrogenasi atau reaksi kopling.
Konsep Pasangan Stereoaktif
Pasangan stereoaktif merujuk pada pasangan elektron valensi yang tidak terikat pada atom pusat, yang menempati volume ruang yang signifikan dan secara aktif berpartisipasi dalam tolakan elektron menurut teori VSEPR. Keberadaannya tidak “inert” atau diam; ia memaksa perubahan geometri. Pada senyawa seperti amina (R3N) atau sulfida (R 2S), pasangan bebas ini menempati salah satu sudut dari geometri tetrahedral elektron, sehingga mendorong tiga atau dua ikatan menjadi lebih berdekatan. Hasilnya adalah geometri molekul piramida trigonal untuk amina dan bengkok untuk sulfida. Karakter orbital pasangan ini (biasanya dengan kontribusi s yang tinggi) membuatnya lebih terpusat pada inti atom dibandingkan pasangan elektron ikatan, sehingga tolakannya terhadap pasangan ikatan menjadi sangat efektif dalam menentukan sudut dan bentuk molekul.
Peran Gugus Donor dalam Sifat Optoelektronik Material
Dari skala molekul, kita zoom out ke skala material, di mana pasangan elektron donor berperan sebagai insinyur yang mendesain sifat cahaya dan listrik. Dalam material semikonduktor seperti quantum dot, perovskit hibrida organik-anorganik, atau bahkan pewarna organik, keberadaan dan distribusi pasangan donor ini dapat menggeser warna cahaya yang diserap atau dipancarkan, serta menentukan efisiensi perangkat seperti LED atau sel surya.
Korelasi antara kerapatan pasangan elektron donor dan sifat optoelektronik berakar dalam struktur pita energi material. Dalam semikonduktor murni (intrinsik), pita valensi (penuh elektron) dan pita konduksi (kosong) dipisahkan oleh celah pita (band gap). Pasangan elektron donor, baik dari atom pengotor (doping) atau dari gugus fungsional permukaan, memperkenalkan tingkat energi baru yang terletak tepat di bawah pita konduksi. Elektron-elektron pada tingkat donor ini dapat dengan mudah tereksitasi ke pita konduksi, meningkatkan konsentrasi pembawa muatan negatif (elektron) dan menciptakan semikonduktor tipe-n.
Pada material seperti quantum dot (titik kuantum) timbal sulfida (PbS), gugus donor seperti ligan oleat yang terikat pada permukaan tidak hanya menstabilkan partikel tetapi juga menyumbangkan elektron, memodifikasi profil pita energi dan menggeser serapan cahaya ke panjang gelombang yang lebih panjang (efek red-shift). Pada perovskit seperti CH 3NH 3PbI 3, kation organik (CH 3NH 3+) tidak secara langsung mendonorkan elektron, tetapi interaksi dan polarisasinya memengaruhi struktur pita material induk.
Namun, cacat titik seperti vakansi iodida (kekurangan iodin) dapat bertindak sebagai pusat donor yang tidak diinginkan, menciptakan perangkap rekombinasi yang justru mengurangi efisiensi emisi cahaya. Oleh karena itu, rekayasa gugus donor adalah seni menyeimbangkan antara menyediakan elektron bebas yang berguna dan menghindari cacat yang merusak.
Jenis Cacat Kristal yang Berperan sebagai Donor
Berbagai ketidaksempurnaan dalam kisi kristal dapat menjadi sumber pasangan elektron donor yang memengaruhi konduktivitas listrik material.
- Pengotor Substitusional Donor: Atom dengan elektron valensi lebih banyak menggantikan atom host. Contoh klasik adalah atom fosfor (5 elektron valensi) menggantikan atom silikon (4 elektron valensi) dalam kristal Si. Elektron kelebihan dari P menjadi donor, menghasilkan Si tipe-n.
- Vakansi Anion: Ketiadaan anion (ion bermuatan negatif) dalam kisi. Misalnya, vakansi oksigen dalam seng oksida (ZnO). Setiap vakansi meninggalkan dua elektron yang sebelumnya dipakai untuk berikatan, yang dapat dilepaskan dengan relatif mudah, meningkatkan konduktivitas tipe-n.
- Atom Interstisi: Atom yang menempati celah (interstisi) dalam kisi, seringkali atom logam. Contohnya adalah atom seng interstisi pada ZnO. Atom Zn ekstra ini dapat dengan mudah melepaskan elektron, bertindak sebagai donor yang potensial.
- Gugus Permukaan atau Ligan: Pada material nano, molekul yang terikat pada permukaan seperti amina (-NH 2) atau tiol (-SH) dapat menyumbangkan elektron ke pita konduksi partikel, secara signifikan menggeser sifat optiknya.
Pemetaan Orbital Molekul dari Ligan Donor
Untuk memahami secara teoretis bagaimana ligan donor memengaruhi celah pita suatu kompleks, kita dapat memetakan kontribusinya ke dalam diagram orbital molekul (MO). Prosedurnya dimulai dengan mengidentifikasi orbital molekul ligan yang terisi elektron, terutama orbital simetri tinggi yang cocok untuk tumpang tindih dengan orbital logam. Orbital-orbital ini, seringkali orbital σ atau π yang terisi, akan berinteraksi dengan orbital logam yang simetri cocok (seperti d z², s, atau p).
Dalam diagram MO yang dihasilkan, orbital ligan donor ini akan muncul sebagai orbital molekul yang terisi energi rendah, yang sebagian besar memiliki karakter ligan. Pengaruhnya terhadap celah pita (Δ, atau HOMO-LUMO gap pada sistem molekuler) bergantung pada seberapa kuat interaksi dan seberapa dekat energinya dengan orbital d logam. Ligan donor σ yang kuat akan menaikkan energi orbital molekul yang terisi (mendekati HOMO), yang dapat mempengaruhi potensial ionisasi dan stabilitas oksidasi.
Sumbangan dari orbital π ligan (seperti pada fosfin atau klorida) dapat lebih kompleks, karena dapat terjadi donasi σ dan penerimaan π balik, yang secara bersamaan memengaruhi tingkat energi terisi dan kosong.
Ilustrasi Efek Gugus Amino pada Pewarna Organik
Bayangkan sebuah molekul pewarna organik berbasis antrakuinon, yang secara intrinsik menyerap cahaya biru sehingga tampak kuning-orange. Sekarang, kita memasang sebuah gugus amino (-NH 2) ke dalam sistem terkonjugasi aromatik pewarna tersebut. Atom nitrogen dalam gugus amino memiliki pasangan elektron bebas yang dapat beresonansi dengan orbital π cincin aromatik. Pasangan elektron donor ini “didorong” ke dalam sistem π terkonjugasi yang lebih luas, meningkatkan kerapatan elektron π secara keseluruhan.
Peningkatan kerapatan elektron ini menaikkan energi orbital molekul tertinggi yang terisi (HOMO), sementara orbital terendah yang kosong (LUMO) relatif tidak terpengaruh atau sedikit turun karena efek penarik elektron dari nitrogen yang terprotonasi secara parsial. Akibatnya, celah energi antara HOMO dan LUMO menyempit. Untuk mengeksitasi sebuah elektron dari HOMO yang kini lebih tinggi ke LUMO, diperlukan energi foton yang lebih rendah.
Ini berarti molekul sekarang akan menyerap foton dengan panjang gelombang yang lebih panjang (lebih ke arah merah). Jika sebelumnya menyerap biru, dengan gugus donor amino, ia mungkin menyerap hijau atau bahkan kuning, sehingga warna yang kita lihat bergeser ke merah atau ungu. Inilah yang disebut efek bathokromik, dan merupakan alat mendasar dalam mendesain pewarna untuk aplikasi spesifik.
Simulasi Komputasi untuk Memvisualisasikan Kepadatan Elektron Donor: Jumlah Gugus Donor Pasangan Elektron Dalam Struktur Senyawa
Bagaimana kita bisa “melihat” wilayah kaya elektron yang siap mendonorkan pasangannya? Di sinilah simulasi komputasi modern, khususnya Teori Fungsi Kerapatan (Density Functional Theory – DFT), menjadi mata super kita. DFT memungkinkan kita untuk mengkuantifikasi yang abstrak—menghitung nilai numerik untuk muatan parsial, memetakan permukaan kerapatan elektron, dan menggambar peta potensial elektrostatik berwarna yang secara intuitif menunjukkan di mana pasangan elektron bebas bersembunyi dan seberapa kuat mereka ingin didonorkan.
Pendekatan DFT pada dasarnya memecahkan persamaan untuk menemukan kerapatan elektron ground-state suatu sistem. Dari informasi fundamental ini, berbagai properti dapat diturunkan. Untuk mengidentifikasi gugus donor, kita sering melihat dua hasil utama: peta kerapatan elektron (electron density map) dan peta potensial elektrostatik (Electrostatic Potential Surface – ESP). Peta kerapatan elektron menunjukkan distribusi spasial semua elektron. Daerah dengan kerapatan tinggi, seperti di sekitar inti atom atau di antara dua atom yang berikatan, tampak padat.
Pasangan elektron bebas muncul sebagai “tonjolan” atau awan kerapatan tinggi yang terlokalisasi pada atom donor (misalnya, di belakang atom nitrogen dalam NH 3). Yang lebih informatif adalah plot ESP, di mana permukaan kerapatan elektron konstan diwarnai berdasarkan potensial elektrostatik pada titik tersebut. Warna merah menandakan wilayah dengan potensial positif (kekurangan elektron, akseptor potensial), biru menandakan wilayah negatif (kaya elektron, donor potensial), dan hijau netral.
Pada molekul seperti air atau amonia, kita akan melihat lobus biru yang jelas di lokasi pasangan elektron bebas, memberikan visualisasi langsung tentang situs donor. Nilai energi orbital HOMO (Highest Occupied Molecular Orbital) dari perhitungan DFT juga menjadi indikator kuantitatif yang bagus: HOMO yang lebih tinggi energinya menandakan elektron yang lebih mudah dilepaskan, sehingga molekul tersebut merupakan donor yang lebih kuat.
Hasil Simulasi DFT untuk Beberapa Molekul Donor
Tabel berikut membandingkan beberapa properti kunci yang diperoleh dari simulasi komputasi untuk molekul-molekul sederhana, mengungkap kecenderungan mereka sebagai donor elektron.
| Molekul | Muatan Parsial pada Atom Donor (mis. N, O) | Energi Orbital HOMO (eV) | Luas Wilayah Potensial Negatif (ESP) | Reaktivitas Prediktif terhadap Elektrofil |
|---|---|---|---|---|
| NH3 | ≈ -0.8 hingga -1.0 (pada N) | Tinggi (≈ -5 hingga -6 eV) | Luas, lobus biru jelas di atas N | Tinggi, situs donor kuat dan terarah. |
| H2O | ≈ -0.7 hingga -0.9 (pada O) | Sedang (≈ -7 eV) | Dua lobus biru di daerah pasangan bebas O. | Sedang, donor yang baik tetapi sudutnya lebih terbatas. |
| CH4 | ≈ -0.2 hingga -0.4 (pada H, bukan donor biasa) | Sangat Rendah (≈ -10 eV atau lebih) | Hijau/merah, tidak ada wilayah biru yang signifikan. | Sangat rendah, bukan donor elektron yang efektif. |
| C6H 6 (Benzena) | Ring sedikit negatif, tetapi donor utama adalah awan π. | Sedang (≈ -6 hingga -7 eV) | Permukaan π di atas dan bawah cincin menunjukkan wilayah negatif yang difus. | Donor π lembut, reaktif terhadap elektrofil yang mencari awan π. |
Interpretasi Peta Kepadatan Elektron dan Potensial Elektrostatik
Source: slidesharecdn.com
Membaca plot komputasi membutuhkan pemahaman tentang apa yang diwakili oleh setiap fitur. Pada peta kerapatan elektron, kontur atau permukaan iso-nilai yang tinggi menunjukkan di mana kemungkinan besar menemukan elektron. Pasangan elektron ikatan muncul sebagai “jembatan” kerapatan tinggi yang menghubungkan dua inti atom.
Pasangan elektron bebas muncul sebagai daerah kerapatan tinggi yang terlokalisasi kuat pada satu atom, biasanya menjorok keluar dari atom tersebut ke arah yang tidak terhalang. Awan π, seperti pada ikatan rangkap atau cincin aromatik, muncul sebagai “sandwich” kerapatan di atas dan di bawah bidang ikatan. Plot ESP yang dihasilkan dari kerapatan ini memberikan informasi tentang reaktivitas. Sebuah lobus biru yang dalam dan terlokalisasi menunjukkan situs donor nukleofilik yang kuat dan terarah (seperti pada N dalam NH 3).
Warna biru yang lebih difus dan menyebar, seperti di atas cincin benzena, menunjukkan donor yang lebih lembut dan kurang terarah. Dengan membandingkan kedua plot, kita dapat dengan jelas membedakan: pasangan bebas memberikan lobus biru yang tajam pada ESP di lokasi tonjolan kerapatan, sementara awan π memberikan wilayah biru yang lebih luas dan datar.
Pelacakan Dinamika Pasangan Donor dengan Simulasi
Simulasi dinamika molekul, yang menghitung pergerakan atom dan molekul seiring waktu berdasarkan hukum fisika, dapat melacak bagaimana kerapatan pasangan elektron donor berfluktuasi selama suatu reaksi. Dalam sebuah simulasi reaksi antara sebuah nukleofil (donor) dan elektrofil, kita dapat mengamati parameter seperti muatan parsial pada atom donor atau nilai kerapatan elektron di wilayah kunci sebagai fungsi waktu. Saat nukleofil mendekati elektrofil, pasangan elektron bebas mungkin mulai terpolarisasi atau bahkan “mengalir” sedikit menuju elektrofil sebelum ikatan benar-benar terbentuk. Fluktuasi termal dapat menyebabkan momen-momen di mana kerapatan elektron pada donor secara lokal menjadi lebih tinggi, meningkatkan kemungkinan serangan. Dengan menganalisis ratusan atau ribuan “frame” dari simulasi dinamika, kita mendapatkan gambaran statistik yang kaya tentang tidak hanya struktur statis, tetapi juga lintasan dan fleksibilitas pasangan elektron donor dalam lingkungan yang dinamis dan larutan, sesuatu yang sulit diamati secara eksperimen.
Penutupan Akhir
Jadi, setelah menyelami berbagai aspeknya, menjadi jelas bahwa menghitung dan memahami jumlah gugus donor pasangan elektron jauh lebih dari sekadar latihan akademis. Ini adalah bahasa dasar yang digunakan molekul untuk bercerita tentang bentuk, reaktivitas, dan kemampuannya yang luar biasa. Dari simulasi komputasi yang canggih hingga penerapan dalam material mutakhir, prinsip ini terus menjadi fondasi yang menghubungkan teori di papan tulis dengan inovasi di dunia nyata.
Dengan menguasai konsep ini, pintu untuk mengeksplorasi dan mendesain senyawa dengan sifat yang kita inginkan pun terbuka lebar.
FAQ Umum
Apakah pasangan elektron dalam ikatan rangkap bisa disebut sebagai gugus donor?
Ya, bisa. Elektron-elektron dalam ikatan pi (π) dari ikatan rangkap dua atau tiga, seperti pada alkena atau karbon monoksida (CO), sering kali dapat menyumbangkan kerapatan elektronnya ke orbital kosong logam, bertindak sebagai ligan pendonor π. Ini berbeda dengan donor pasangan elektron bebas dari orbital hibrida.
Bagaimana cara membedakan “gugus donor” dengan “gugus penarik elektron” hanya dari struktur Lewis?
Secara umum, atom dengan keelektronegatifan rendah (seperti N, P, S, O yang memiliki pasangan bebas) cenderung menjadi donor karena mudah mendonasikan elektronnya. Sebaliknya, atom atau gugus dengan keelektronegatifan tinggi atau yang terikat pada banyak atom elektronegatif (seperti -NO2, -CF3) cenderung menarik kerapatan elektron menjauhi inti, bersifat penarik (akseptor).
Mengapa dalam teori VSEPR, pasangan elektron bebas menimbulkan tolakan yang lebih besar daripada pasangan elektron ikatan?
Pasangan elektron bebas hanya “dimiliki” oleh atom pusat, sehingga awan elektronnya lebih terkonsentrasi dan menempati lebih banyak ruang di sekitar inti atom. Sementara pasangan elektron ikatan tertarik oleh dua inti atom, sehingga awannya lebih tertarik ke arah luar dan memakan ruang yang sedikit lebih kecil.
Apakah jumlah gugus donor selalu sama dengan jumlah pasangan elektron bebas dalam struktur Lewis?
Tidak selalu. Satu atom bisa memiliki lebih dari satu pasangan elektron bebas, tetapi tidak semuanya harus aktif sebagai donor dalam suatu konteks. Faktor seperti sterik (hambatan ruang), hibridisasi, dan lingkungan kimia dapat memengaruhi apakah suatu pasangan bebas benar-benar tersedia dan reaktif untuk didonasikan.
Bagaimana pengaruh pelarut terhadap kekuatan suatu gugus donor?
Pelarut yang sangat polar atau yang dapat membentuk ikatan hidrogen kuat (seperti air) dapat berinteraksi dengan dan “menyelubungi” pasangan elektron bebas pada donor, sehingga mengurangi ketersediaan dan nukleofilisitasnya. Dalam pelarut nonpolar, kemampuan donor biasanya lebih terlihat jelas.


