Jumlah partikel dalam mol O2 (g) itu bukan sekadar angka di buku teks, lho. Bayangkan, satu genggam gas oksigen yang biasa kita hirup itu ternyata dipenuhi oleh sekitar 602 miliar triliun molekul O2. Angka fantastis yang dikenal sebagai bilangan Avogadro ini adalah jembatan rahasia yang menghubungkan dunia yang bisa kita lihat dan rasakan dengan drama mikroskopis partikel-partikel tak kasat mata.
Konsep ini membuka pintu untuk memahami segala hal, mulai dari bagaimana tubuh kita menghasilkan energi hingga bagaimana lapisan pelindung pada pesawat luar angkasa terbentuk.
Melalui lensa mol, kita bisa menyelami filosofi kesatuan dalam keragaman, di mana kumpulan partikel yang sangat besar bertindak sebagai satu kesatuan sifat yang dapat kita ukur. Topik ini akan mengajak kita berkelana dari pemikiran filsuf Yunani kuno tentang atom, menyusuri proses rumit respirasi sel di dalam tubuh, menganalisis rekayasa material di industri, mengamati kesehatan ekosistem perairan, hingga merancang sistem pendukung kehidupan di lingkungan paling ekstrem sekalipun.
Semuanya berawal dari pertanyaan mendasar: berapa banyak sih, sebenarnya?
Mengurai Hubungan Filosofis antara Konsep Mol Oksigen dan Keberadaan Partikel Dasar di Alam Semesta
Angka 6.022 x 10^23, yang kita kenal sebagai bilangan Avogadro, sering kali terasa sebagai angka yang dingin dan matematis belaka. Namun, di balik notasi ilmiahnya, tersembunyi sebuah jembatan filosofis yang luar biasa. Jembatan ini menghubungkan apa yang bisa kita timbang, lihat, dan rasakan—seperti segenggam gas oksigen—dengan realitas tak kasatmata yang terdiri dari triliunan partikel individual. Konsep mol dan bilangan Avogadro pada dasarnya adalah alat bagi pikiran manusia untuk memahami kesatuan dalam kejamakan yang tak terbayangkan.
Ketika kita mengatakan satu mol gas oksigen (O2), kita sedang membicarakan sekitar 32 gram zat. Jumlah yang ringan dan mudah dikelola di laboratorium. Namun, dalam jumlah yang terukur itu, terkandung sekitar 602.200.000.000.000.000.000.000 molekul O
2. Setiap molekul itu adalah entitas mandiri, bergerak bebas, bertumbukan, dan hidup dalam dunianya sendiri. Bilangan Avogadro memaksa kita untuk menerima bahwa realitas makroskopik yang stabil—tekanan gas dalam ban, udara yang kita hirup—adalah hasil statistik yang elegan dari chaos mikroskopik yang tak terhitung jumlahnya.
Implikasi filosofisnya mendalam: kesatuan yang kita amati di dunia sering kali adalah ilusi yang indah, dibangun dari bagian-bagian diskrit yang jumlahnya luar biasa besar. Dari satu kesatuan (satu mol) muncul keragaman (miliaran miliar molekul), dan dari keragaman yang teratur itu lahirlah kembali sebuah kesatuan dengan sifat baru yang dapat diprediksi.
Konsep Kesatuan dalam Berbagai Skala Realitas
Idea tentang “satu” yang terdiri dari “banyak” merupakan tema universal yang berulang dalam berbagai disiplin ilmu. Tabel berikut membandingkan manifestasi konsep ini, menunjukkan bagaimana pola yang mirip muncul dari filsafat hingga fisika partikel.
| Skala | Entitas “Kesatuan” | Penyusun Dasar | Prinsip yang Menyatukan |
|---|---|---|---|
| Filsafat | Alam Semesta (Kosmos) | Atom-atom (menurut Democritus) | Hukum Logika dan Sebab-Akibat |
| Biologi | Organisme Hidup (Manusia) | ±37.2 Triliun Sel | Koordinasi Genetik dan Sinyal Biokimia |
| Kimia (Mol O2) | 1 Mol Gas Oksigen (32 g) | 6.022 x 10^23 Molekul O2 | Bilangan Avogadro dan Hukum Gas Ideal |
| Fisika Partikel | Proton | 3 Quark (2 up, 1 down) | Gaya Kuat (Interaksi Kuat) |
Pemikiran Historis tentang Entitas Tak Terlihat
Perjuangan untuk memahami dunia yang tak terlihat telah menghantui para pemikir selama berabad-abad. Konsep mol modern berutang budi pada intuisi brilian dari para perintis ini.
“Tidak ada yang ada selain atom-atom dan ruang hampa; segala hal lain hanyalah pendapat.” – Democritus (sekitar 460–370 SM). Meskipun konsep atomnya masih spekulatif, ia menangkap esensi bahwa realitas materi bersifat diskrit.
Mempelajari jumlah partikel dalam mol O₂ (g) itu seru, lho! Kita hitung atom-atomnya yang banyak banget, mirip kayak ngitung sisa material setelah pengerjaan. Nah, soal hitung-hitungan praktis kayak Sisa Panjang Bambu Setelah Dipotong 155 cm dan 1,2 m itu melatih logika yang sama: presisi dan konversi satuan. Kembali ke O₂, dengan bilangan Avogadro, kita bisa tahu betapa luar biasanya jumlah molekul gas dalam satu mol itu.
“Volume gas yang sama, pada tekanan dan suhu yang sama, mengandung jumlah molekul yang sama.” – Hipotesis Amedeo Avogadro (1811). Pernyataan sederhana ini, yang akhirnya mengarah pada penentuan bilangan konstan, adalah kunci yang menghubungkan dunia makro (volume) dengan dunia mikro (jumlah molekul).
Jaringan Partikel yang Melebihi Butiran Pasir
Untuk benar-benar menghargai skala yang diwakili oleh satu mol, mari kita lakukan perhitungan sederhana dan bandingkan dengan sesuatu yang familiar: pasir di pantai. Ambil contoh Pantai Kuta di Bali, yang memiliki panjang sekitar 5 kilometer dan lebar rata-rata 50 meter. Jika kita asumsikan kedalaman pasir yang diambil adalah 1 meter, volume total pasirnya kira-kira 250.000 meter kubik. Dengan perkiraan kasar bahwa satu butir pasir memiliki volume sekitar 1 milimeter kubik, maka jumlah butiran pasir di seluruh volume tersebut adalah sekitar 250.000 x 10^9 (karena 1 m³ = 10^9 mm³) = 2.5 x 10^14 butir.
Itu adalah 250 triliun butir pasir, angka yang sudah sangat besar.
Sekarang, bandingkan dengan satu mol molekul oksigen: 6.022 x 10^
23. Untuk mengetahui berapa kali jumlah molekul O2 lebih banyak daripada butiran pasir di Pantai Kuta, kita bagi: (6.022 x 10^23) / (2.5 x 10^14) = sekitar 2.4 x 10^9. Hasilnya, satu mol molekul oksigen jumlahnya kira-kira 2.4 miliar kali lebih banyak daripada jumlah butiran pasir di seluruh Pantai Kuta yang digali sedalam satu meter.
Bayangkan setiap butir pasir di pantai sebesar itu mewakili satu “kelompok” yang berisi 2.4 miliar molekul. Atau, sebaliknya, untuk setiap molekul O2 dalam satu mol, Anda perlu mencari butiran pasir yang setara di lebih dari dua miliar pantai sebesar Kuta. Perhitungan ini bukan sekadar permainan angka, tetapi sebuah ilustrasi yang mengejutkan tentang betapa padatnya jaringan partikel yang membentuk realitas materi yang kita anggap biasa saja.
Udara di sekitar kita, yang terasa kosong, sebenarnya adalah lautan partikel yang saling terhubung dengan kerapatan yang tak terpahami.
Simfoni Partikel Oksigen dalam Respirasi Seluler dan Dampak Kuantitatifnya pada Metabolisme
Setiap tarikan napas kita adalah undangan bagi miliaran molekul oksigen untuk masuk ke dalam sebuah pabrik energi mikroskopis. Proses respirasi seluler adalah simfoni biokimia yang terencana, di mana O2 berperan sebagai akseptor elektron final. Memahami proses ini dalam kerangka mol dan jumlah molekul mengungkap efisiensi dan skala menakjubkan dari mesin kehidupan. Konversi energi kimia dalam glukosa menjadi ATP, mata uang energi sel, sangat bergantung pada pasokan partikel O2 yang tepat waktu dan dalam jumlah yang memadai.
Dalam mitokondria, molekul O2 yang kita hirup tidak langsung “terbakar”. Ia menunggu di akhir rantai transpor elektron, sebuah serangkaian kompleks protein yang mirip stasiun pompa. Di sini, elektron berenergi tinggi dari hasil pemecahan glukosa (melalui glikolisis dan siklus Krebs) dialirkan. Setiap molekul O2 menerima empat elektron dan empat ion H+ untuk akhirnya membentuk dua molekul air (H2O). Reaksi redoks besar inilah yang menggerakkan pompa proton, menciptakan gradien yang memicu sintesis ATP.
Satu molekul glukosa, secara teoretis, dapat menghasilkan hingga sekitar 30-32 ATP, dengan konsumsi 6 molekul O2. Artinya, setiap molekul O2 yang dikonsumsi membantu menghasilkan sekitar 5 molekul ATP, sebuah pertukaran energi yang sangat efisien.
Kuantitas Oksigen dan Hasil Energi dalam Tahap Metabolisme
Untuk melihat kontribusi kuantitatif O2, mari kita telusuri perjalanan satu molekul glukosa. Perlu diingat, angka ATP dapat bervariasi tergantung sel dan kondisi, tetapi berikut adalah perkiraan umum yang menggambarkan skalanya.
| Tahap Metabolisme | Molekul O2 yang Dikonsumsi (per glukosa) | Molekul ATP yang Dihasilkan (per glukosa) | Analogi Skala Sehari-hari |
|---|---|---|---|
| Glikolisis (sitoplasma) | 0 | 2 (bersih) + pembawa elektron | Modal awal, seperti menyiapkan bahan baku di gudang. |
| Siklus Krebs (matriks mitokondria) | 0 | 2 (langsung) + banyak pembawa elektron | Proses perakitan yang menghasilkan banyak kupon energi (elektron). |
| Rantai Transpor Elektron & Fosforilasi Oksidatif (membran dalam mitokondria) | 6 | ~26-28 | Pembangkit listrik utama. O2 adalah “pembeli” akhir yang menutup deal, memungkinkan produksi ATP masal. |
Perjalanan Satu Rombongan Partikel O2 dari Paru-paru ke Mitokondria
Bayangkan sekelompok molekul O2, katakanlah beberapa miliar dari mereka, yang merupakan bagian dari satu tarikan napas. Mereka meluncur melalui bronkiolus dan akhirnya mendarat di alveolus, sebuah gelembung kecil yang dilingkupi pembuluh kapiler rambut. Dinding alveolus dan kapiler begitu tipis, hanya setebal satu sel. Di sini, karena perbedaan tekanan parsial, setiap molekul O2 berdifusi melintasi membran, meninggalkan fase gas dan larut ke dalam plasma darah, lalu langsung dijemput oleh hemoglobin dalam sel darah merah.
Molekul O2 menempel pada atom besi di inti heme hemoglobin, seperti penumpang yang naik ke taksi khusus.
Taksi hemoglobin ini lalu mengalir dalam arus darah, menuju sel-sel yang membutuhkan, misalnya sel otot yang sedang aktif. Di dekat sel otot, kondisi menjadi sedikit asam dan hangat akibat metabolisme, menyebabkan hemoglobin melepaskan penumpang O2-nya. Molekul O2 yang bebas kemudian berdifusi melalui membran sel, masuk ke sitoplasma, dan akhirnya memasuki mitokondria. Di dalam mitokondria, ia berenang menuju membran dalam, tempat kompleks IV (sitokrom c oksidase) berada.
Di situlah tempat peristirahatan terakhirnya. Ia menunggu, hingga empat elektron dan empat proton datang, lalu dalam sekejap, ia bertransformasi menjadi bagian dari dua molekul air, menyelesaikan misinya sebagai penerima elektron dan sekaligus mengaktifkan produksi ATP.
Estimasi Kebutuhan Oksigen Harian Manusia
Berapa mol sebenarnya O2 yang kita butuhkan sehari? Mari buat perhitungan teoretis sederhana berdasarkan tingkat metabolisme basal dan aktivitas. Asumsi pertama: manusia dewasa dengan berat 70 kg memiliki tingkat metabolisme basal (BMR) sekitar 1700 kkal per hari. Setiap liter O2 yang dikonsumsi menghasilkan sekitar 5 kkal energi (nilai kalorik). Jadi, kebutuhan O2 minimal hanya untuk bertahan hidup adalah 1700 kkal / 5 kkal/L = 340 liter O2 per hari pada kondisi STP (Standard Temperature and Pressure).
Sekarang, konversi volume ke mol. Menggunakan hukum gas ideal, pada STP (0°C, 1 atm), 1 mol gas menempati 22.4 L. Jadi, 340 L / (22.4 L/mol) ≈ 15.2 mol O2 per hari hanya untuk BMR. Namun, ini di kondisi STP. Pada suhu tubuh (37°C) dan tekanan atmosfer, volume molar lebih besar, sekitar 25.4 L/mol.
Maka perhitungannya menjadi 340 L / (25.4 L/mol) ≈ 13.4 mol. Angka ini adalah kebutuhan dasar tanpa aktivitas.
Aktivitas fisik meningkatkan konsumsi secara dramatis. Saat berlari, konsumsi O2 bisa mencapai 15-20 kali lipat dari kondisi istirahat. Jika seseorang aktif (olahraga 1 jam, aktivitas ringan sepanjang hari), total konsumsi O2 harian bisa mencapai 600-800 liter. Menggunakan volume molar pada kondisi tubuh, 700 L / 25.4 L/mol ≈ 27.6 mol O2. Itu berarti, dalam sehari, tubuh kita memproses sekitar 27.6 mol x (6.022 x 10^23 molekul/mol) ≈ 1.66 x 10^25 molekul O2.
Sebuah angka yang luar biasa besar, menunjukkan betapa sibuknya triliunan mitokondria di dalam tubuh kita setiap saat, semua bergantung pada aliran partikel O2 yang tak putus-putusnya dari udara.
Rekayasa Material Berbasis Rasio Mol Oksigen pada Proses Oksidasi dan Pembentukan Lapisan Pelindung
Oksidasi sering diasosiasikan dengan kerusakan, seperti karat pada besi. Namun, dengan mengontrol jumlah dan kondisi reaksi, kita dapat merekayasa oksidasi menjadi proses yang sangat bermanfaat. Di sinilah konsep mol dan stoikiometri memainkan peran krusial. Dalam rekayasa material, kita tidak lagi bertanya “apakah oksigen bereaksi?”, tetapi “berapa banyak partikel oksigen yang dibutuhkan per satuan luas permukaan, dan pada kondisi bagaimana, untuk menciptakan lapisan oksida dengan sifat yang diinginkan?”.
Proses seperti anodisasi pada aluminium adalah contoh sempurna. Di sini, aluminium bertindak sebagai anoda dalam larutan elektrolit. Listrik dialirkan untuk secara sengaja menarik ion oksigen (dari air) ke permukaan logam. Ion-ion ini bereaksi dengan atom Al, membentuk aluminium oksida (Al2O3). Stoikiometri reaksi 4Al + 3O2 → 2Al2O3 memberi tahu kita rasio molar yang tepat: setiap 4 mol Al, dibutuhkan 3 mol O2.
Dengan mengontrol jumlah muatan listrik (yang sebanding dengan jumlah ion yang bereaksi), suhu, dan komposisi elektrolit, kita dapat mengatur ketebalan, porositas, dan kristalinitas lapisan oksida. Lapisan ini keras, tahan korosi, dan dapat diwarnai, mengubah logam yang relatif lunak menjadi material dengan permukaan yang sangat tangguh.
Aplikasi Oksidasi Terkontrol pada Berbagai Logam
Prinsip mengendalikan jumlah partikel O2 untuk membentuk lapisan pelindung diterapkan pada berbagai logam. Setiap logam menghasilkan senyawa oksida dengan karakteristik unik, yang menentukan aplikasi akhirnya.
| Logam Dasar | Rasio Mol O2 (Perkiraan dalam Proses) | Senyawa Oksida yang Dibentuk | Sifat Fungsional Lapisan |
|---|---|---|---|
| Aluminium (Anodisasi) | 3 mol O2 per 4 mol Al | Al2O3 (alumina) | Sangat keras, tahan aus & korosi, isolator listrik, dapat diwarnai. |
| Titanium (Oksidasi Anodik) | 1 mol O2 per 1 mol Ti (untuk TiO2) | TiO2 (titanium dioksida) | Biokompatibel, tahan korosi kuat, menunjukkan efek warna interferensi. |
| Besi (Pembuatan Biru/Browning) | Reaksi terkontrol dengan uap/oksidan | Fe3O4 (magnetit) atau Fe2O3 | Lapisan dekoratif yang mengurangi refleksi, memberikan ketahanan karat ringan. |
| Tembaga (Pembuatan Patina) | Reaksi lambat dengan atmosfer | Cu2O (kuprit), lalu CuCO3·Cu(OH)2 (malakit/azurit) | Lapisan dekoratif berwarna hijau/biru yang melindungi logam di bawahnya dari korosi lebih lanjut. |
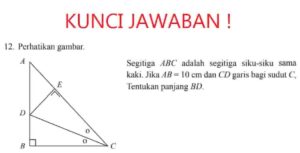
Faktor yang Mempengaruhi Jumlah Partikel O2 yang Berikatan Efektif, Jumlah partikel dalam mol O2 (g)
Keberhasilan membentuk lapisan oksida yang merata dan fungsional bergantung pada beberapa faktor kunci yang mengontrol ketersediaan dan reaktivitas partikel O2 atau prekursornya di permukaan logam.
- Potensial Listrik (Voltage/Current Density): Dalam proses elektrokimia seperti anodisasi, potensial listrik menentukan energi yang mendorong ion oksigen menuju permukaan. Potensial yang lebih tinggi umumnya dapat menarik lebih banyak ion, mempercepat reaksi dan mempengaruhi struktur lapisan.
- Komposisi dan Suhu Elektrolit: Jenis asam atau basa dalam larutan mempengaruhi kelarutan oksida yang terbentuk dan laju transportasi ion. Suhu mempengaruhi mobilitas ion dan laju reaksi; suhu rendah cenderung menghasilkan lapisan yang lebih keras dan padat.
- Waktu Proses: Durasi penerapan potensial atau paparan terhadap lingkungan oksidatif berbanding lurus dengan ketebalan lapisan hingga titik tertentu, karena lapisan yang sudah terbentuk dapat menghambat difusi partikel O2 lebih lanjut.
- Pre-treatment Permukaan: Kebersihan dan tekstur permukaan logam sebelum proses sangat penting. Permukaan yang bebas minyak, kotoran, dan oksida alamiah memastikan kontak yang seragam antara logam dan sumber O2, sehingga reaksi terjadi secara homogen.
Eksperimen Pemikiran: Menyaksikan Tumbuhnya Lapisan Oksida Molekul demi Molekul
Bayangkan kita memiliki mikroskop super yang mampu memperbesar hingga tingkat atom, dan kita mengamati sepetak kecil permukaan aluminium murni yang sedang dianodisasi. Awalnya, kita hanya melihat kisi logam yang teratur. Begitu arus dinyalakan, dari lautan elektrolit di sekitarnya, ion-ion bermuatan negatif yang mengandung oksigen (seperti OH-) mulai tertarik dan bergerak menuju permukaan positif (anoda). Mereka seperti peselancar yang mengendarai gelombang medan listrik.
Saat ion pertama menyentuh atom aluminium di permukaan, terjadi reaksi. Atom aluminium melepaskan tiga elektronnya, berubah menjadi ion Al3+. Ion oksigen yang datang segera mengikatnya. Satu ikatan terbentuk. Kemudian datang ion oksigen berikutnya, dan berikutnya.
Secara bertahap, sebuah pola kristal kecil aluminium oksida mulai terbentuk, menutupi area itu. Proses ini berlangsung simultan di miliaran titik di seluruh permukaan. Kita dapat melihat lapisan tumbuh vertikal ke atas dari permukaan logam, seperti hutan mikroskopis yang sangat rapat. Setiap beberapa detik, lapisan bertambah tinggi beberapa nanometer, karena lapisan demi lapisan molekul Al2O3 baru tertata. Yang menakjubkan, proses ini bukannya merusak, justru membangun benteng pelindung dari dalam logam itu sendiri, dikontrol secara presisi oleh aliran partikel O2 yang kita arahkan.
Dinamika Kuantitas Oksigen Terlarut dalam Akuatik dan Pengaruh Molekuler terhadap Ekosistem
Kehidupan di perairan, dari ikan yang berenang hingga bakteri di sedimen, bergantung pada pasokan partikel oksigen yang larut dalam air. Berbeda dengan udara, oksigen di air hadir dalam konsentrasi yang jauh lebih rendah dan fluktuatif. Konsentrasi ini, sering diukur dalam miligram per liter atau parts per million (ppm), secara langsung dapat dikonversi menjadi satuan mol per liter, menghubungkan pengukuran lapangan dengan dunia molekuler.
Fluktuasi kecil dalam jumlah mol O2 per liter air dapat menjadi pembeda antara ekosistem yang berkembang dan zona mati.
Mekanisme utama masuknya partikel O2 ke dalam air adalah melalui transfer gas di permukaan, yaitu difusi dari atmosfer (terutama ketika air bergolak oleh angin atau arus) dan hasil fotosintesis oleh fitoplankton dan tumbuhan air. Setiap molekul O2 yang terlarut adalah entitas individual yang bertabrakan dengan molekul air. Ikan dan organisme akuatik lainnya bergantung pada difusi partikel-partikel ini dari air ke dalam pembuluh darah insang atau permukaan tubuh mereka.
Jika konsentrasinya turun di bawah tingkat kritis (biasanya di bawah 3-4 mg/L untuk banyak spesies), hewan-hewan akan mengalami stres, berhenti berkembang biak, atau bahkan mati. Dengan demikian, jumlah absolut partikel O2 dalam suatu badan air berfungsi sebagai penopang kapasitas hidup bagi seluruh jaring-jaring makanan di dalamnya.
Parameter yang Mempengaruhi Kelarutan Partikel Oksigen dalam Air

Source: slidesharecdn.com
Jumlah partikel O2 yang dapat ditampung oleh air bukanlah nilai tetap. Ia dipengaruhi oleh beberapa faktor fisik dan kimia yang saling terkait, yang menentukan “daya tampung” molekuler suatu perairan.
| Parameter | Pengaruh terhadap Kelarutan O2 | Alasan Molekuler/Kinetik | Contoh Pengaruh Kuantitatif |
|---|---|---|---|
| Suhu | Berbanding terbalik. Semakin tinggi suhu, kelarutan menurun. | Energi kinetik molekul O2 meningkat, sehingga lebih mudah lepas dari fase cair ke gas. | Air pada 0°C dapat melarutkan ~14.6 mg/L O2, sedangkan pada 30°C hanya ~7.6 mg/L. |
| Salinitas | Berbanding terbalik. Semakin asin, kelarutan menurun. | Ion-ion garam “mengganggu” dan bersaing dengan molekul O2 untuk ruang antar molekul air (efek pengusir, atau “salting-out”). | Air laut (salinitas 35 ppt) melarutkan O2 sekitar 20% lebih sedikit daripada air tawar pada suhu yang sama. |
| Tekanan Atmosfer | Berbanding lurus. Semakin tinggi tekanan, kelarutan meningkat. | Hukum Henry: konsentrasi gas terlarut sebanding dengan tekanan parsialnya di atas cairan. | Di dataran tinggi (tekanan rendah), kelarutan O2 alami lebih rendah daripada di permukaan laut. |
| Aktivitas Biologis | Menyebabkan fluktuasi dinamis (produksi & konsumsi). | Fotosintesis menambah partikel O2, respirasi dan dekomposisi mengkonsumsinya. | Di danau, kadar O2 bisa maksimum di sore hari (fotosintesis) dan minimum sebelum fajar (respirasi malam). |
Konversi Data Oksigen Terlarut ke Jumlah Molekul
Misalkan kita memiliki data dari sebuah danau kecil yang relatif sehat, dengan konsentrasi Oksigen Terlarut (DO) sebesar 8.0 mg/L pada siang hari. Langkah pertama, konversi mg/L ke mol/L. Massa molar O2 adalah 32 g/mol atau 32.000 mg/mol. Jadi, 8.0 mg/L ÷ 32.000 mg/mol = 0.00025 mol/L. Atau, 2.5 x 10^-4 M (molar).
Ini adalah konsentrasi molar O2 di danau tersebut.
Sekarang, jika kita ingin memperkirakan total molekul O2 dalam seluruh volume danau, katakanlah danau tersebut memiliki volume 500.000 meter kubik (5 x 10^8 liter). Pertama, cari total mol O2: (2.5 x 10^-4 mol/L) x (5 x 10^8 L) = 125.000 mol O
2. Angka ini sudah fantastis. Lalu, kalikan dengan bilangan Avogadro untuk mendapatkan jumlah molekul: 125.000 mol x (6.022 x 10^23 molekul/mol) = 7.5275 x 10^28 molekul O2.
Itu adalah angka 75 diikuti oleh 27 nol. Jumlah partikel O2 yang tak terbayangkan banyaknya, yang terus-menerus digunakan dan dihasilkan kembali oleh seluruh kehidupan di danau tersebut, menggambarkan betapa kompleks dan dinamisnya sistem akuatik meski pada tingkat molekuler.
Danau yang Bernapas: Analogi Fluktuasi Oksigen
Sebuah danau bukanlah wadah air yang diam. Ia adalah organisme yang bernapas. Napasnya diukur dari naik turunnya partikel oksigen terlarut di dalam tubuhnya. Di saat fajar, setelah malam yang panjang di mana tumbuhan air dan alga ikut bernapas, danau itu seolah-olah menarik napas dalam-dalam namun dengan persediaan yang menipis—kadar O2 mencapai titik terendah. Saat matahari terbit, sinarnya menembus permukaan, memberi energi pada fitoplankton untuk memulai fotosintesis. Seperti paru-paru hijau raksasa, mereka mulai mengeluarkan gelembung-gelembung oksigen molekuler ke dalam air. Partikel demi partikel O2 dilepaskan, meningkatkan konsentrasinya secara perlahan. Di siang hari, danau itu berada di puncak “inhalasi”, penuh dengan energi dan kehidupan. Ikan-ikan aktif, serangga air berkembang biak. Menjelang malam, saat fotosintesis berhenti, proses pernapasan dan dekomposisi kembali mendominasi, mengkonsumsi O2. Danau pun memasuki fase “ekshalasi” yang panjang, melepaskan sebagian energinya kembali ke atmosfer dalam bentuk karbon dioksida dan panas, sambil menunggu napas baru dari matahari esok hari. Ritme harian jumlah partikel O2 ini adalah detak jantung ekosistem perairan.
Paradoks Ketersediaan Partikel Oksigen di Lingkungan Ekstrem dan Adaptasi Teknologi Penyangga Hayati: Jumlah Partikel Dalam Mol O2 (g)
Di Bumi, pasokan partikel O2 tampak begitu melimpah dan otomatis. Namun, di lingkungan tertutup atau ekstrem—seperti dalam kabin pesawat ruang angkasa, kapal selam yang menyelam berminggu-minggu, atau stasiun penelitian di dataran tinggi—setiap molekul O2 menjadi sumber daya yang berharga yang harus dihitung, diproduksi ulang, dan diatur dengan presisi. Tantangannya adalah menciptakan sistem yang dapat mempertahankan jumlah mol O2 dalam kisaran sempit yang aman untuk manusia (tekanan parsial O2 sekitar 0.21 atm), sambil secara bersamaan membuang produk sampingan respirasi, yaitu karbon dioksida.
Kegagalan dalam regulasi ini bukan hanya soal ketidaknyamanan, tetapi bisa berakibat fatal dalam waktu singkat.
Di ruang angkasa, tidak ada atmosfer untuk dihirup. Setiap partikel O2 harus dibawa dari Bumi atau dibuat di tempat. Ini adalah paradoks logistik: membawa terlalu sedikit berarti risiko kehabisan napas, membawa terlalu banyak berarti membuang-buang massa yang sangat mahal untuk diluncurkan. Solusinya adalah sistem regeneratif yang mencoba menutup siklus, mengubah CO2 yang diembuskan astronaut kembali menjadi O2 yang dapat dihirup.
Teknologi ini berdiri di atas prinsip stoikiometri reaksi kimia yang ketat, di mana jumlah mol reaktan dan produk harus seimbang untuk menjaga stabilitas atmosfer buatan.
Prosedur Teknis Sistem Regeneratif Oksigen
Sebuah sistem pendukung kehidupan yang tertutup memerlukan beberapa proses terintegrasi. Berikut adalah prosedur teknis singkat untuk sistem dasar yang mempertahankan jumlah mol O2.
- Penyerapan Karbon Dioksida (CO2 Removal): Udara kabin dialirkan melalui bahan penyerap seperti lithium hidroksida (LiOH) atau zeolit. Reaksi seperti 2LiOH + CO2 → Li2CO3 + H2O secara stoikiometris mengikat molekul CO2, mencegah akumulasi yang beracun.
- Elektrolisis Air (Oxygen Generation): Air yang diperoleh dari kondensasi napas, keringat, atau urine, atau yang dibawa dari Bumi, dipecah menggunakan listrik (dari panel surya). Reaksi 2H2O → 2H2 + O2 menghasilkan gas oksigen murni secara stoikiometris: setiap 2 mol air menghasilkan 1 mol O2. O2 ini kemudian dilepaskan terkendali ke kabin.
- Pengurangan Karbon Dioksida (CO2 Reduction): Untuk sistem yang lebih maju, CO2 yang ditangkap dapat direduksi dengan hidrogen (H2 dari elektrolisis) dalam reaktor Sabatier: CO2 + 4H2 → CH4 + 2H2O. Reaksi ini menghasilkan air, yang dapat didaur ulang ke elektroliser, menutup sebagian siklus.
- Monitoring dan Kontrol Tekanan Parsial: Sensor O2 dan CO2 yang sangat sensitif terus memantau jumlah partikel gas di udara. Sistem kontrol secara otomatis mengatur laju elektrolisis atau pelepasan O2 dari tangki cadangan untuk menjaga tekanan parsial pada setpoint yang aman.
Perbandingan Teknologi Penyangga Hayati Produksi Oksigen
Berbagai metode dapat digunakan untuk menghasilkan atau menyediakan O2 dalam lingkungan terkontrol, masing-masing dengan pertimbangan kapasitas, energi, dan kompleksitasnya.
| Teknologi | Kapasitas Produksi (Perkiraan Mol O2/hari untuk 1 orang) | Energi/Kebutuhan Input | Kompleksitas & Pemeliharaan |
|---|---|---|---|
| Generator Kimia (e.g., Kalium Klorat) | Tetap (tergantung stok), ~2-3 mol dari satu cartridge | Daya aktivasi panas rendah, sekali pakai. | Sangat rendah, sederhana, tapi tidak regeneratif dan menghasilkan limbah padat. |
| Elektrolisis Air | Dapat diatur, ~20-25 mol (untuk kebutuhan harian) | Tinggi (listrik untuk memecah H2O), perlu pasokan air. | Sedang hingga tinggi, memerlukan sistem pemurnian air dan pengelolaan gas H2. |
| Sistem Tanaman Hidroponik (Fotosintesis) | Variatif, bergantung luas dan cahaya, ~1-2 mol per m² per hari | Cahaya (matahari atau buatan), nutrisi, air, pengaturan lingkungan. | Sangat tinggi, memerlukan perawatan agrikultur, sistem pendukung kehidupan tanaman, dan waktu untuk tumbuh. |
| Tangki Penyimpanan O2 Bertekanan (Dari Bumi) | Terbatas oleh volume tangki, beberapa ratus mol. | Hanya untuk pelepasan, tidak ada produksi. | Rendah, tetapi tidak berkelanjutan untuk misi panjang karena massa yang besar. |
Skenario Hipotetis: Kegagalan Regulasi Oksigen dalam Misi Antariksa
Bayangkan sebuah misi berawak jangka panjang ke Mars. Setelah beberapa bulan perjalanan, sebuah micrometeorit merusak modul utama dan menyebabkan kebocoran kecil tetapi terus-menerus pada sistem pendingin reaktor Sabatier. Sistem itu terlalu panas dan otomatis dimatikan. Awalnya, tidak ada alarm darurat O2 karena elektroliser masih berjalan, menghasilkan O2 dari air. Namun, tanpa reaktor Sabatier yang berfungsi, CO2 yang dihasilkan kru tidak dapat dikonversi kembali menjadi air.
Penyerap CO2 (seperti LiOH) mulai jenuh lebih cepat dari perkiraan.
Dalam beberapa hari, meskipun konsentrasi O2 masih normal, jumlah partikel CO2 di kabin mulai meningkat secara perlahan namun pasti. Sensor CO2 memberi peringatan, tetapi cadangan penyerap terbatas. Pada tingkat molekuler, setiap napas yang diembuskan menambah lebih banyak molekul CO2 yang tidak dapat dibuang. Ketika tekanan parsial CO2 melewati ambang batas (sekitar 0.5% volume untuk gejala awal, >2% berbahaya), kru mulai mengalami sakit kepala, gangguan konsentrasi, dan sesak napas—gejala hiperkapnia.
Upaya mereka untuk memperbaiki sistem menjadi kurang efektif karena penurunan fungsi kognitif.
Jika kebocoran pada sistem pendingin tidak dapat diperbaiki, dan cadangan penyerap CO2 habis, situasi akan kritis. Pilihan terakhir adalah menggunakan tangki O2 cadangan untuk “membilas” kabin dengan O2 murni sambil membuang udara yang terkontaminasi CO2 ke luar angkasa, sebuah proses yang sangat boros dan mengurangi persediaan untuk sisa misi. Setiap partikel O2 yang terbuang adalah kerugian yang tak tergantikan. Skenario ini menggambarkan dengan jelas bagaimana kelangsungan hidup di lingkungan ekstrem bergantung pada keseimbangan angka yang rapuh: jumlah mol O2 yang masuk harus seimbang dengan jumlah mol CO2 yang dikeluarkan, dan teknologi hanyalah alat untuk menjaga tarian molekuler yang rumit ini tetap berlangsung.
Penutupan
Jadi, setelah menyusuri perjalanan yang cukup panjang, terlihat jelas bahwa membahas jumlah partikel dalam mol O2 (g) jauh melampaui hitung-hitungan kimia biasa. Konsep ini adalah kunci untuk membuka pemahaman tentang keterhubungan segala sesuatu, dari skala kosmik filosofis hingga detail teknis yang menyangga kehidupan modern. Ia mengajarkan bahwa di balik kesederhanaan sebuah nafas, terdapat simfoni partikel yang sangat kompleks dan teratur.
Memahami jumlahnya berarti memiliki kemampuan untuk memprediksi, merekayasa, dan melestarikan.
Pada akhirnya, bilangan Avogadro dan konsep mol mengingatkan kita akan keajaiban yang tersembunyi dalam hal-hal yang tampak biasa. Setiap tarikan napas adalah bukti langsung dari interaksi triliunan molekul oksigen dengan tubuh kita. Dengan menguasai bahasa kuantitatif ini, kita bukan hanya menjadi lebih paham tentang alam semesta, tetapi juga lebih mampu untuk merawatnya dan berinovasi untuk masa depan. Sungguh luar biasa bagaimana sebuah angka dapat membawa kita pada petualangan sains yang begitu mendalam dan aplikatif.
FAQ Umum
Apakah satu mol gas oksigen (O2) beratnya selalu 32 gram?
Tidak selalu. Massa molar O2 memang 32 gram/mol, tetapi massa satu mol gas tersebut bergantung pada jumlah zatnya. 32 gram adalah massa
-untuk setiap mol*-nya. Jadi, 0.5 mol O2 massanya 16 gram, dan 2 mol massanya 64 gram.
Mengapa harus ada bilangan Avogadro yang begitu besar, apakah tidak bisa pakai angka yang lebih sederhana?
Bilangan Avogadro yang besar (6.022 x 10^23) justru dipilih agar skala makroskopik (gram) selaras dengan skala mikroskopik (massa atom). Angka ini membuat perhitungan kimia menjadi praktis. Jika lebih kecil, satu mol akan merepresentasikan terlalu sedikit partikel dan menjadi tidak relevan dengan pengukuran di lab.
Bagaimana cara membayangkan jumlah partikel sebanyak bilangan Avogadro dengan lebih mudah?
Bayangkan jika Anda memiliki 6.022 x 10^23 butir beras. Jumlah beras itu akan mampu menutupi seluruh permukaan bumi dengan lapisan setinggi beberapa meter, atau bisa memberi makan seluruh populasi manusia di Bumi selama jutaan tahun. Itulah skala “kelimpahan” yang diwakili oleh satu mol.
Apakah jumlah partikel dalam satu mol gas lain, seperti nitrogen (N2), sama dengan dalam satu mol O2?
Ya, persis sama. Satu mol zat apa pun, baik itu O2, N2, air (H2O), atau bahkan butiran pasir (secara teoritis), selalu mengandung jumlah partikel dasar yang sama, yaitu bilangan Avogadro. Yang membedakan adalah massa satu mol-nya, karena bergantung pada massa molekul atau atom relatif zat tersebut.
Dalam aplikasi dunia nyata, apakah ilmuwan selalu bekerja dengan satu mol penuh?
Sangat jarang. Dalam eksperimen laboratorium atau proses industri, ilmuwan dan insinyur lebih sering bekerja dengan fraksi mol (seperti milimol, mikromol) atau kelipatannya (kilomol). Konsep mol digunakan sebagai satuan dasar untuk memudahkan konversi antara massa, jumlah partikel, dan volume gas.