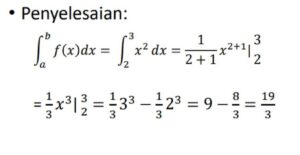Jumlah Partikel Oksigen (O₂) dalam 8 gram Gas Oksigen bukan sekadar angka mati di buku teks. Bayangkan, dari tarikan napas kita yang paling dalam hingga kobaran api yang menghangatkan, semuanya bermula dari tarian tak terlihat miliaran molekul kecil ini. Mari kita buka tabirnya, seolah-olah kita sedang mengintip ke dalam dunia mikro yang penuh keajaiban, di mana segenggam kecil gas menyimpan cerita besar tentang kehidupan, energi, dan keseimbangan alam semesta.
Pertanyaan sederhana “berapa banyak sih partikelnya?” justru menjadi gerbang menuju pemahaman yang lebih luas. Melalui 8 gram gas oksigen yang tampak sepele ini, kita bisa menjelajahi prinsip dasar kimia, mengukur kebutuhan sel-sel dalam tubuh, bahkan merancang reaksi industri yang presisi. Setiap langkah perhitungannya seperti memecahkan kode rahasia alam, mengungkap bagaimana skala mikro yang tak terlihat berdampak langsung pada realitas makro yang kita alami sehari-hari.
Menelusuri Jejak Molekul Oksigen dari Atmosfer Bumi ke Dalam Tabung Laboratorium
Oksigen yang kita hirup setiap hari bukanlah barang jadi yang selalu ada. Ia adalah hasil dari proses alamiah yang rumit dan panjang. Di alam, molekul diatomik O₂ terutama dihasilkan melalui fotosintesis oleh tumbuhan, alga, dan cyanobacteria. Proses ini menggunakan energi matahari untuk memecah molekul air (H₂O) dan melepaskan oksigen sebagai produk sampingan. Sebelum kehidupan fotosintetik muncul miliaran tahun lalu, atmosfer Bumi hampir tidak mengandung oksigen bebas.
Akumulasi O₂ secara masif, peristiwa yang disebut Great Oxidation Event, secara fundamental mengubah kimia planet dan memungkinkan evolusi kehidupan aerobik yang kompleks.
Oksigen di udara bebas yang kita nikmati saat ini adalah campuran yang tidak murni. Ia bercampur dengan nitrogen, argon, karbon dioksida, uap air, dan berbagai partikel lainnya. Konsentrasinya sekitar 21% volume. Berbeda dengan kondisi di alam, gas oksigen di laboratorium atau industri dimurnikan melalui berbagai proses seperti distilasi kriogenik (penyulingan udara cair) atau adsorpsi perubahan tekanan (Pressure Swing Adsorption). Hasilnya adalah gas dengan kemurnian yang dapat disesuaikan kebutuhan, mulai dari oksigen medis (≥99.5%) hingga oksigen kemurnian tinggi untuk semikonduktor yang mencapai 99.9999%.
Perjalanan dari atmosfer campuran ke tabung bertekanan tinggi melambangkan kemampuan manusia untuk mengisolasi dan memanfaatkan elemen fundamental kehidupan dengan presisi.
Perbandingan Sifat Fisika Oksigen dalam Berbagai Medium
Sifat fisika oksigen sangat bergantung pada lingkungan dan tekanannya. Perbandingan berikut memberikan gambaran bagaimana konteks aplikasi mempengaruhi perilaku molekul O₂ yang sama.
| Parameter | O₂ di Udara Bebas (21%) | O₂ Udara Terkompresi | O₂ Gas Medis | O₂ Kemurnian Tinggi (Industri) |
|---|---|---|---|---|
| Tekanan | ~0.21 atm (parsial) | 4-15 bar (dalam tabung) | 200 bar (tabung kecil) | 150-300 bar (tabung besar) |
| Kepadatan Partikel | Rendah, tersebar | Sangat tinggi, rapat | Sangat tinggi, rapat | Sangat tinggi, rapat |
| Kelembaban | Bergantung cuaca | Kering (udara dikeringkan) | Sangat kering | Ekstrem kering (titik embun <-40°C) |
| Pengotor Utama | N₂, Ar, CO₂, debu | Minyak kompresor, N₂ | CO, CO₂, uap air (sangat minimal) | Gas inert lain (N₂, Ar), hidrokarbon (sangat minimal) |
Langkah-Langkah Pengukuran 8 Gram Gas O₂ di Laboratorium
Mengukur massa gas secara akurat membutuhkan pendekatan tidak langsung karena sifat gas yang mudah menyebar. Prinsip yang umum digunakan adalah mengukur tekanan, volume, dan suhu untuk menghitung massa menggunakan hukum gas ideal, atau menimbang selisih massa tabung. Berikut adalah prosedur rinci menggunakan metode penimbangan selisih dengan alat presisi.
- Persiapan Alat: Siapkan tabung gas oksigen kecil berkatup, neraca analitik dengan ketelitian 0.0001 gram, serta alat bantu seperti penjepit dan sarung tangan. Pastikan neraca dikalibrasi dan berada di permukaan yang stabil dan bebas getaran.
- Penimbangan Awal: Timbang tabung gas oksigen beserta katupnya dalam keadaan penuh. Catat massa ini sebagai M₁. Pastikan permukaan tabung bersih dari debu atau minyak yang dapat mempengaruhi pembacaan.
- Pengeluaran Gas Terkontrol: Sambungkan tabung ke sistem pengatur tekanan (regulator) dan alirkan gas secara perlahan ke dalam sistem atau ruang tertutup yang telah divakumkan sebelumnya. Tujuan kita bukan mengosongkan tabung, tetapi mengurangi massanya sekitar 8 gram.
- Penimbangan Akhir: Setelah aliran dihentikan dan katup ditutup rapat, tunggu beberapa saat agar suhu tabung stabil kembali ke suhu ruang. Timbang kembali tabung tersebut. Catat massa ini sebagai M₂.
- Perhitungan Massa O₂: Massa gas oksigen yang dikeluarkan dihitung dari selisih massa: Massa O₂ = M₁
-M₂. Jika selisihnya tepat 8.0000 gram, maka kita telah berhasil mengukur 8 gram gas O₂ dengan presisi tinggi.
Perhitungan Jumlah Partikel dalam 8 Gram Gas O₂
Dari massa yang telah diukur, kita dapat melangkah ke dunia mikroskopis dengan menghitung jumlah molekul O₂ yang ada. Perhitungan ini mengandalkan konstanta fundamental, yaitu bilangan Avogadro.
Metode 1: Konsep Mol
1. Tentukan massa molar O₂. Atom O memiliki massa atom relatif 16, sehingga O₂ = 32 g/mol.
2. Hitung jumlah mol (n) dalam 8 gram: n = massa / massa molar = 8 g / 32 g/mol = 0.25 mol.3. Hitung jumlah partikel (N): N = n × bilangan Avogadro = 0.25 mol × 6.022 × 10²³ molekul/mol = 1.5055 × 10²³ molekul.
Metode 2: Langsung dari Massa
1. Hitung massa satu molekul O₂: Massa 1 molekul O₂ = massa molar / bilangan Avogadro = (32 g/mol) / (6.022 × 10²³ mol⁻¹) ≈ 5.31 × 10⁻²³ gram.
2. Hitung jumlah molekul (N) dalam 8 gram: N = total massa / massa per molekul = 8 g / (5.31 × 10⁻²³ g) ≈ 1.505 × 10²³ molekul.Kedua metode memberikan hasil yang sama: 8 gram gas oksigen mengandung sekitar 150.500.000.000.000.000.000.000 (1,5 × 10²³) molekul O₂.
Dinamika Partikel Oksigen dan Implikasinya pada Skala Biomedis Seluler
Angka 1.5 × 10²³ molekul terasa abstrak, namun dalam konteks tubuh manusia, ia memiliki makna fisiologis yang sangat nyata. Oksigen yang kita hirup pada akhirnya akan diangkut oleh hemoglobin dalam sel darah merah. Setiap molekul hemoglobin dapat mengikat maksimal empat molekul O₂. Dengan mengetahui jumlah molekul O₂ dalam 8 gram, kita dapat memperkirakan berapa banyak hemoglobin yang dapat “dipenuhi” oleh kuantitas ini, memberikan gambaran tentang efisiensi sistem transportasi oksigen kita.
Massa molar hemoglobin bervariasi, tetapi rata-rata sekitar 64.500 g/mol. Satu mol hemoglobin (6.022 × 10²³ molekul) dapat mengikat 4 mol O₂ (4 × 6.022 × 10²³ molekul). Dengan 0.25 mol O₂ dari 8 gram, maka jumlah O₂ yang tersedia adalah 0.25 × 6.022 × 10²³ = 1.505 × 10²³ molekul. Untuk mengikat semua O₂ ini, dibutuhkan seperempat dari jumlah hemoglobin yang dibutuhkan untuk 1 mol O₂, yaitu sekitar 0.0625 mol hemoglobin.
Dalam gram, ini setara dengan 0.0625 mol × 64.500 g/mol ≈ 4.031 gram hemoglobin. Artinya, secara teoritis, 8 gram oksigen murni dapat sepenuhnya diangkut oleh sekitar 4 gram hemoglobin. Ini mengilustrasikan kapasitas ikatan yang sangat efisien dari hemoglobin, yang menjadi kunci kehidupan aerobik.
Konversi Satuan 8 Gram O₂ ke Parameter Biomedis dan Energi

Source: amazonaws.com
Untuk memahami implikasi kuantitas 8 gram O₂ dalam berbagai konteks, konversi satuan ke bentuk yang lebih aplikatif sangat membantu.
Menghitung jumlah partikel oksigen dalam 8 gram O₂, yang melibatkan konsep mol dan bilangan Avogadro, seru banget karena mengasah logika kuantitatif kita. Nah, kemampuan analitis serupa juga sangat dibutuhkan untuk memahami pola perubahan dalam matematika, misalnya saat menganalisis Integral dan Turunan Akar (1 - √x). Pemahaman mendalam tentang “perubahan” ini akhirnya menguatkan interpretasi kita, termasuk dalam menentukan berapa tepatnya molekul O₂ yang terkandung dalam sampel tersebut.
| Parameter | Nilai untuk 8 gram O₂ | Rumus/Keterangan | Implikasi |
|---|---|---|---|
| Jumlah Molekul | 1.505 × 10²³ | n × Nₐ (Nₐ = Bil. Avogadro) | Skala mikroskopis proses seluler. |
| Volume pada STP | ≈ 5.6 Liter | V = n × 22.4 L/mol | Setara dengan volume beberapa kantong napas dalam-dalam. |
| Jumlah Mol | 0.25 mol | n = massa / Mᵣ | Satuan dasar dalam stoikiometri kimia. |
| Energi Teoretis (dari respirasi) | ≈ 40 kJ | Berdasarkan ∆H respirasi glukosa per mol O₂ (~500 kJ/mol) | Dapat menaikkan suhu ~1 liter air sebesar 9.5°C. |
Perjalanan Partikel O₂ dari Alveolus ke Mitokondria
Bayangkan sebuah gugus molekul O₂ dari 8 gram oksigen yang kita hitung tadi. Setelah dihirup, mereka memasuki alveolus, kantong udara kecil di paru-paru yang dindingnya setipis balon. Di sini, karena perbedaan tekanan, setiap molekul O₂ berdifusi melintasi membran alveolus-kapiler yang hanya setebal 0.5 mikrometer. Begitu masuk ke dalam kapiler darah, molekul O₂ bertemu dengan hemoglobin (Hb) dalam sel darah merah.
Dengan gesit, ia terikat pada ion besi di inti heme hemoglobin, menjadi Oksihemoglobin (HbO₂).
Dengan tumpangan yang aman di dalam sel darah merah, molekul O₂ ini kemudian dibawa oleh aliran darah, meninggalkan paru-paru menuju jantung, lalu dipompa ke seluruh tubuh. Saat sel darah merah melewati kapiler di jaringan, seperti otot yang sedang aktif, kondisi berubah: suhu lebih hangat, pH lebih asam, dan konsentrasi CO₂ tinggi. Kondisi ini menyebabkan hemoglobin melepaskan “penumpang” O₂-nya. Molekul O₂ yang bebas kemudian berdifusi keluar dari kapiler, masuk ke dalam sel otot.
Di dalam sitoplasma, ia bergerak menuju “pembangkit tenaga” sel: mitokondria. Di sana, di akhir rantai respirasi, molekul O₂ akhirnya bertemu dengan elektron dan ion hidrogen, menerimanya untuk membentuk molekul air (H₂O). Proses penerimaan elektron ini melepaskan energi yang digunakan untuk membuat ATP, mata uang energi sel. Perjalanan panjang dari udara ke air ini adalah inti dari kehidupan aerobik.
Pemanfaatan dalam Kalibrasi Alat Bantu Pernapasan
Pengetahuan pasti tentang kuantitas gas oksigen sangat krusial dalam dunia medis, terutama untuk memastikan alat bantu pernapasan memberikan dosis yang akurat dan aman bagi pasien. Kalibrasi rutin adalah kuncinya.
- Verifikasi Konsentrasi Output: Sebuah analyzer oksigen portabel yang telah dikalibrasi digunakan untuk memverifikasi bahwa konsentrasi O₂ yang diatur pada ventilator atau konsentrator sesuai dengan yang ditampilkan, misalnya 40%, 60%, atau 100%.
- Kalibrasi Flow Sensor: Alat seperti spirometer kalibrator (flow analyzer) digunakan untuk mengukur laju aliran udara/oksigen yang sebenarnya keluar dari alat bantu napas. Data ini dibandingkan dengan setpoint yang diinginkan untuk koreksi.
- Pengujian Volume Tidal: Pada ventilator, volume udara yang diberikan per napas (tidal volume) dikalibrasi menggunakan kalibrator volume, seringkali berupa “super syringe” raksasa yang presisi, untuk memastikan pasien menerima volume yang cukup tanpa menyebabkan barotrauma.
- Integrasi dengan Sistem Monitoring: Sensor oksigen (sel galvanik atau paramagnetik) pada monitor pasien juga harus dikalibrasi secara berkala menggunakan gas kalibrasi dengan konsentrasi O₂ yang diketahui (misal, 21% dan 100%) untuk memastikan pembacaan saturasi oksigen (SpO₂) dan tekanan parsial (PaO₂) secara tidak langsung akurat.
Interaksi Kuantitatif Oksigen dengan Unsur Lain dalam Reaksi Pembakaran Terkontrol: Jumlah Partikel Oksigen (O₂) Dalam 8 gram Gas Oksigen
Di luar tubuh, oksigen memainkan peran yang sama pentingnya dalam reaksi pembakaran, yang pada dasarnya adalah respirasi yang sangat cepat dan eksotermik. Memahami stoikiometri, yaitu hubungan kuantitatif antara pereaksi dan produk, memungkinkan kita memprediksi hasil reaksi dengan tepat. Mari kita ambil 8 gram gas O₂ (0.25 mol) sebagai reaktan pembatas dan lihat interaksinya dengan dua bahan bakar umum: hidrogen dan metana.
Reaksi pembakaran sempurna hidrogen menghasilkan air: 2H₂ + O₂ → 2H₂O. Dari persamaan, 1 mol O₂ bereaksi dengan 2 mol H₂. Dengan 0.25 mol O₂, kita membutuhkan 0.5 mol H₂, yang setara dengan sekitar 1 gram (karena massa molar H₂ = 2 g/mol). Reaksi ini akan menghasilkan 0.5 mol H₂O, atau sekitar 9 gram air, dan melepaskan sejumlah besar energi (sekitar 142 kJ untuk 0.25 mol O₂).
Sementara itu, pembakaran sempurna metana: CH₄ + 2O₂ → CO₂ + 2H₂O. Di sini, 2 mol O₂ dibutuhkan untuk 1 mol CH₄. Dengan 0.25 mol O₂, hanya 0.125 mol CH₄ yang dapat terbakar sempurna. Ini setara dengan 2 gram metana (massa molar 16 g/mol). Produknya adalah 0.125 mol CO₂ (~5.5 gram) dan 0.25 mol H₂O (~4.5 gram).
Perbandingan ini menunjukkan bagaimana jumlah oksigen yang tetap membatasi jumlah bahan bakar yang dapat dibakar dan menentukan komposisi produk akhir, sebuah prinsip mendasar dalam teknik kimia dan keselamatan kebakaran.
Faktor Penyimpangan Jumlah Partikel Efektif dalam Reaksi Nyata
Perhitungan stoikiometri mengasumsikan kondisi ideal. Dalam praktiknya di laboratorium atau industri, beberapa faktor dapat menyebabkan jumlah partikel O₂ yang bereaksi efektif menyimpang dari perhitungan teoritis.
- Pencampuran yang Tidak Sempurna: Molekul bahan bakar dan oksigen mungkin tidak tercampur secara homogen sebelum atau selama reaksi. Beberapa molekul O₂ mungkin “terjebak” di area dengan konsentrasi bahan bakar rendah, sehingga tidak bereaksi meskipun secara teoritis tersedia.
- Kecepatan Reaksi dan Difusi: Pada suhu rendah, laju reaksi mungkin lambat sehingga tidak semua O₂ sempat bereaksi sebelum produk dibuang atau kondisi berubah. Molekul juga harus bertabrakan dengan orientasi dan energi yang tepat untuk bereaksi.
- Adanya Pengotor: Gas oksigen atau bahan bakar yang tidak murni mungkin mengandung senyawa yang menyerap oksigen, mengkatalisis reaksi samping, atau membentuk lapisan pasif pada permukaan reaksi, mengurangi ketersediaan O₂ untuk reaksi utama.
- Kondisi Reaksi Non-Ideal: Pada tekanan sangat tinggi atau suhu sangat tinggi, perilaku gas menyimpang dari hukum gas ideal. Volume efektif yang ditempati partikel dan gaya tarik antarmolekul menjadi signifikan, mempengaruhi konsentrasi dan laju reaksi.
- Pembentukan Produk Samping: Pada pembakaran hidrokarbon, kekurangan oksigen atau pendinginan yang cepat dapat menghasilkan karbon monoksida (CO) atau jelaga (C) alih-alih CO₂. Ini berarti tidak semua atom oksigen digunakan untuk oksidasi sempurna, mengurangi “efektivitas” per molekul O₂.
Perbandingan Pembakaran dengan Berbagai Bahan Bakar Menggunakan 8 gram O₂, Jumlah Partikel Oksigen (O₂) dalam 8 gram Gas Oksigen
Kinerja pembakaran sangat bergantung pada jenis bahan bakar. Tabel berikut membandingkan reaksi ketika 0.25 mol (8 gram) O₂ digunakan sebagai reaktan pembatas.
| Bahan Bakar (Reaksi) | Massa Bahan Bakar yang Terbakar | Energi yang Dilepaskan (Pendekatan) | Suhu Nyala Teoretis & Produk Samping Potensial |
|---|---|---|---|
| Hidrogen (2H₂ + O₂) | 1.0 gram H₂ | ~142 kJ | Sangat tinggi (>2000°C). Produk hanya H₂O (bersih). |
| Metana (CH₄ + 2O₂) | 2.0 gram CH₄ | ~111 kJ | Tinggi (~1950°C). Risiko CO jika O₂ kurang. |
| Propana (C₃H₈ + 5O₂) | ~1.32 gram C₃H₈ | ~56 kJ | Tinggi. Cenderung berjelaga jika pencampuran buruk. |
| Bensin (C₈H₁₈ + 12.5O₂) | ~1.14 gram C₈H₁₈ | ~55 kJ | Tinggi. Produk samping kompleks: CO, NOx, jelaga, HC tak terbakar. |
Prinsip Kesetimbangan Massa dan Pengaruh Jumlah Partikel pada Laju Reaksi
Prinsip Kesetimbangan Massa (Hukum Kekekalan Massa Lavoisier): “Massa total reaktan sama dengan massa total produk dalam suatu reaksi kimia.” Dalam konteks 8 gram O₂, ini berarti massa semua zat yang bereaksi dengan O₂ ditambah 8 gram itu sendiri harus sama persis dengan massa semua produk yang dihasilkan. Jika 8 gram O₂ bereaksi sempurna dengan 1 gram H₂ membentuk 9 gram H₂O, massa tetap 9 gram sebelum dan sesudah reaksi.
Prinsip ini adalah dasar dari semua perhitungan stoikiometri.
Pengaruh pada Laju Reaksi dalam Ruang Tertutup: Dalam ruang tertutup dengan volume tetap, jumlah partikel O₂ (konsentrasinya) secara langsung mempengaruhi laju reaksi pembakaran. Semakin tinggi konsentrasi O₂, semakin sering terjadi tumbukan efektif dengan molekul bahan bakar, sehingga reaksi berlangsung lebih cepat dan lebih eksotermik. Namun, peningkatan laju ini juga berarti pelepasan energi panas yang lebih cepat. Jika panas tidak dapat dibuang dengan cukup cepat, suhu dan tekanan dalam ruang tertutup akan meningkat drastis, yang dapat mempercepat reaksi lebih lanjut secara eksponensial.
Inilah yang mendasari ledakan. Dengan demikian, mengontrol jumlah partikel O₂ bukan hanya tentang hasil, tetapi juga tentang kecepatan dan keselamatan proses.
Metamorfosis Konseptual dari Massa ke Jumlah Entitas dalam Pendidikan Sains Dasar
Salah satu lompatan konseptual terbesar dalam pembelajaran kimia adalah memahami bahwa massa yang kita timbang (dalam gram) sebenarnya adalah perwakilan dari jumlah entitas mikroskopis (atom, molekul, ion) yang sangat banyak. Konsep “mol” dan “bilangan Avogadro” adalah jembatan yang menghubungkan kedua dunia ini. Contoh 8 gram gas oksigen adalah alat yang sempurna untuk membangun jembatan tersebut, karena massanya mudah dibayangkan dan perhitungannya sederhana.
Strategi pengajaran dimulai dengan membangun rasa “ketidakcukupan” deskripsi makroskopis. Tunjukkan dua balon: satu berisi 8 gram helium dan satu berisi 8 gram oksigen. Secara massa sama, tapi sifatnya berbeda. Mengapa? Karena jenis partikelnya berbeda.
Ini mengarah pada kebutuhan untuk menghitung partikel. Perkenalkan massa molar sebagai “faktor konversi spesifik” untuk setiap zat, seperti konversi lusin ke buah, tetapi dalam skala yang jauh lebih besar. 32 gram O₂ adalah satu “paket standar” yang berisi 6.022×10²³ molekul. Dengan analogi ini, 8 gram O₂ adalah seperempat paket, jadi berisi seperempat dari jumlah molekul tersebut. Penting untuk terus menekankan bahwa mol adalah satuan jumlah, seperti lusin, bukan satuan massa.
Aktivitas visualisasi, seperti menghitung butiran beras yang dibutuhkan untuk mencapai massa molar, dapat memperkuat pemahaman tentang besarnya bilangan Avogadro.
Analogi Besarnya Jumlah Partikel dalam 8 Gram O₂
Bayangkan semua molekul O₂ dalam 8 gram itu adalah butiran pasir putih halus. Jika setiap butir pasir mewakili satu molekul, maka tumpukan pasir yang terbentuk akan cukup untuk menutupi seluruh lapangan sepak bola standar dengan ketebalan lebih dari satu meter. Itulah kerapatan jumlah yang kita bicarakan dalam skala mikro.
Anggaplah setiap molekul O₂ adalah satu detik waktu. 1.5 × 10²³ detik setara dengan sekitar 4.75 triliun tahun. Itu sekitar 350 kali lebih lama dari usia alam semesta saat ini yang diperkirakan 13.8 miliar tahun. Jadi, jika Anda mulai menghitung satu molekul per detik sejak Big Bang, Anda bahkan belum mendekati sepersepuluh dari jumlah molekul dalam 8 gram oksigen ini.
Jika setiap molekul dari 8 gram O₂ diubah menjadi sebuah halaman kertas kosong (dengan asumsi 1 molekul = 1 halaman), dan halaman-halaman itu ditumpuk, tingginya akan mencapai luar angkasa. Lebih tepatnya, tumpukan itu akan menembus atmosfer, melampaui orbit Stasiun Luar Angkasa Internasional, dan terus meroket ke kedalaman tata surya, karena ketebalannya akan mencapai orde miliaran kilometer.
Prosedur Percobaan Simulasi Mol dan Bilangan Avogadro
Percobaan ini menggunakan biji kacang hijau atau butiran beras untuk mensimulasikan konsep mol tanpa bahan kimia berbahaya.
- Tujuan: Menunjukkan bahwa “mol” adalah satuan jumlah, dan menghubungkan massa suatu sampel dengan jumlah partikel melalui “massa molar” semu.
- Alat dan Bahan: Neraca dapur, biji kacang hijau kering, wadah, kalkulator. Tentukan “massa molar semu”: misal, 50 gram kacang hijau didefinisikan sebagai 1 “mol kacang”.
- Langkah 1: Timbang 50 gram kacang hijau. Jelaskan bahwa ini adalah 1 “mol kacang” menurut definisi kita. Hitung jumlah butir kacang dalam 50 gram ini (misal, 500 butir). Maka, “bilangan Avogadro” simulasi kita adalah 500 butir/mol.
- Langkah 2: Sekarang, minta siswa menimbang “massa molar” zat lain, misalnya 25 gram beras (sebagai simulasi zat dengan “massa molar” 25 g/mol). Berapa “mol” beras yang didapat? (1 mol). Berapa jumlah butirnya? Hitung untuk 25 gram, misal 1500 butir.
Jadi “bilangan Avogadro” beras adalah 1500 butir/mol.
- Langkah 3: Berikan tantangan: “Jika saya memberi kamu 20 gram kacang hijau (dengan ‘Mᵣ’ 50), berapa ‘mol’ dan perkiraan jumlah butirnya?” Siswa hitung: n = 20/50 = 0.4 mol. Jumlah butir = 0.4 × 500 = 200 butir.
- Diskusi: Tekankan bahwa “mol” selalu mengandung jumlah entitas yang sama (sesuai “bilangan Avogadro” masing-masing sistem), tetapi massanya berbeda-beda tergantung “massa molar” zatnya, persis seperti dalam kimia sebenarnya.
Kesalahan Konsep Umum tentang Ukuran dan Jumlah Partikel
Kesalahan 1: “Karena atom sangat kecil, maka dalam 8 gram yang sedikit pasti hanya ada sedikit atom/molekul.”
Koreksi: Justru karena atom dan molekul itu sangat-sangat kecil, maka dalam massa yang tampaknya sedikit bagi kita, bisa terkumpul jumlah mereka yang luar biasa besar. Kecilnya ukuran individu dikompensasi oleh banyaknya jumlah. 8 gram adalah massa yang besar dalam skala atom.Kesalahan 2: “Molekul O₂ pasti bisa dilihat dengan mikroskop cahaya terkuat sekalipun.”
Koreksi: Molekul O₂ memiliki diameter sekitar 0.3 nanometer. Mikroskop cahaya memiliki batas resolusi sekitar 200 nanometer karena terbatas oleh panjang gelombang cahaya. Molekul individu tidak dapat dilihat dengan mikroskop cahaya. Mereka baru dapat “diindra” dengan teknik seperti mikroskop elektron atau mikroskop gaya atom.Kesalahan 3: “Jika ada 1.5 × 10²³ molekul dalam 8 gram, maka molekulnya pasti saling bersentuhan dan padat seperti dalam benda padat.”
Koreksi: Dalam keadaan gas, molekul-molekul tersebut justru sangat berjauhan jika dibandingkan dengan ukurannya sendiri. Mereka bergerak cepat dan saling bertumbukan, tetapi sebagian besar volume wadah gas adalah ruang kosong. Kerapatan partikel yang tinggi tidak berarti mereka padat merata tanpa celah; itu berarti dalam setiap volume kecil (misalnya 1 cm³) terdapat jumlah partikel yang sangat banyak, tetapi jarak antar partikel masih ribuan kali lebih besar dari diameter partikel itu sendiri.
Resonansi Filosofis Atom Oksigen dalam Keseimbangan Ekosistem dan Industri
Oksigen bukan hanya molekul untuk bernapas atau bereaksi; ia adalah pemain utama dalam keseimbangan dinamis biosfer Bumi. Produksinya melalui fotosintesis dan konsumsinya melalui respirasi, pembakaran, dan oksidasi lainnya membentuk siklus global yang rumit. Dalam skala ini, 8 gram O₂ tampak seperti setitik debu. Namun, bayangkan jika setiap manusia di Bumi (sekitar 8 miliar) masing-masing melepaskan 8 gram O₂ murni ke atmosfer.
Itu akan menjadi 64 miliar gram, atau 64.000 ton O₂. Jumlah ini masih sangat kecil dibandingkan dengan perkiraan produksi oksigen global oleh fitoplankton di lautan saja, yang mencapai ratusan miliar ton per tahun.
Posisi 8 gram dalam skala global mengajarkan kita tentang prinsip keseimbangan dan dampak kumulatif. Satu aktivitas industri kecil mungkin hanya mengonsumsi atau menghasilkan oksigen dalam orde kilogram atau ton, yang tampak insignifikan. Namun, akumulasi dari ribuan pabrik, kendaraan, dan perubahan penggunaan lahan secara global dapat menggeser keseimbangan siklus ini, meskipun dampaknya terhadap persentase O₂ atmosfer (21%) masih terlalu kecil untuk diukur secara langsung dalam waktu singkat.
Ancaman yang lebih nyata adalah dampak tidak langsung, seperti peningkatan CO₂ dari pembakaran bahan bakar fosil yang mengganggu siklus karbon dan menyebabkan perubahan iklim, yang pada gilirannya mempengaruhi produsen oksigen utama di lautan dan daratan.
Peran Setara 8 Gram O₂ di Berbagai Bidang
Jumlah partikel yang setara dengan 8 gram O₂ dapat memainkan peran yang sangat berbeda tergantung konteks aplikasinya.
| Proses/Bidang | Peran O₂ | Skala Dampak (untuk ~8 gram) | Catatan Khusus |
|---|---|---|---|
| Proses Biologis (Respirasi Sel) | Akseptor elektron akhir dalam rantai respirasi untuk menghasilkan ATP. | Dapat menghasilkan ~40 kJ energi teoritis, cukup untuk jutaan operasi sel dasar. | Efisiensi nyata di tubuh kurang dari 50%, sebagian energi menjadi panas. |
| Industri Pembuatan Baja (BOF) | Mengoksidasi karbon dan pengotor dalam besi cair menjadi gas (CO, CO₂) untuk menurunkan kadar karbon. | Jumlah sangat kecil. Skala industri menggunakan puluhan ton O₂ per batch. | Oksigen kemurnian tinggi (>99.5%) disemburkan dengan kecepatan tinggi. |
| Treatment Air Limbah (Aerasi) | Menyuplai oksigen terlarut untuk bakteri aerob menguraikan materi organik. | Dapat mengoksidasi sejumlah kecil BOD (Biochemical Oxygen Demand). | Di kolam aerasi, oksigen dari udara ditiupkan, bukan dari tabung murni. |
| Teknologi Fuel Cell | Bereaksi dengan ion hidrogen dan elektron di katoda untuk membentuk air, menghasilkan arus listrik. | Dapat menghasilkan listrik ~0.2-0.3 kWh secara teoritis, cukup untuk menyalakan lampu LED beberapa jam. | Fuel cell hidrogen-O₂ adalah yang paling efisien, dengan air sebagai satu-satunya produk. |
Jejak Lingkungan dari Sumber O₂ yang Berbeda
Pelepasan 8 gram O₂ ke atmosfer dari sumber yang berbeda memiliki konteks lingkungan dan energi yang berbeda pula.
- Fotosintesis Tanaman: O₂ ini adalah produk sampingan dari konversi CO₂ dan air menjadi glukosa menggunakan energi matahari. Jejak lingkungannya sangat positif, karena proses ini menyerap CO₂, melepaskan O₂, dan menyimpan energi matahari dalam biomassa. 8 gram O₂ dari fotosintesis disertai dengan penyerapan sekitar 12 gram CO₂.
- Elektrolisis Air: O₂ dihasilkan dengan mengalirkan listrik untuk memecah air (2H₂O → 2H₂ + O₂). Jejak lingkungannya sepenuhnya bergantung pada sumber listrik. Jika listrik berasal dari panel surya atau angin, jejaknya rendah. Jika berasal dari pembangkit batu bara, maka pelepasan 8 gram O₂ ini mungkin terkait dengan emisi CO₂ dan polutan lain dari pembakaran batu bara untuk menghasilkan listrik tersebut.
- Distilasi Kriogenik Udara: Ini adalah metode industri utama. Udara didinginkan hingga cair, lalu dipisahkan berdasarkan titik didihnya. Proses ini membutuhkan energi dalam jumlah besar (untuk kompresi dan pendinginan). Jejak lingkungannya adalah emisi tidak langsung dari pembangkit listrik yang menyuplai energi ke pabrik pemisahan udara.
- Pelepasan dari Lautan (Outgassing): Ketika suhu laut naik, kelarutan gas menurun, menyebabkan lautan melepaskan O₂ terlarut ke atmosfer. 8 gram O₂ yang dilepaskan dengan cara ini bisa menjadi indikator pemanasan global dan mungkin disertai dengan pelepasan CO₂ laut, yang dapat memperparah efek rumah kaca.
Siklus Satu Gugus Partikel O₂ di Biosfer
Mari ikuti perjalanan hipotetis beberapa molekul O₂ dari paket 8 gram kita, yang dilepaskan dari stomata daun jati raksasa di hutan tropis saat fotosintesis siang hari. Molekul-molekul itu naik ke udara, terdorong oleh angin. Salah satu molekul terhirup oleh seekor burung elang yang sedang terbang. Di paru-paru burung, ia berdifusi ke dalam darah, diikat oleh hemoglobin, dan dibawa ke sel otot sayap.
Menghitung jumlah partikel O₂ dalam 8 gram gas oksigen, kita temukan sekitar 1,5 x 10²³ molekul—sebuah angka yang luar biasa besar. Prinsip kolaborasi ini mirip dengan efisiensi saat dua orang bekerja sama, seperti yang dijelaskan dalam studi kasus Waktu Penyelesaian Renovasi Rumah Jika Ali dan Rama Bekerja Sama. Sama seperti sinergi mempercepat pekerjaan, dalam kimia, memahami konsep mol dan bilangan Avogadro ini memungkinkan kita mengkuantifikasi “tim” molekul raksasa tersebut dengan presisi yang elegan.
Di mitokondria sel tersebut, molekul O₂ ini akhirnya menerima elektron, bergabung dengan hidrogen untuk membentuk kembali molekul air. Energi dari reaksi ini digunakan untuk kontraksi otot sayap.
Namun, molekul O₂ yang lain dari gugus yang sama mungkin mengambil rute berbeda. Terbawa angin jauh dari daratan, ia akhirnya mencapai permukaan laut. Karena tekanan parsial dan suhu yang sesuai, molekul O₂ ini terlarut ke dalam air laut. Di sana, ia dihirup oleh sekumpulan zooplankton kecil. Oksigen ini digunakan untuk respirasi mereka, mengubah bahan organik menjadi energi, dan kembali menghasilkan CO₂ dan air.
Atau, mungkin molekul itu tetap terlarut, menjadi bagian dari cadangan oksigen terlarut yang vital bagi kehidupan laut, sebelum akhirnya mungkin dilepaskan kembali ke atmosfer bertahun-tahun kemudian, menyempurnakan siklus yang menghubungkan hutan, atmosfer, hewan, dan lautan dalam sebuah tarian biogeokimia yang abadi.
Ulasan Penutup
Jadi, begitulah kisah di balik 8 gram gas oksigen. Dari sebuah pertanyaan numerik yang sederhana, kita diajak berkelana melintasi disiplin ilmu, dari laboratorium yang steril hingga denyut nadi biosfer. Angka akhir jumlah partikelnya—sekitar 1,5 x 10²³ molekul—bukanlah titik akhir, melainkan sebuah awal. Ia adalah kunci untuk memahami bagaimana alam mengatur dirinya dalam satuan-satuan yang terukur namun tak terbatas maknanya. Pengetahuan ini tidak hanya memuaskan rasa ingin tahu, tetapi juga memberdayakan kita untuk berinteraksi dengan dunia secara lebih sadar dan bertanggung jawab.
FAQ Terpadu
Apakah jumlah partikel dalam 8 gram O₂ sama jika diukur di puncak gunung dan di pantai?
Tidak, jumlah partikel (molekul) O₂-nya tetap sama karena massa 8 gram tidak berubah. Namun, volume yang ditempati oleh 8 gram gas tersebut akan berbeda karena tekanan udara di puncak gunung lebih rendah, sehingga gas akan memuai.
Bisakah kita benar-benar “melihat” atau “merasakan” jumlah partikel sebanyak itu?
Tidak secara langsung. Jumlahnya yang sangat besar (kuadriliunan) berada jauh di luar jangkauan indra kita. Itulah mengapa kita menggunakan konsep mol dan analogi, seperti membandingkannya dengan butiran pasir di seluruh pantai, untuk membayangkan skalanya.
Bagaimana jika gasnya bukan O₂ murni, melainkan campuran seperti udara?
Perhitungannya akan jauh lebih rumit. 8 gram udara hanya mengandung sekitar 1,8 gram O₂. Jadi, untuk mendapatkan jumlah partikel O₂ yang setara, Anda hanya perlu mengambil sebagian kecil dari 8 gram udara tersebut, yaitu massa yang mengandung unsur O₂-nya saja.
Apa aplikasi praktis paling mengejutkan dari mengetahui jumlah partikel ini?
Dalam dunia kedokteran, pengetahuan ini vital untuk mengkalibrasi ventilator dan tabung oksigen medis secara tepat, memastikan dosis yang diterima pasien sesuai untuk mendukung metabolisme selnya tanpa membahayakan.
Apakah semua partikel O₂ dalam 8 gram itu identik dan berperilaku sama?
Secara kimiawi, ya, mereka identik sebagai molekul O₂. Namun, dalam dinamika gas, masing-masing partikel memiliki energi kinetik (kecepatan) yang berbeda-beda sesuai dengan distribusi Maxwell-Boltzmann, sehingga perilaku statistiknya beragam.