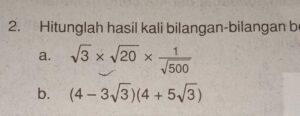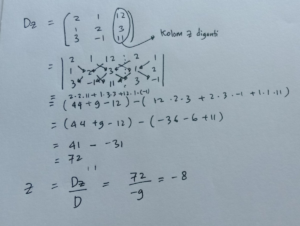Kekurangan dan Kelebihan Atom bukan sekadar daftar hitam putih dalam buku pelajaran. Ia adalah kisah tentang entitas terkecil yang justru memegang kunci rahasia alam semesta yang paling megah. Seperti seorang tokoh yang penuh paradoks, atom menyimpan keagungan dan kerendahan hati dalam inti yang sama, sebuah keajaiban yang tak terlihat mata namun menjadi fondasi segala yang tampak.
Dari debu bintang hingga denyut kehidupan, segala materi berawal dan bergantung pada bagaimana satuan dasar ini diatur. Memahami kekuatan dan batasannya berarti menyelami cerita tentang bagaimana cahaya matahari tercipta, bagaimana tubuh kita menyembuhkan diri, dan mengapa dunia material yang tampak kokoh sebenarnya dipenuhi ruang kosong dan ketidakpastian yang menari-nari menurut hukum yang aneh dan menakjubkan.
Pengenalan Dasar tentang Atom
Bayangkan kamu sedang membongkar sebuah benda, apa pun itu, sampai ke bagian terkecil yang masih mempertahankan sifat dasar dari bahan tersebut. Itulah konsep atom. Dalam dunia sains, atom dikenal sebagai unit dasar penyusun segala materi di alam semesta, dari udara yang kita hirup hingga bintang-bintang yang jauh. Memahami atom bukan sekadar hafalan tabel periodik, melainkan kunci untuk membuka pemahaman tentang bagaimana dunia fisik ini bekerja dari tingkat yang paling fundamental.
Setiap atom, meski sangat kecil, memiliki struktur internal yang teratur. Ia terdiri dari inti atom yang padat di tengah, dikelilingi oleh awan elektron yang bergerak cepat. Inti atom sendiri tersusun dari dua jenis partikel: proton yang bermuatan positif dan neutron yang tidak bermuatan (netral). Sementara itu, elektron yang bermuatan negatif “mengitari” inti. Interaksi antara muatan positif proton dan muatan negatif elektron inilah yang secara umum menjaga atom tetap utuh.
Komponen Penyusun Atom
Untuk memahami karakteristik atom, kita perlu mengenal tiga partikel subatomik utamanya. Masing-masing memiliki peran dan sifat yang unik, yang bersama-sama menentukan identitas dan perilaku suatu atom. Perbedaan mendasar di antara ketiganya dapat dilihat dari muatan listrik, massa relatif, dan lokasinya dalam struktur atom.
| Partikel | Muatan Listrik | Massa Relatif | Lokasi dalam Atom |
|---|---|---|---|
| Proton | +1 (positif) | ~1 sma | Inti Atom (Nukleus) |
| Neutron | 0 (netral) | ~1 sma | Inti Atom (Nukleus) |
| Elektron | -1 (negatif) | ~1/1840 sma | Awan Elektron di sekitar Inti |
Data pada tabel menunjukkan bahwa hampir seluruh massa atom terkonsentrasi di inti, karena massa elektron sangat kecil jika dibandingkan. Namun, ruang yang ditempati atom justru didominasi oleh wilayah awan elektron. Proton, dengan muatan positifnya, bertindak sebagai “kartu identitas” suatu unsur, sementara neutron berperan sebagai perekat yang menstabilkan inti.
Sifat-Sifat Utama Atom
Atom bukanlah entitas yang seragam. Keberagaman materi yang kita lihat sehari-hari berasal dari perbedaan dalam susunan internal atom-atom penyusunnya. Sifat-sifat utama atom ini, seperti identitas unsur dan perilaku kimianya, ditentukan oleh angka-angka sederhana: jumlah proton, neutron, dan elektron. Dengan memahami angka-angka ini, kita bisa memprediksi bagaimana suatu unsur akan bereaksi.
Jumlah Proton dan Identitas Unsur
Angka paling krusial dalam sebuah atom adalah jumlah proton dalam intinya, yang dikenal sebagai nomor atom. Inilah yang membedakan satu unsur dengan unsur lainnya secara fundamental. Sebuah atom dengan 6 proton selalu adalah atom karbon, tidak peduli berapa pun jumlah neutron atau elektronnya. Jika kamu mengubah jumlah proton, kamu mengubah atom tersebut menjadi unsur yang sama sekali berbeda. Sistem periodik unsur modern disusun berdasarkan kenaikan nomor atom ini, memberikan peta yang teratur dari keragaman unsur di alam.
Konsep Isotop dan Massa Atom
Meskipun nomor atom menentukan identitas, atom dari unsur yang sama bisa memiliki variasi dalam jumlah neutron. Variasi ini menghasilkan apa yang disebut isotop. Sebagai contoh, karbon memiliki tiga isotop yang umum: Karbon-12 (6 proton, 6 neutron), Karbon-13 (6 proton, 7 neutron), dan Karbon-14 (6 proton, 8 neutron). Mereka semua adalah karbon, tetapi memiliki massa yang berbeda. Massa atom relatif yang tercantum dalam tabel periodik adalah rata-rata tertimbang dari massa semua isotop alami suatu unsur, yang menjelaskan mengapa massa atom sering bukan bilangan bulat.
Konfigurasi Elektron dan Sifat Kimia
Sementara proton dan neutron “bersembunyi” di dalam inti, elektronlah yang menentukan bagaimana atom berinteraksi dengan atom lainnya. Elektron-elektron ini tersusun dalam tingkat-tingkat energi atau kulit. Elektron pada kulit terluar, yang disebut elektron valensi, memegang peran kunci dalam reaksi kimia. Sebagai contoh, natrium (Na) memiliki satu elektron valensi, sementara klorin (Cl) memiliki tujuh. Kecenderungan natrium untuk melepaskan satu elektron dan klorin untuk menerima satu elektron membuat mereka bereaksi sangat kuat membentuk senyawa natrium klorida (garam dapur).
Pola seperti ini berulang dalam tabel periodik, di mana unsur-unsur dalam golongan yang sama memiliki konfigurasi elektron valensi serupa dan sifat kimia yang mirip.
Kelebihan Model Atom dalam Memahami Materi
Model atom, meskipun merupakan penyederhanaan dari realitas yang kompleks, telah menjadi landasan yang sangat kuat bagi ilmu kimia dan fisika modern. Konsep ini berhasil memberikan kerangka kerja yang koheren untuk menjelaskan fenomena yang tak terhitung jumlahnya, dari mengapa besi berkarat hingga bagaimana DNA menyimpan informasi. Kekuatan utamanya terletak pada kemampuannya untuk menyederhanakan kompleksitas alam menjadi prinsip-prinsip yang dapat diprediksi dan diuji.
Salah satu pencapaian terbesarnya adalah menjelaskan keberagaman materi. Dengan hanya sekitar 100 jenis atom yang berbeda (unsur), dan aturan tentang bagaimana mereka dapat berikatan, model atom berhasil menjelaskan pembentukan jutaan senyawa yang berbeda. Air (H₂O), garam (NaCl), dan gula (C₁₂H₂₂O₁₁) semuanya dapat dijelaskan dengan elegan melalui jenis dan jumlah atom penyusunnya serta cara atom-atom tersebut terhubung.
Penerapan dalam Teknologi Modern
Pemahaman tentang atom tidak hanya teori belaka. Ia menjadi dasar dari teknologi yang mendefinisikan zaman kita. Contoh paling nyata adalah pada semikonduktor. Dengan menyuntikkan atom pengotor (doping) seperti boron atau fosfor ke dalam kristal silikon yang murni, kita dapat mengontrol dengan presisi bagaimana material tersebut menghantarkan listrik. Prinsip inilah yang menjadi jantung dari setiap transistor, mikroprosesor, dan chip komputer, menggerakkan seluruh dunia digital.
Kelebihan Teori Atom dalam Memprediksi Reaksi
Dalam ilmu kimia, model atom memberikan kemampuan prediktif yang luar biasa. Berikut adalah beberapa kelebihannya:
- Stoikiometri yang Akurat: Teori atom memungkinkan kita menulis persamaan reaksi yang seimbang dan menghitung secara tepat jumlah reaktan yang dibutuhkan atau produk yang dihasilkan, yang vital dalam industri kimia dan farmasi.
- Pemahaman tentang Ikatan: Konsep konfigurasi elektron dan kecenderungan atom untuk mencapai konfigurasi stabil (seperti oktet) memungkinkan kita memprediksi jenis ikatan yang terbentuk (ionik, kovalen, logam) dan kekuatannya.
- Penjelasan Sifat Periodik: Sifat seperti jari-jari atom, energi ionisasi, dan keelektronegatifan menunjukkan tren yang jelas dan dapat diprediksi dalam tabel periodik, semuanya berakar pada struktur atom.
Keterbatasan dalam Memahami Struktur Atom
Meski sangat berguna, penting untuk diingat bahwa model atom yang kita gunakan sehari-hari—dengan bola padat dan orbit melingkar—adalah sebuah analogi, bukan gambaran sebenarnya. Model ini, sering disebut model Bohr, adalah batu loncatan yang hebat, tetapi ia memiliki batasan serius ketika kita menyelami dunia yang sangat kecil, di mana hukum mekanika kuantum berkuasa. Pada skala ini, konsep intuitif kita tentang partikel dan gelombang menjadi kabur.
Batasan Model Klasik
Model atom klasik gagal menjelaskan beberapa perilaku elektron. Sebagai contoh, menurut fisika klasik, elektron yang bergerak melingkar mengelilingi inti akan terus-memancarkan energi dan akhirnya jatuh ke dalam inti, menyebabkan atom kolaps—sesuatu yang jelas tidak terjadi. Selain itu, model sederhana tidak dapat menjelaskan spektrum garis yang spesifik dari unsur-unsur atau mengapa elektron hanya dapat menempati tingkat energi tertentu yang diskrit (terkuantisasi).
Representasi Visual vs Realitas Kuantum, Kekurangan dan Kelebihan Atom
Gambar atom dengan inti dan elektron yang berputar pada orbit tertentu adalah penyederhanaan yang menyesatkan. Dalam realitas mekanika kuantum, kita tidak dapat mengetahui posisi dan momentum elektron secara bersamaan dengan kepastian mutlak (Prinsip Ketidakpastian Heisenberg). Sebaliknya, kita berbicara tentang orbital, yaitu wilayah tiga dimensi dengan probabilitas tertentu untuk menemukan elektron. Elektron lebih mirip awan probabilititas yang menyebar daripada bola padat yang bergerak pada jalur tetap.
Representasi visual yang statis tidak mampu menangkap sifat dualitas gelombang-partikel dan sifat probabilistik ini.
“Jika kamu pikir kamu memahami mekanika kuantum, maka kamu tidak memahaminya.”Richard Feynman. Pernyataan Feynman ini menggambarkan betapa paradoks dan tidak intuitifnya dunia subatomik, termasuk perilaku elektron dalam atom, jika dilihat dari kacamata pengalaman sehari-hari kita.
Aplikasi dan Dampak Pengetahuan tentang Atom: Kekurangan Dan Kelebihan Atom
Pengetahuan mendalam tentang struktur atom dan inti atom telah melahirkan revolusi teknologi dengan dampak yang mendalam bagi peradaban. Dari mengobati penyakit hingga memenuhi kebutuhan energi, kemampuan untuk memanipulasi dan memanfaatkan proses pada tingkat atom telah membuka pintu ke kemungkinan yang sebelumnya hanya ada dalam imajinasi. Aplikasi-aplikasi ini sering kali memanfaatkan dua aspek: energi yang tersimpan dalam inti atom, dan kemampuan untuk melacak atau memanipulasi atom dan isotop tertentu.
Pemanfaatan dalam Bidang Energi
Pemahaman tentang reaksi inti, khususnya fisi nuklir (pembelahan inti atom berat), adalah dasar dari reaktor nuklir. Ketika inti atom seperti Uranium-235 dibelah oleh neutron, ia melepaskan energi panas yang sangat besar dan neutron-neutron baru yang dapat memicu reaksi berantai. Panas ini kemudian digunakan untuk menghasilkan uap dan menggerakkan turbin pembangkit listrik. Prinsip ini memanfaatkan konversi langsung massa menjadi energi, seperti yang dijelaskan oleh persamaan Einstein yang terkenal, E=mc², memberikan sumber energi yang padat dan bebas emisi karbon selama operasi normal.
Penerapan dalam Bidang Kedokteran
Di dunia kedokteran, pengetahuan tentang atom dan isotop menyelamatkan jiwa dalam dua cara utama. Pertama, dalam pencitraan diagnostik seperti PET scan (Positron Emission Tomography), isotop radioaktif dengan waktu paruh pendek disuntikkan ke tubuh. Peluruhan isotop ini memancarkan partikel yang dapat dideteksi, memungkinkan dokter melihat aktivitas metabolisme sel-sel, sangat berguna untuk mendeteksi kanker dini. Kedua, dalam radioterapi, sinar radiasi berenergi tinggi (seperti sinar gamma) atau partikel seperti proton diarahkan secara presisi untuk menghancurkan sel-sel tumor dengan merusak DNA mereka, sementara berusaha meminimalkan dampak pada jaringan sehat di sekitarnya.
Perbandingan Aplikasi Teknologi Atom
| Bidang | Aplikasi Teknologi | Prinsip Kerja Singkat | Unsur/Isotop Kunci |
|---|---|---|---|
| Energi | Reaktor Nuklir | Memanfaatkan reaksi fisi berantai terkendali untuk menghasilkan panas dan listrik. | Uranium-235, Plutonium-239 |
| Kedokteran | Radioterapi & Pencitraan | Menggunakan radiasi untuk menghancurkan sel kanker atau isotop radioaktif sebagai pelacak metabolisme. | Kobalt-60, Teknesium-99m, Fluor-18 |
| Pertanian | Iradiasi dan Pemuliaan Tanaman | Sinar radiasi digunakan untuk membunuh bakteri pada makanan atau menyebabkan mutasi genetik yang menguntungkan pada bibit. | Sumber Cobalt-60 (sinar gamma) |
| Industri & Arkeologi | Penanggalan Radiokarbon | Mengukur peluruhan Karbon-14 yang tersisa dalam material organik untuk memperkirakan usia. | Karbon-14 |
Perbandingan dengan Model Partikel Lainnya
Untuk benar-benar menghargai keunikan atom, kita perlu menempatkannya dalam konteks skala partikel yang lebih luas. Atom bukanlah yang terkecil, tetapi ia menempati posisi khusus sebagai “batu bata” materi yang stabil. Memahami perbandingan skalanya membantu kita melihat mengapa dunia makroskopik yang kita alami memiliki sifat yang sangat berbeda dari dunia subatomik.
Skala Atom, Partikel Subatomik, dan Molekul

Source: z-dn.net
Atom berada di tengah-tengah hierarki ukuran. Partikel penyusunnya—proton, neutron, dan elektron—jauh lebih kecil. Sebagai gambaran, jika sebuah atom diperbesar seukuran stadion sepak bola, inti atomnya hanya sebesar kacang polong di tengah lapangan, sementara elektron mengisi seluruh volume stadion tersebut sebagai awan yang samar. Di sisi lain, molekul, yang terdiri dari dua atau lebih atom yang terikat, lebih besar dari atom tunggal.
Misalnya, sebuah molekul air (H₂O) jelas lebih besar dan lebih kompleks daripada atom hidrogen atau oksigen penyusunnya.
Kestabilan Atom
Keajaiban atom terletak pada kestabilannya. Proton yang bermuatan positif seharusnya saling tolak-menolak dengan kuat di dalam inti yang kecil. Namun, di dalam inti, bekerja gaya yang jauh lebih kuat, disebut gaya nuklir kuat, yang mengatasi tolakan elektromagnetik antara proton dan mengikat proton dengan neutron. Gaya ini hanya bekerja pada jarak yang sangat pendek, seukuran inti atom. Di luar inti, gaya elektromagnetik yang lebih lemah namun jangkauannya lebih panjang mengikat elektron ke inti.
Kombinasi unik ini menciptakan sebuah sistem yang stabil. Sebaliknya, partikel seperti neutron bebas di luar inti tidak stabil dan akan meluruh dalam waktu sekitar 15 menit.
Ilustrasi Ukuran Atom
Membayangkan ukuran atom memang menantang karena ia jauh di luar jangkauan indra kita. Bayangkan sehelai rambut manusia. Diameter rata-ratanya sekitar 100.000 nanometer. Satu nanometer sendiri adalah sepersejuta meter. Sebuah atom khas, seperti atom besi, memiliki diameter sekitar 0.2 nanometer.
Artinya, dalam satu helai rambut manusia, sekitar 500.000 atom besi bisa berjajar berdampingan. Atau, pikirkan tentang setetes air. Satu tetes kecil air mengandung sekitar 1.6 sextillion molekul air (itu adalah angka 1,6 diikuti oleh 21 nol), dan setiap molekul air terdiri dari 3 atom. Jadi, dalam sesuatu yang tampak sederhana dan kecil bagi kita, terdapat alam semesta aktivitas atom yang tak terbayangkan banyaknya.
Simpulan Akhir
Demikianlah, perjalanan menyusuri kekurangan dan kelebihan atom mengantar kita pada sebuah kesadaran yang dalam. Bahwa pengetahuan kita, bagaimanapun canggihnya, selalu berbatas dengan misteri yang lebih luas. Atom, dengan segala kesederhanaan model dan kompleksitas kuantumnya, mengajarkan kerendahan hati. Ia bukan akhir dari pencarian, melainkan pintu gerbang menuju labirin realitas yang tak pernah sepenuhnya bisa kita peta, namun selalu layak untuk kita kagumi dan pelajari, satu proton, satu elektron, pada satu waktu.
Jawaban yang Berguna
Apakah atom benar-benar tidak bisa dibagi lagi?
Istilah “atom” berasal dari kata Yunani yang berarti “tidak dapat dibagi”, namun secara ilmiah, atom memang dapat dibagi menjadi partikel subatomik seperti proton, neutron, dan elektron. Bahkan, partikel-partikel ini sendiri tersusun dari partikel yang lebih fundamental lagi seperti quark.
Bagaimana atom yang sebagian besar ruang kosong bisa membentuk benda yang padat dan keras?
Kepadatan dan kekerasan benda bukan karena partikel inti atom yang bersentuhan, melainkan akibat gaya tolak-menolak elektromagnetik antara awan elektron dari atom-atom yang berdekatan. Gaya ini yang mencegah kita “menembus” meja, meskipun secara teknis terdapat ruang kosong yang sangat besar di antara inti atom.
Apakah model atom yang kita pelajari di sekolah salah?
Tidak sepenuhnya salah, tetapi disederhanakan. Model seperti model Bohr memberikan fondasi pemahaman yang sangat berguna untuk kimia dasar. Namun, untuk memahami perilaku sebenarnya, terutama pada tingkat kuantum, diperlukan model yang lebih kompleks yang menggambarkan elektron sebagai awan probabilitas, bukan partikel yang mengorbit seperti planet.
Dapatkah kita melihat atom secara langsung?
Tidak dengan mata telanjang atau mikroskop cahaya biasa. Namun, dengan teknologi seperti Mikroskop Tunneling Pemindaian (STM) atau Mikroskop Gaya Atom (AFM), kita dapat “merasakan” atau memetakan permukaan material hingga tingkat atom, menghasilkan gambar yang merepresentasikan posisi atom-atom tersebut.