Mengenal Isomer Geometri Cis‑Trans itu ibarat belajar bahasa rahasia yang diucapkan oleh molekul-molekul di sekitar kita. Bayangkan sebuah tarian berpasangan yang elegan, di mana bagaimana posisi para penari saling berhadapan atau membelakangi ternyata bisa mengubah seluruh sifat dan cerita yang mereka bawakan. Nah, dalam dunia kimia, “penari” ini adalah gugus atom, dan posisi mereka di sekitar ikatan rangkap kaku itulah yang kita sebut isomer geometri cis dan trans.
Konsep yang mungkin terdengar teknis ini sebenarnya adalah dalang di balik banyak hal menakjubkan, mulai dari kenapa mentega dan margarin terasa berbeda di mulut, hingga bagaimana mata kita bisa menangkap cahaya dan menerjemahkannya menjadi penglihatan.
Perbedaan posisi yang tampak sederhana ini punya konsekuensi fisik dan kimia yang sangat nyata. Isomer cis, dengan gugus sejenis berada di sisi yang sama, seringkali membuat molekulnya bengkok. Sementara isomer trans, dengan gugus yang berseberangan, cenderung lebih lurus dan rapat. Perbedaan bentuk mendasar ini langsung berimbas pada titik leleh, kelarutan, hingga bagaimana molekul tersebut berinteraksi dengan tubuh kita atau digunakan dalam industri.
Dengan memahami dansa molekuler ini, kita bisa mengapa alam dan ilmuwan seringkali memiliki preferensi tertentu terhadap satu isomer dibanding yang lain.
Mengungkap Dansa Molekuler Cis dan Trans dalam Kehidupan Sehari-hari
Bayangkan sebuah pesta dansa di mana setiap pasangan penari mewakili sebuah molekul dengan ikatan rangkap. Dalam tarian kimia ini, ikatan rangkap itu bagai dua penari yang saling berpegangan tangan erat, tidak bisa berputar bebas. Posisi penari-penari lain (yang mewakili gugus fungsi atau atom) yang berdiri di samping mereka menjadi sangat penting. Jika kedua penari dengan baju merah, misalnya, berada di sisi yang sama dari pasangan penari utama, maka itu adalah tarian formasi cis.
Sebaliknya, jika satu penari baju merah ada di kiri dan yang lainnya di kanan, mereka membentuk formasi trans. Perbedaan posisi yang tampak sederhana ini ternyata menghasilkan dua koreografi molekul dengan sifat fisik dan kimia yang bisa sangat berbeda, layaknya dua lagu dengan irama yang bertolak belakang.
Konsep isomer geometri cis-trans ini adalah tentang bagaimana atom-atom tersusun dalam ruang di sekitar suatu ikatan yang kaku, seperti ikatan rangkap dua karbon-karbon atau ikatan koordinasi pada kompleks logam. Kekakuan ini mencegah rotasi, sehingga pengaturan spasial menjadi permanen dan melahirkan isomer-isomer yang unik. Dansa cis-trans ini bukan sekadar teori di laboratorium; ia adalah koreografi fundamental yang memengaruhi tekstur makanan yang kita kunyah, efektivitas obat yang kita telan, dan bahkan cara mata kita menangkap cahaya.
Karakteristik Fisik Isomer Cis dan Trans pada Senyawa Umum
Perbedaan tata ruang molekuler langsung berimbas pada sifat-sifat fisik yang dapat kita ukur. Isomer cis, dengan gugus sejenis berada pada sisi yang sama, cenderung membuat molekulnya memiliki bentuk bengkok atau seperti “V”. Bentuk ini mengurangi kemungkinan molekul untuk berkemas rapat dalam bentuk padat. Sementara itu, isomer trans, dengan gugusnya berseberangan, umumnya lebih linear dan rapi, memungkinkan pengepakan yang lebih efisien.
Kontras ini jelas terlihat pada pasangan asam lemak tak jenuh: asam oleat (cis) dan asam elaidat (trans).
| Karakteristik | Asam Oleat (Cis-9-oktadekenoat) | Asam Elaidat (Trans-9-oktadekenoat) | Konsekuensi Praktis |
|---|---|---|---|
| Titik Leleh | 13.4 °C (cair pada suhu ruang) | 44 °C (padat pada suhu ruang) | Minyak zaitun (kaya oleat) cair, margarin (mengandung elaidat) padat. |
| Titik Didih | ~360 °C (terurai) | ~360 °C (terurai) | Perbedaan titik didih tidak signifikan karena massa molekul sama. |
| Kelarutan dalam Pelarut Organik | Tinggi, bentuk bengkok mengganggu kristalisasi. | Agak lebih rendah, bentuk linear memudahkan kristalisasi. | Isomer cis lebih mudah tetap larut dalam campuran minyak. |
| Wujud pada Suhu Ruang (25°C) | Cairan berminyak | Padatan berminyak/kristalin | Perbedaan wujud inilah yang dimanfaatkan dalam industri pangan. |
Contoh Penerapan dalam Berbagai Bidang
Dansa cis-trans ini memiliki peran sentral dalam banyak aspek kehidupan modern. Dari dapur hingga apotek, geometri molekul menentukan pengalaman dan hasil akhir.
- Kuliner: Mentega alami mengandung asam lemak dengan konfigurasi cis, yang membuatnya lunak dan mudah meleleh di suhu ruang. Proses hidrogenasi parsial pada pembuatan margarin mengubah sebagian ikatan cis menjadi trans, menghasilkan lemak dengan titik leleh lebih tinggi yang tetap padat dan spreadable langsung dari lemari es.
- Farmasi: Aktivitas biologis suatu obat seringkali sangat bergantung pada bentuk geometrinya. Salah satu contoh klasik adalah obat cisplatin, yang digunakan dalam kemoterapi. Isomer cis-nya (dengan gugus amonia pada sisi yang sama) sangat aktif melawan kanker, sementara isomer trans-nya tidak efektif untuk tujuan tersebut.
- Material: Dalam industri polimer, keberadaan ikatan cis atau trans pada monomer seperti isoprena menentukan sifat karet alam. Poliisoprena dengan konfigurasi cis-1,4 menghasilkan karet yang elastis dan lentur (seperti pada ban), sedangkan konfigurasi trans-1,4 menghasilkan polimer yang lebih kaku seperti gutta-percha, yang dulu digunakan untuk bola golf atau isolasi kabel bawah laut.
Isomer Geometri dan Mekanisme Penglihatan
Proses melihat adalah sebuah drama biokimia yang diatur oleh perubahan isomer geometri. Molekul kunci di baliknya adalah retinal, turunan dari vitamin A yang terikat pada protein opsin di sel batang dan kerucut retina kita.
Ketika seberkas foton (cahaya) mengenai molekul 11-cis-retinal, energi tersebut menyebabkan isomerisasi cepat dari bentuk cis menjadi bentuk all-trans-retinal. Perubahan bentuk molekuler ini memicu kaskade sinyal seperti domino, mengubah konformasi protein opsin, yang akhirnya menghasilkan impuls listrik yang dikirim ke otak untuk diartikan sebagai “penglihatan”. Tanpa tarian cis-trans yang sensitif terhadap cahaya ini, retina kita tidak akan bisa mengubah energi cahaya menjadi bahasa saraf.
Resonansi Sejarah dari Pencetus hingga Penerapan Modern Isomer Geometri
Pemahaman bahwa molekul dengan rumus sama bisa memiliki sifat berbeda karena susunan atomnya telah lama menggelitik para kimiawan. Awalnya, perbedaan ini hanya dikaitkan dengan isomerisme struktural—perbedaan cara atom-atom terhubung. Namun, pada abad ke-19, muncul kasus-kasus membingungkan di mana dua senyawa memiliki struktur kerangka yang identik, tetapi sifatnya tetap berbeda. Fenomena ini membutuhkan lompatan konseptual: bahwa perbedaan bisa terjadi semata-mata dari bagaimana atom-atom itu tersusun dalam ruang di sekitar ikatan yang kaku, bahkan tanpa mengubah konektivitas dasarnya.
Perintis seperti J.H. van ‘t Hoff dan J.A. Le Bel pada 1874 mengusulkan teori tetrahedral untuk karbon, membuka pintu pemikiran tentang stereokimia. Namun, penerapan spesifik pada isomer geometri sekitar ikatan rangkap dan kompleks koordinasi membutuhkan waktu dan sosok yang mampu mensistematiskannya. Intuisi awal bahwa ada sesuatu yang “berbeda” dalam penataan ruang senyawa seperti asam maleat dan fumarat (keduanya C₄H₄O₄) akhirnya menemukan kerangka teorinya yang kokoh.
Dalam kimia organik, konsep isomer geometri cis-trans menunjukkan bagaimana susunan atom dalam ruang bisa menghasilkan sifat berbeda, meski rumus molekulnya sama. Prinsip ini mirip dengan cara kita melihat objek dari sudut berbeda; misalnya, saat Hitung Tinggi Pohon Cemara dari Sudut Pandang 30° , perspektif itu menentukan hasil pengukuran. Begitu pula, memahami isomer cis-trans memerlukan sudut pandang tiga dimensi yang tepat untuk membedakan konfigurasinya dengan akurat.
Tonggak Penting dalam Penemuan dan Penamaan
Perjalanan menuju pemahaman modern tentang isomer geometri diwarnai oleh observasi empiris yang kemudian mendapat penjelasan teoritis. Garis waktu berikut menyoroti momen-momen kunci yang membentuk konsep ini.
- 1830-an: Jöns Jacob Berzelius pertama kali memperkenalkan istilah “isomer” untuk senyawa dengan komposisi unsur sama tetapi sifat berbeda.
- 1849: Louis Pasteur memisahkan enantiomer asam tartarat secara manual, secara praktis mendemonstrasikan bahwa molekul bisa memiliki “kiralitas” atau sifat tangan kanan-kiri.
- 1874: Van ‘t Hoff dan Le Bel secara independen mengusulkan model tetrahedral untuk atom karbon, landasan untuk semua stereokimia organik.
- 1890: Alfred Werner, melalui studinya yang mendalam tentang kompleks koordinasi logam, secara tegas membuktikan dan mensistematiskan keberadaan isomer geometri cis dan trans pada senyawa seperti [Pt(NH₃)₂Cl₂].
- 1960-an: Robert S. Cahn, Christopher Kelk Ingold, dan Vladimir Prelog mengusulkan sistem prioritas Z/E yang lebih umum dan tidak ambigu untuk menamai isomer geometri di sekitar ikatan rangkap.
Kontributor Kunci di Luar Alfred Werner
Meski Werner sering disebut sebagai bapak penegas isomer geometri, ia berdiri di atas pundak para pemikir besar sebelumnya. Berikut adalah tiga kontributor penting yang pemikirannya membuka jalan.
J.H. van ‘t Hoff: “Jika empat afinitas atom karbon diarahkan ke sudut-sudut tetrahedron yang pusatnya ditempati oleh atom karbon, maka rumus-rumus yang diperoleh akan mewakili struktur ruang.” Pernyataannya ini menjadi fondasi untuk memahami bahwa substituen bisa menempati posisi ruang yang berbeda.
Louis Pasteur: “Kehidupan sebagaimana terwujud di bumi, dalam hubungannya dengan struktur molekul zat, adalah fungsi dari asimetri alam semesta.” Meski fokus pada kiralitas, pekerjaan pemisahannya membuktikan secara fisik bahwa perbedaan susunan ruang molekul adalah nyata dan memiliki konsekuensi besar, membuka pikiran komunitas ilmiah terhadap stereokimia.
Sophus Mads Jørgensen: “Saya telah menyiapkan serangkaian garam platinum yang tampaknya memiliki komposisi yang sama dengan yang disintesis oleh Werner, namun dengan sifat pelarutan yang berbeda.” Sebagai rival ilmiah Werner, Jørgensen secara tidak sengaja menyediakan banyak senyawa kompleks yang sifatnya membingungkan, yang justru menjadi bahan uji empiris yang mendorong Werner untuk menyusun teori koordinasinya yang lengkap, termasuk penjelasan untuk isomer geometri.
Evolusi Notasi: Dari Deskripsi Verbal ke Simbol Z/E
Seiring berkembangnya kompleksitas senyawa yang disintesis, sistem penamaan cis-trans tradisional mulai menunjukkan kelemahannya, terutama ketika keempat substituen di sekitar ikatan rangkap berbeda. Hal ini mendorong evolusi notasi menjadi sistem yang lebih sistematis dan universal.
| Era | Sistem Notasi | Cara Kerja | Contoh Sederhana |
|---|---|---|---|
| Awal – Pertengahan Abad 20 | Deskripsi Verbal Cis-Trans | Membandingkan posisi relatif dua gugus yang “serupa” atau “penting”. Bergantung pada identifikasi pasangan yang jelas. | Asam maleat (cis-butenedioat) dan asam fumarat (trans-butenedioat). |
| Pertengahan Abad 20 – Sekarang | Sistem Prioritas Cahn-Ingold-Prelog (Z/E) | Memberi prioritas pada setiap substituen di kedua ujung ikatan rangkap berdasarkan nomor atom. Z (zusammen) jika prioritas tinggi searah, E (entgegen) jika berseberangan. | Sebuah alkena dengan Br di satu sisi dan Cl di sisi lain, serta rantai alkil. Prioritas Br > Cl dan alkil > H menentukan konfigurasinya sebagai Z atau E, terlepas dari kesamaan gugus. |
Logika Tersembunyi di Balik Penamaan dan Notasi Isomer Geometri
Sistem penamaan cis-trans yang intuitif bekerja dengan baik selama kita berhadapan dengan ikatan rangkap yang memiliki dua substituen identik, atau setidaknya satu pasangan yang jelas untuk dibandingkan. Namun, kimia organik modern sering kali berurusan dengan molekul kompleks di mana keempat posisi di sekitar ikatan rangkap ditempati oleh atom atau gugus yang berbeda-beda. Dalam situasi seperti “siapa teman sebelah siapa” menjadi tidak jelas, dan istilah cis atau trans menjadi ambigu atau bahkan tidak dapat diterapkan.
Untuk mengatasi kebuntuan ini, diperlukan sebuah sistem penamaan yang objektif, berdasarkan aturan yang tidak memandang bulu.
Aturan Cahn-Ingold-Prelog (CIP) hadir sebagai solusi elegan. Sistem ini tidak lagi bertanya “apakah gugus yang serupa berada di sisi yang sama?”, melainkan “mana gugus dengan prioritas lebih tinggi di setiap ujung ikatan rangkap?”. Dengan menjawab pertanyaan ini melalui serangkaian aturan hierarkis, kita dapat menetapkan konfigurasi Z atau E secara tegas untuk setiap ikatan rangkap, terlepas dari kompleksitas molekulnya. Logika ini mirip dengan menentukan pemenang dalam pertandingan dengan membandingkan statistik pemain, bukan berdasarkan kesan subjektif.
Langkah-Langkah Sistematis Aturan Prioritas Cahn–Ingold–Prelog
Penentuan notasi Z/E mengikuti prosedur yang terstruktur. Pertama, identifikasi kedua atom karbon yang terlibat dalam ikatan rangkap. Untuk setiap karbon tersebut, lihat kedua atom yang langsung terikat padanya (selain pasangan ikatan rangkapnya). Prioritas ditentukan dengan membandingkan nomor atom dari atom-atom yang terikat langsung ini. Atom dengan nomor atom lebih tinggi mendapat prioritas lebih tinggi.
Misalnya, Br (nomor atom 35) > Cl (17) > S (16) > O (8) > N (7) > C (6) > H (1).
Jika terjadi seri—yaitu, dua atom yang terikat langsung identik—kita harus “melihat lebih jauh”. Kita membandingkan “rintisan” atau rantai yang dimulai dari atom-atom tersebut. Kita buat daftar nomor atom dari semua atom yang terikat pada titik persamaan itu, diurutkan dari tinggi ke rendah, dan bandingkan daftar ini leksikografis (seperti mengurutkan kata dalam kamus). Proses ini berlanjut hingga perbedaan ditemukan. Setelah prioritas untuk substituen di setiap ujung ikatan rangkap ditetapkan, kita periksa orientasinya.
Jika dua substituen dengan prioritas lebih tinggi berada pada sisi yang sama dari ikatan rangkap, konfigurasinya adalah Z (dari bahasa Jerman zusammen, berarti bersama). Jika mereka berseberangan, konfigurasinya adalah E ( entgegen, berarti berseberangan).
Demonstrasi pada Molekul Kompleks dengan Rantai Bercabang, Mengenal Isomer Geometri Cis‑Trans
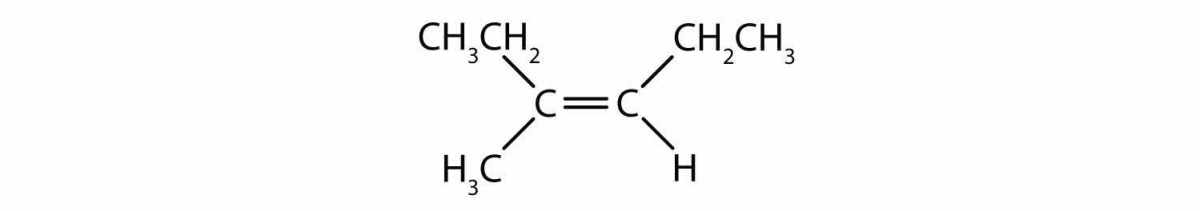
Mari terapkan aturan CIP pada sebuah molekul hipotetis dengan rumus CH₃-CH₂-C(Br)=C(Cl)-CH(CH₃)₂. Fokus pada ikatan rangkap antara dua atom karbon tengah.
- Langkah 1: Identifikasi ujung ikatan. Sebut saja karbon kiri (C1) dan karbon kanan (C2).
- Langkah 2: Tentukan prioritas di C1. Substituen di C1 adalah: -Br dan -CH₂CH₃. Atom yang terikat langsung: Br (nomor atom 35) vs. C (6). Jelas Br > C. Jadi, prioritas tinggi di C1 adalah -Br.
- Langkah 3: Tentukan prioritas di C2. Substituen di C2 adalah: -Cl dan -CH(CH₃)₂. Atom yang terikat langsung: Cl (17) vs. C (6). Jelas Cl > C. Jadi, prioritas tinggi di C2 adalah -Cl.
- Langkah 4: Tentukan konfigurasi. Prioritas tertinggi di setiap ujung adalah -Br (di kiri) dan -Cl (di kanan). Kita perlu melihat apakah mereka berada di sisi yang sama. Pada molekul ini, -Br dan -Cl berada pada sisi yang berseberangan dari ikatan rangkap (asumsikan rantai alkil lainnya melengkung ke arah yang berlawanan). Oleh karena itu, konfigurasinya adalah E.
Perbandingan Sistem Penamaan Cis-Trans dan Z/E
| Aspek | Sistem Cis-Trans (Tradisional) | Sistem Z/E (CIP, Modern) |
|---|---|---|
| Dasar Penentuan | Posisi relatif dua gugus yang “serupa” atau ditentukan secara subjektif. | Prioritas objektif berdasarkan nomor atom substituen di setiap ujung ikatan. |
| Jangkauan Aplikasi | Terbatas pada ikatan rangkap dengan setidaknya satu pasangan substituen identik. | Universal, dapat diterapkan pada semua ikatan rangkap, terlepas dari kesamaan substituen. |
| Keunggulan | Intuitif, mudah dipahami untuk molekul sederhana. Terkait langsung dengan sifat fisik (polaritas) pada beberapa kasus. | Tidak ambigu, sistematis, dan dapat mengatasi kompleksitas molekul dengan banyak substituen berbeda. |
| Batasan/Kekurangan | Menjadi ambigu atau tidak terdefinisi ketika keempat substituen berbeda. Bergantung pada identifikasi pasangan yang “penting”. | Kurang intuitif bagi pemula. Membutuhkan penerapan aturan prioritas yang bisa rumit untuk rantai kompleks. |
Ambiguitas Istilah Cis-Trans pada Tiga Substituen Berbeda
Bayangkan sebuah molekul sederhana di mana satu ujung ikatan rangkap C=C memiliki gugus metil (-CH₃) dan hidrogen (-H), sementara ujung lainnya memiliki gugus etil (-CH₂CH₃) dan sebuah atom klorin (-Cl). Dalam kasus ini, tidak ada pasangan substituen yang identik. Jika kita mencoba memaksa penamaan cis-trans, pertanyaannya menjadi: substituen mana yang harus dibandingkan? Apakah kita bandingkan metil dengan etil? Atau metil dengan klorin?
Atau hidrogen dengan klorin? Setiap pilihan bisa menghasilkan jawaban “cis” atau “trans” yang berbeda untuk molekul yang sama persis, yang jelas tidak dapat diterima. Inilah titik di mana sistem cis-trans mengalami kegagalan. Deskripsi verbal menjadi berbelit-belit dan tidak pasti. Sistem Z/E dengan aturan prioritasnya (Cl > C berdasarkan nomor atom; pada ujung lainnya, bandingkan atom yang terikat langsung: untuk -CH₃ adalah C, untuk -H adalah H, jadi -CH₃ > -H) akan memberikan satu jawaban yang jelas dan tidak terbantahkan: Z atau E.
Geometri yang Mengendalikan Reaksi Sintesis dan Biokatalisis
Dalam sintesis organik, tidak cukup hanya membuat molekul target dengan atom-atom yang terhubung dengan benar; seringkali kita juga harus mengendalikan tata ruangnya, termasuk konfigurasi cis atau trans di sekitar ikatan rangkap. Hasil reaksi yang menghasilkan campuran isomer biasanya tidak diinginkan karena memerlukan pemisahan yang sulit dan mengurangi efisiensi. Di sinilah peran katalis, khususnya katalis logam transisi, menjadi sangat penting. Katalis-katalis ini berfungsi seperti sutradara panggung molekuler, mengarahkan reaktan untuk bergabung dengan orientasi spasial tertentu, sehingga menghasilkan isomer geometri yang diinginkan dengan selektivitas tinggi.
Mekanisme kerja katalis logam transisi, seperti pada katalisis homogen dengan kompleks paladium atau rhodium, sering melibatkan pembentukan intermediat yang mengoordinasikan reaktan ke permukaan logam. Logam bertindak sebagai templat atau cetakan yang sementara, menahan reaktan dalam posisi dan geometri yang tepat sebelum reaksi berlangsung. Misalnya, dalam reaksi metatesis alkena yang diganjar Nobel, katalis logam membentuk kompleks siklik dengan dua molekul alkena, memaksa pertukaran ikatan rangkap terjadi dengan stereokimia tertentu, yang bisa diarahkan untuk menghasilkan produk cis atau trans.
Kemampuan mengendalikan stereokimia ini adalah hal yang membedakan sintesis modern yang elegan dari sintesis “brute force” di masa lalu.
Mekanisme dan Penentu Hasil Adisi Elektrofilik
Reaksi adisi elektrofilik klasik seperti adisi HBr atau Br₂ pada alkena sederhana sering menghasilkan campuran isomer geometris jika alkena awalnya tidak simetris atau jika mekanismenya melibatkan karbokation atau intermediat yang dapat berotasi. Faktor penentu isomer mana yang dominan bergantung pada kondisi reaksi dan mekanisme spesifik.
- Stabilitas Intermediat: Pada adisi HX melalui karbokation, produk akhir ditentukan oleh stabilitas karbokation yang terbentuk. Rotasi bebas di sekitar ikatan tunggal dalam karbokation memungkinkan pembentukan campuran cis dan trans dari alkena awal yang sama.
- Serangan Nukleofil: Setelah karbokation terbentuk, nukleofil (X⁻) dapat menyerang dari kedua sisi bidang karbokation, yang juga dapat menghasilkan campuran isomer.
- Adisi Sin vs Anti: Pada adisi halogen (Br₂) yang seringkali berjalan melalui ion bromonium siklik, nukleofil (Br⁻) menyerang dari sisi yang berlawanan (serangan anti), menghasilkan adisi stereospesifik. Jika alkena awalnya adalah cis, produknya adalah campuran enantiomer dengan konfigurasi tertentu (biasanya meso atau dl); jika trans, produknya akan berbeda.
- Pengarah Sterik dan Elektronik: Gaya tolakan antara gugus besar selama pendekatan reaktan dapat lebih menyukai pembentukan satu isomer di atas yang lain, terutama pada reaksi yang dikatalisis atau pada alkena tersubstitusi berat.
Pengaruh Isomer Geometri Substrat pada Reaksi Enzimatis
Enzim, sebagai katalis biologis, sangat sensitif terhadap stereokimia substratnya. Sebuah gugus fungsi yang berada pada posisi cis versus trans dapat berarti perbedaan antara cocok atau tidak cocok dengan situs aktif enzim, yang pada akhirnya menentukan apakah reaksi akan berjalan cepat, lambat, atau sama sekali tidak.
| Enzim/Reaksi | Substrat Cis | Substrat Trans | Pengaruh pada Kecepatan/Produk |
|---|---|---|---|
| Enzim Desaturase Asam Lemak | Asam stearat (tidak ada ikatan rangkap) | Asam elaidat (trans-Δ9) | Desaturase secara alami hanya mengenali konfigurasi tertentu dan hanya dapat memperkenalkan ikatan rangkap cis. Asam elaidat (trans) bukan substrat yang baik dan tidak akan di-desaturasi lebih lanjut oleh enzim ini. |
| Reaksi Diels-Alder (model enzimatik) | Diena dengan konfigurasi cisoid (s-cis) | Diena terkunci dalam konformasi transoid (s-trans) | Hanya diena dalam konformasi cisoid yang reaktif dalam sikloadisi Diels-Alder. Konformasi transoid sangat tidak reaktif, menunjukkan bagaimana geometri mengunci reaktivitas. |
| Oksidasi oleh Sitokrom P450 | Alkena siklik cis (misal, dalam steroid) | Alkena siklik trans analog | Enzim P450 memiliki preferensi kuat untuk mengoksidasi satu wajah (face) molekul. Perubahan dari cis ke trans dapat sepenuhnya mengubah orientasi molekul dalam situs aktif, mengarahkan oksidasi ke atom karbon yang berbeda atau menghambat reaksi. |
Kekakuan Konformasi dan Dampaknya pada Desain Obat
Ikatan rangkap dengan konfigurasi geometris tertentu tidak hanya menentukan bentuk molekul, tetapi juga “membekukan” atau membatasi konformasi yang dapat diadopsi oleh molekul tersebut. Dalam desain obat, sifat ini sangat berharga. Dengan memasukkan ikatan rangkap cis atau trans secara strategis, seorang ahli kimia medisinal dapat mengunci kerangka molekul obat dalam bentuk bioaktif yang tepat, meningkatkan potensinya untuk berikatan dengan reseptor target dan mengurangi kemungkinan mengadopsi konformasi tidak aktif.
Konsep kekakuan konformasi ini analog dengan menggunakan sebuah engsel yang terkunci versus engsel yang bebas berputar. Obat dengan engsel bebas (ikatan tunggal yang dapat berotasi) bisa membungkuk ke banyak bentuk, dan hanya sebagian kecil populasi molekul yang mungkin berada dalam bentuk yang tepat untuk berikatan dengan reseptor pada suatu waktu. Sebaliknya, obat dengan “engsel terkunci” (ikatan rangkap cis/trans) dipaksa untuk mempertahankan satu bentuk utama. Jika bentuk itu adalah bentuk yang aktif, maka hampir setiap molekul obat siap untuk berinteraksi, yang secara dramatis meningkatkan potensi dan selektivitas obat tersebut. Inilah mengapa analog struktural dengan ikatan rangkap sering digunakan untuk mengoptimalkan lead compound dalam penemuan obat.
Paradoks Stabilitas Ketika Cis Lebih Stabil daripada Trans: Mengenal Isomer Geometri Cis‑Trans
Aturan umum yang sering diajarkan adalah bahwa isomer trans lebih stabil daripada isomer cis karena tolakan sterik yang lebih kecil antara gugus-gugus besar yang berseberangan. Meski ini benar untuk banyak kasus, seperti pada 2-butena, alam penuh dengan pengecualian yang menarik. Stabilitas relatif antara cis dan trans adalah hasil pertarungan halus antara berbagai faktor energi, di mana tolakan sterik hanyalah satu pemain.
Dalam arena molekuler, faktor lain seperti momen dipol, kemampuan membentuk ikatan hidrogen intramolekul, dan tekanan cincin (ring strain) bisa mengubah keseimbangan kekuatan, terkadang membuat isomer cis justru menjadi pemenang yang lebih stabil.
Ketika dua gugus yang relatif besar dan polar berada pada sisi yang sama dalam isomer cis, memang terjadi tolakan sterik. Namun, pengaturan ini juga menciptakan momen dipol molekul yang signifikan. Dalam pelarut polar, interaksi yang menguntungkan antara dipol molekul dan pelarut (solvasi) dapat memberikan penstabilan energi yang cukup besar untuk mengimbangi bahkan mengatasi ketidakstabilan sterik. Lebih lanjut, jika gugus-gugus tersebut mengandung donor dan akseptor ikatan hidrogen, isomer cis memungkinkan terbentuknya ikatan hidrogen intramolekul yang kuat—sebuah interaksi penstabil yang tidak mungkin terjadi pada isomer trans karena jaraknya terlalu jauh.
Inilah yang terjadi pada senyawa seperti asam maleat.
Kasus Spesifik: Stabilitas Asam Maleat (Cis) atas Asam Fumarat (Trans)
Pasangan klasik asam maleat (cis-butenedioat) dan asam fumarat (trans-butenedioat) adalah contoh sempurna paradoks stabilitas. Secara sterik, asam fumarat dengan dua gugus karboksilat yang berseberangan seharusnya lebih stabil. Namun, dalam fase padat dan larutan tertentu, asam maleat menunjukkan sifat yang justru menunjukkan stabilitas unik karena faktor lain yang dominan.
- Ikatan Hidrogen Intramolekul: Pada asam maleat, dua gugus asam karboksilat yang berdekatan memungkinkan pembentukan ikatan hidrogen intramolekul yang sangat kuat, membentuk cincin beranggota enam yang stabil. Ikatan ini mengunci struktur dan menstabilkan isomer cis secara signifikan.
- Titik Leleh: Asam maleat memiliki titik leleh 130°C, jauh lebih rendah daripada asam fumarat (287°C). Titik leleh yang lebih rendah ini sering dikaitkan dengan struktur yang kurang simetris dan kepadatan pengepakan kristal yang lebih rendah, tetapi juga mencerminkan bahwa energi kisi kristal asam maleat lebih rendah karena stabilisasi internal dari ikatan hidrogen intramolekul sudah terjadi sebelum kristalisasi.
- Kekuatan Asam: Asam maleat adalah asam yang jauh lebih kuat (pKa1 ≈ 1.9) daripada asam fumarat (pKa1 ≈ 3.0). Hal ini karena setelah kehilangan proton pertama, anion maleat distabilkan secara ekstrem oleh ikatan hidrogen intramolekul yang sangat kuat antara gugus karboksilat terdeprotonasi dan gugus asam yang tersisa, sebuah fenomena yang tidak mungkin pada anion fumarat.
Kontribusi Energi Berbagai Faktor terhadap Stabilitas Total
Source: core2learn.org
Untuk memahami mengapa satu isomer lebih stabil, kita dapat memetakan kontribusi relatif dari berbagai sumber energi. Tabel berikut memberikan gambaran kualitatif untuk dua contoh yang telah dibahas.
| Faktor Energi | 2-Butena (Cis vs Trans) | Asam Maleat vs Fumarat (dalam fase gas/isolasi) |
|---|---|---|
| Tolakan Sterik | Menyukai Trans (gugus metil berseberangan). Kontribusi besar dan dominan. | Menyukai Fumarat (Trans). Namun, kontribusinya dikalahkan oleh faktor lain pada maleat. |
| Interaksi Dipol-Dipol | Minimal, kedua isomer hampir non-polar. | Pada Maleat (Cis), dipol besar menciptakan tolakan elektrostatik yang tidak menguntungkan. Menyukai Fumarat yang non-polar. |
| Ikatan Hidrogen Intramolekul | Tidak ada. | Menyukai Maleat (Cis) secara sangat signifikan. Menyediakan penstabilan energi besar (~20-30 kJ/mol) yang mengimbangi tolakan sterik dan dipol. |
| Energi Solvasi (dalam air) | Hampir sama. | Kompleks. Maleat mungkin lebih tersolvasi karena kepolaran dan kemampuan donor/akseptor ikatan H, menambah stabilitas relatifnya dalam larutan. |
Pengaraturan Ruang dalam Cincin Siklik
Dalam sistem siklik kecil seperti sikloalkena, geometri molekul dipaksa oleh kerangka cincin itu sendiri. Ambil contoh siklooktena (cincin 8 anggota). Untuk sebuah ikatan rangkap dalam cincin berukuran sedang seperti ini, isomer trans secara teoritis memiliki tolakan sterik yang sangat besar karena dua rantai alkil dari cincin harus berada pada sisi yang berlawanan dari bidang ikatan rangkap, menciptakan ketegangan torsional dan sudut yang parah di dalam cincin.
Isomer cis, di mana kedua bagian cincin berada pada sisi yang sama, justru lebih mudah diadopsi oleh cincin berukuran 8 atau lebih besar. Bayangkan sebuah pita yang dilipat membentuk lingkaran. Jika Anda memaksa kedua ujung pita untuk saling berhadapan (trans), pita akan sangat tertekuk dan tegang. Namun, jika Anda membiarkan kedua ujungnya searah (cis), pita dapat membentuk lingkaran yang lebih santai.
Pada siklooktena, isomer cis adalah satu-satunya yang stabil dan dapat diisolasi pada suhu kamar, sementara isomer trans-nya sangat reaktif dan sulit ditangkap karena tekanan cincin yang luar biasa besarnya. Paradoks ini menunjukkan bagaimana konteks molekuler—dalam hal ini, batasan geometri cincin—dapat sepenuhnya membalikkan ekspektasi stabilitas kita berdasarkan aturan sederhana.
Penutupan
Jadi, perjalanan mengenal isomer geometri cis-trans mengungkap bahwa di balik rumus kimia yang tampak statis, tersembunyi dunia dinamika dan preferensi spasial yang luar biasa. Dari intuisi awal para kimiawan hingga aturan prioritas CIP yang rumit, semua upaya itu menunjukkan betapa pentingnya “bentuk” dalam menentukan nasib sebuah molekul. Pemahaman ini bukan hanya sekadar teori di buku, melainkan kunci yang membuka pintu untuk merancang obat yang lebih manjur, material yang lebih unggul, dan memahami mekanisme kehidupan yang paling mendasar.
Pada akhirnya, cis dan trans mengajarkan kita bahwa terkadang, posisi adalah segalanya.
Daftar Pertanyaan Populer
Apakah isomer geometri cis-trans hanya ada pada senyawa dengan ikatan rangkap dua karbon-karbon (C=C)?
Tidak. Konsep ini paling umum dan mudah dipahami pada ikatan rangkap C=C, tetapi juga berlaku untuk ikatan rangkap antara atom lain seperti nitrogen (C=N dalam imina) dan pada senyawa kompleks logam transisi, khususnya kompleks koordinasi dengan geometri persegi datar atau oktahedral, di mana ligan-ligan dapat mengatur diri dalam posisi cis atau trans.
Mengapa sistem penamaan cis/trans dianggap tidak cukup dan perlu sistem Z/E?
Sistem cis/trans menjadi ambigu ketika keempat substituen di sekitar ikatan rangkap berbeda semua. Istilah “cis” (sama sisi) atau “trans” (berseberangan) jadi tidak jelas karena tidak ada dua gugus yang identik untuk dibandingkan. Sistem Z/E, berdasarkan prioritas atom, memberikan aturan yang jelas dan tidak ambigu untuk situasi kompleks seperti itu.
Bisakah isomer cis dan trans saling berubah menjadi satu sama lain dengan mudah?
Secara spontan pada suhu ruang, umumnya tidak. Untuk berubah, ikatan rangkap yang kaku harus diputar, dan ini membutuhkan energi yang sangat besar karena akan memutus ikatan pi yang kuat. Konversi biasanya memerlukan energi dari cahaya (fotoisomerisasi, seperti pada retinal di mata) atau katalis khusus, dan tidak terjadi dengan sendirinya.
Apakah semua senyawa dengan ikatan rangkap pasti memiliki isomer cis dan trans?
Tidak. Syarat utama adanya isomer geometri adalah bahwa masing-masing atom pada ikatan rangkap harus mengikat dua gugus yang berbeda. Jika salah satu atom karbon mengikat dua gugus yang sama, maka hanya ada satu bentuk geometri yang mungkin, sehingga isomer cis-trans tidak ada untuk senyawa tersebut.
Bagaimana pengaruh isomer geometri dalam dunia farmasi bisa sangat kritis?
Karena tubuh kita sangat spesifik. Reseptor dan enzim dalam tubuh dirancang untuk mengenali bentuk molekul tertentu dengan sangat tepat. Seringkali, hanya satu isomer (misalnya, cis atau trans) yang aktif secara farmakologis dan memberikan efek terapi, sementara isomer lainnya bisa tidak aktif atau bahkan menimbulkan efek samping yang berbahaya. Inilah mengapa sintesis isomer murni sangat penting dalam desain obat.


