Menghitung Massa Zat: Glukosa, Nitrogen, Metana, Gas N₂, SO₂ itu kayak lagi nge-hitung budget jalan-jalan di Malioboro, harus pas biar nggak boncos di tengah eksperimen. Semuanya serba harus tepat, mulai dari nimbang gula buat praktikum sampai ngitung polusi pabrik, soalnya kalau salah hitung bisa kacau balau urusannya.
Dunia kimia tuh nggak bisa lepas dari yang namanya massa molar dan mol, konsep yang jadi dasar buat segala jenis perhitungan, dari yang sederhana kayak nyiapin larutan glukosa sampai yang ribet kayak ngontrol emisi gas SO₂ di industri. Semua ini butuh ketelitian tinggi dan alat yang akurat, makanya paham cara hitung massa zat itu skill wajib buat yang berkecimpung di lab ataupun pabrik.
Konsep Dasar dan Pentingnya Menghitung Massa Zat: Menghitung Massa Zat: Glukosa, Nitrogen, Metana, Gas N₂, SO₂
Dalam dunia kimia, segala sesuatu bermula dari pengukuran yang akurat. Bayangkan seorang koki yang sedang membuat kue; jika takaran gram terigu atau gula tidak tepat, hasilnya bisa jauh dari harapan. Prinsip yang sama, namun dengan presisi yang jauh lebih tinggi, berlaku di laboratorium dan industri kimia. Fondasi dari semua perhitungan ini adalah pemahaman mendalam tentang mol dan massa molar.
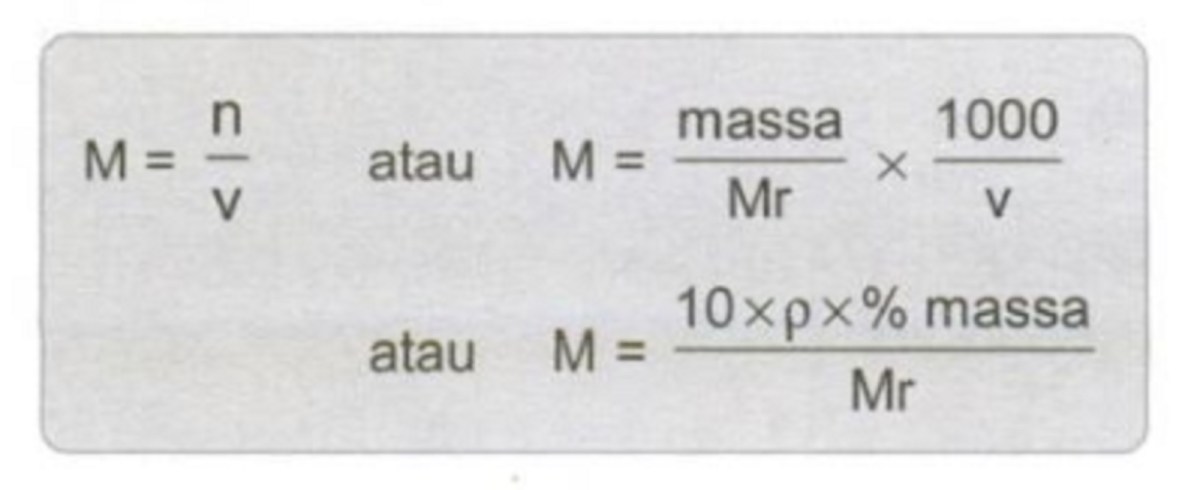
Massa molar adalah massa dari satu mol zat, yang dinyatakan dalam gram per mol (g/mol). Nilai ini secara numerik sama dengan massa atom relatif (Ar) untuk unsur atau massa molekul relatif (Mr) untuk senyawa. Konsep mol menghubungkan dunia mikroskopis atom dan molekul yang tak terlihat dengan dunia makroskopis yang dapat kita ukur dengan timbangan. Satu mol didefinisikan sebagai jumlah partikel yang setara dengan jumlah atom dalam tepat 12 gram karbon-12, yaitu sekitar 6.022 x 10²³ partikel (bilangan Avogadro).
Massa Molar dan Hubungannya dengan Mol
Hubungan antara mol (n), massa (m), dan massa molar (M) dirumuskan sebagai n = m / M. Rumus sederhana ini adalah pintu gerbang untuk menghitung berapa banyak zat yang terlibat dalam sebuah reaksi. Ketepatan perhitungan ini menentukan keberhasilan sebuah sintesis kimia, efisiensi proses industri, dan keamanan dalam penanganan bahan.
Aplikasi dalam Laboratorium dan Industri
Di laboratorium, seorang peneliti yang mensintesis obat baru harus menimbang prekursor dengan akurasi miligram untuk memastikan reaksi berjalan sempurna dan menghasilkan produk yang diinginkan. Sementara di industri, kesalahan perhitungan massa pada skala ton dapat berakibat pada kerugian finansial yang besar, produksi limbah berlebih, atau bahkan bahaya keselamatan. Pembuatan pupuk ammonia, misalnya, sangat bergantung pada perhitungan massa yang tepat antara gas nitrogen dan hidrogen untuk memaksimalkan hasil dan menghemat biaya.
Besaran dan Satuan Fundamental dalam Stoikiometri
Untuk memudahkan pemahaman hubungan antara berbagai besaran dalam stoikiometri, tabel berikut merangkum konversi utamanya.
| Besaran | Satuan | Konversi |
|---|---|---|
| Mol (n) | Mol | n = m / M |
| Massa (m) | Gram (g) | m = n x M |
| Jumlah Partikel | Partikel | Jumlah Partikel = n x N_A |
| Volume Gas pada STP* | Liter (L) | V = n x 22.4 L/mol |
*STP (Standard Temperature and Pressure): 0°C dan 1 atm tekanan.
Menghitung Massa Zat Tunggal (Unsur dan Senyawa)
Source: co.id
Setelah memahami konsep dasarnya, langkah selanjutnya adalah menerapkannya dalam perhitungan nyata. Proses ini melibatkan perhitungan massa dari mol, dan sebaliknya, serta penanganan zat dengan karakteristik berbeda.
Langkah Menghitung Massa Glukosa
Misalkan kita perlu menyiapkan 0.5 mol glukosa (C₆H₁₂O₆) untuk suatu eksperimen. Pertama, kita hitung massa molar glukosa: (6 x 12) + (12 x 1) + (6 x 16) = 180 g/mol. Selanjutnya, massa yang harus ditimbang adalah m = n x M = 0.5 mol x 180 g/mol = 90 gram. Sebaliknya, jika kita memiliki 360 gram glukosa, jumlah molnya adalah n = m / M = 360 g / 180 g/mol = 2 mol.
Menentukan Massa Gas Nitrogen dari Volumenya
Untuk menentukan massa gas nitrogen (N₂, M = 28 g/mol) yang volumenya diketahui, kita gabungkan hukum gas ideal dengan konsep mol. Pada kondisi ruang (25°C, 1 atm), volume molar bukan lagi 22.4 L/mol. Misal, volume gas N₂ adalah 12 L pada kondisi tersebut. Dengan menggunakan hukum gas ideal (PV = nRT), kita hitung mol N₂ terlebih dahulu, kemudian cari massanya dengan m = n x 28 g/mol.
Prinsip Menimbang Zat Berbeda
Teknik penimbangan sangat bergantung pada wujud zat. Berikut adalah poin-poin penting yang harus diperhatikan:
- Zat Padat: Gunakan kaca arloji atau botol timbang. Untuk zat higroskopis, gunakan botol timbang tertutup dan lakukan penimbangan secara cepat.
- Zat Cair: Massa dapat dihitung dari densitas dan volume (m = ρ x V). Gunakan pipet volumetrik atau labu ukur untuk volume yang akurat, lalu timbang wadahnya.
- Zat Gas: Sangat sulit ditimbang langsung. Umumnya, massanya dihitung secara tidak langsung dari volume, suhu, tekanan, dan massa molar menggunakan hukum gas ideal.
Menghitung Massa dalam Senyawa Hidrat dan Campuran
Tantangan dalam perhitungan massa menjadi lebih kompleks ketika zat yang kita hadapi bukan merupakan zat murni tunggal, tetapi berupa senyawa hidrat atau campuran dari berbagai komponen.
Menghitung Massa Air Kristal dalam Hidrat
Senyawa hidrat, seperti kobalt(II) klorida heksahidrat (CoCl₂·6H₂O), mengikat molekul air dalam struktur kristalnya. Untuk mengetahui massa air dalam sampel senyawa hidrat, pertama-tama hitung persentase massa air dalam senyawa hidrat tersebut. Mr CoCl₂·6H₂O = 58.93 + (2×35.45) + 6x[(2×1)+16] = 237.93 g/mol. Massa dari 6H₂O adalah 108 g/mol. Jadi, persentase air = (108 / 237.93) x 100% = 45.38%.
Jika kita memiliki 50 gram CoCl₂·6H₂O, maka massa air kristalnya adalah 45.38% x 50 g = 22.69 gram.
Tantangan dalam Menentukan Massa SO₂ dalam Campuran Gas
Mengukur massa sulfur dioksida (SO₂) dalam emisi cerobong asap pabrik adalah contoh nyata. Gas tersebut bercampur dengan nitrogen, oksigen, uap air, dan gas lainnya. Metode langsung dengan menimbang hampir mustahil. Solusinya adalah teknik pengambilan sampel dan analisis tidak langsung. Sampel gas dapat dialirkan melalui larutan penyerap seperti hidrogen peroksida, dimana SO₂ akan dioksidasi menjadi asam sulfat.
Massa SO₂ kemudian dapat dihitung dengan menitrasi asam sulfat yang terbentuk.
Rumus Praktis untuk Komponen Campuran, Menghitung Massa Zat: Glukosa, Nitrogen, Metana, Gas N₂, SO₂
Untuk memisahkan dan menghitung massa komponen dalam campuran, identifikasi sifat fisik atau kimia yang unik dari komponen target, seperti kelarutan, titik didih, atau reaktivitas terhadap pereaksi tertentu. Massa komponen dapat dihitung setelah pemisahan dan pemurnian, atau melalui metode analitis seperti spektrofotometri yang menghubungkan konsentrasi dengan serapan cahaya.
Aplikasi Perhitungan Massa dalam Reaksi Kimia
Inti dari stoikiometri adalah menerapkan perhitungan massa ke dalam reaksi kimia. Ini memungkinkan kita untuk memprediksi berapa banyak reaktan yang dibutuhkan atau berapa banyak produk yang akan dihasilkan.
Stoikiometri Reaksi Pembakaran Metana
Reaksi pembakaran sempurna metana: CH₄ + 2O₂ → CO₂ + 2H₂O. Jika kita ingin menghasilkan 90 gram air (Mr = 18 g/mol), kita mulai dengan menghitung mol air yang diinginkan: n H₂O = 90 g / 18 g/mol = 5 mol. Dari persamaan, untuk menghasilkan 2 mol H₂O dibutuhkan 1 mol CH₄. Jadi, untuk 5 mol H₂O dibutuhkan (5/2) = 2.5 mol CH₄.
Massa metana (Mr = 16 g/mol) adalah m = 2.5 mol x 16 g/mol = 40 gram.
Konsep Pereaksi Pembatas dalam Sintesis Amonia
Dalam reaksi sintesis amonia (Haber-Bosch): N₂ + 3H₂ → 2NH₃. Misalkan kita mencampur 28 gram N₂ (1 mol) dan 6 gram H₂ (3 mol). Secara stoikiometri, 1 mol N₂ membutuhkan 3 mol H₂. Ternyata kedua reaktan tepat habis bereaksi, tidak ada yang bersisa. Namun, jika kita mencampur 28 gram N₂ (1 mol) dengan 4 gram H₂ (~2 mol), maka H₂ adalah pereaksi pembatas karena jumlahnya kurang dari yang dibutuhkan oleh N₂ yang tersedia.
H₂ akan habis terlebih dahulu dan membatasi jumlah produk NH₃ yang dapat terbentuk.
Langkah-Langkah Stoikiometri Reaksi
Berikut adalah prosedur sistematis untuk menyelesaikan soal stoikiometri yang melibatkan massa.
| Langkah | Deskripsi | Contoh (CH₄ + 2O₂ → CO₂ + 2H₂O) |
|---|---|---|
| 1 | Tulis dan setarakan persamaan reaksi. | Persamaan sudah setara. |
| 2 | Konversi massa yang diketahui menjadi mol. | Diketahui massa CH₄ = 16 g. n CH₄ = 16 g / 16 g/mol = 1 mol. |
| 3 | Gunakan perbandingan koefisien untuk mencari mol zat yang ditanya. | Koefisien CO₂ : CH₄ = 1 : 1, jadi n CO₂ = 1 mol. |
| 4 | Konversi mol tersebut kembali ke massa. | m CO₂ = 1 mol x 44 g/mol = 44 gram. |
Teknik dan Alat Ukur dalam Penentuan Massa
Keakuratan semua perhitungan teoritis ini sangat bergantung pada ketepatan alat ukur yang kita gunakan. Pemilihan alat dan teknik yang tepat merupakan hal yang kritis.
Neraca Analitik dan Penimbangan Glukosa
Neraca analitik adalah alat utama untuk menimbang massa dengan ketelitian hingga 0.0001 gram. Prinsip kerjanya adalah mengkompensasi gaya gravitasi pada massa sampel dengan gaya elektromagnetik. Sebuah arus listrik yang sebanding dengan massa sampel diukur dan dikonversi menjadi pembacaan massa. Untuk menimbang 2.500 gram glukosa, neraca analitik memberikan hasil yang jauh lebih akurat dan presisi dibandingkan neraca kasar.
Perbandingan Pengukuran Massa Gas
Mengukur massa gas secara langsung sangat tidak praktis karena gas sangat ringan dan memenuhi wadahnya. Metode langsung akan melibatkan penimbangan sel gas yang bertekanan, yang berisiko dan rumit. Metode tidak langsung melalui pengukuran volume, suhu, dan tekanan (menggunakan hukum gas ideal) adalah metode yang jauh lebih umum, aman, dan mudah dilakukan di lapangan maupun laboratorium.
Pengukuran Massa SO₂ dalam Emisi Industri
Dalam monitoring emisi industri, massa SO₂ tidak diukur dengan menimbangnya. Sebuah alat yang disebut Continuous Emissions Monitoring System (CEMS) digunakan. Sampel gas dari cerobong asap dialirkan, dan SO₂ di dalamnya diukur dengan teknik spektrofotometri UV. Alat ini mengukur konsentrasi SO₂ berdasarkan serapan cahaya ultraviolet pada panjang gelombang tertentu. Dengan mengetahui laju alir volumetrik total gas buang, massa SO₂ per jam dapat dihitung secara real-time.
Prosedur Kalibrasi dan Faktor yang Mempengaruhi Ketepatan
Kalibrasi neraca dilakukan menggunakan massa standar yang telah disertifikasi. Faktor yang dapat mempengaruhi ketepatan pengukuran massa termasuk guncangan meja, aliran udara, muatan elektrostatik pada sampel, dan suhu lingkungan yang berfluktuasi. Selalu gunakan wadah timbang (seperti botol timbang) dan lakukan penimbangan dalam kondisi yang terkendali untuk meminimalisir kesalahan.
Ringkasan Terakhir
Jadi gitu, guys, ngitung massa zat itu sebenernya keren banget kalau udah paham polanya, kayak main puzzle yang pasangin mol, massa, dan volume. Dengan ngerti dasar-dasarnya, kita bisa ngatasi tantangan dari lab sampai ke industri, pastiin semuanya berjalan akurat dan nggak ada yang salah formula. Intinya, mahir ngitung massa bikin kita jadi lebih pede dan tepat dalam setiap langkah eksperimen maupun produksi.
Informasi FAQ
Apakah massa jenis mempengaruhi perhitungan massa gas?
Ya, sangat mempengaruhi. Massa jenis menghubungkan massa dengan volume gas. Untuk gas, jika diketahui volume dan massa jenisnya pada suhu dan tekanan tertentu, massanya dapat dihitung dengan rumus massa = massa jenis × volume.
Bagaimana cara menghitung massa jika yang diketahui adalah tekanan dan volume gas bukan pada STP?
Gunakan persamaan gas ideal, PV = nRT. Hitung dulu jumlah mol (n) dari data tekanan (P), volume (V), suhu (T), dan konstanta gas (R). Setelah mol didapat, kalikan dengan massa molar untuk mendapatkan massa zat.
Apakah ada perbedaan signifikan dalam menimbang zat cair yang mudah menguap seperti etanol?
Ya, sangat signifikan. Zat cair yang mudah menguap harus ditimbang dalam wadah tertutup untuk menghindari pengurangan massa akibat penguapan. Proses penimbangannya juga harus dilakukan dengan cepat untuk meminimalkan kesalahan.
Bagaimana mengkonversi ppm (part per million) suatu gas seperti SO₂ dalam udara menjadi massa?
Ppm volume sering dianggap setara dengan ppm massa untuk gas dalam kondisi tertentu. Untuk menghitung massa SO₂ dalam volume udara tertentu, konversi dulu ppm ke fraksi volume (dibagi 1.000.000), lalu hitung mol SO₂ dengan persamaan gas ideal, akhirnya konversi mol ke massa.
