Menghitung volume akhir larutan CaCl₂ 0,15 M 500 ml agar Cl⁻ 0,05 M – Menghitung volume akhir larutan CaCl₂ 0,15 M 500 ml agar Cl⁻ 0,05 M itu seperti menyelesaikan puzzle kimia yang bikin penasaran. Kita punya larutan awal, ada target konsentrasi ion klorida yang diinginkan, dan tugas kita adalah mencari seberapa banyak air yang harus ditambahkan. Ini bukan sekadar hitung-hitungan biasa, tapi tentang memahami bagaimana satu senyawa bisa melepaskan banyak ion dan bagaimana kita mengendalikan kerapatannya dalam larutan.
Pada dasarnya, perjalanan ini dimulai dari memahami apa yang kita miliki: 500 mL larutan kalsium klorida dengan konsentrasi 0,15 M. Setiap molekul CaCl₂ akan terurai sempurna di air menjadi satu ion kalsium dan dua ion klorida. Nah, dari situlah cerita dimulai. Kita akan menelusuri jumlah mol, bermain dengan prinsip kekekalan massa zat terlarut, dan akhirnya menemukan titik di mana larutan kita yang sudah diencerkan itu mencapai konsentrasi ion Cl⁻ tepat 0,05 M.
Seru, kan?
Memahami Permasalahan dan Konsep Dasar
Bayangkan kamu punya segelas air garam. Kekentalan atau keasinan air itu bisa kita ukur dengan konsep molaritas. Molaritas (M) itu pada dasarnya adalah konsentrasi yang menunjukkan berapa mol zat terlarut dalam setiap liter larutan. Jadi, kalau kita bilang larutan CaCl₂ 0,15 M, artinya dalam setiap 1 liter larutan tersebut, terdapat 0,15 mol senyawa kalsium klorida. Ini adalah kunci untuk menghubungkan antara volume larutan yang kita lihat dengan jumlah partikel zat (mol) yang tidak terlihat.
Nah, di sini ada twist menarik. Saat CaCl₂ dilarutkan dalam air, ia terurai sempurna menjadi ion-ionnya: satu ion Ca²⁺ dan dua ion Cl⁻. Inilah beda utama antara molaritas senyawa dan molaritas ion. Molaritas CaCl₂ tadi adalah 0,15 M, tetapi molaritas ion Cl⁻ menjadi dua kali lipatnya, yaitu 0,30 M, karena setiap molekul CaCl₂ melepaskan 2 ion Cl⁻. Koefisien stoikiometri inilah pengalinya.
Dalam soal kita, kita punya 500 mL larutan CaCl₂ 0,15 M. Targetnya, kita ingin mengubah larutan ini sehingga konsentrasi ion kloridanya (Cl⁻) saja yang menjadi 0,05 M. Pertanyaannya, berapa volume akhir larutan setelah diencerkan? Untuk memvisualisasikan perubahan sebelum dan sesudah pengenceran, tabel berikut bisa membantu.
| Parameter | Sebelum Pengenceran | Setelah Pengenceran | Keterangan |
|---|---|---|---|
| Molaritas CaCl₂ | 0,15 M | Menurun | Bukan target akhir, tapi berkurang karena pengenceran. |
| Molaritas Cl⁻ | 0,30 M | 0,05 M (target) | Target utama yang ingin dicapai. |
| Volume Larutan | 500 mL (0,5 L) | Bertambah (V₂) | Volume akhir inilah yang akan kita cari. |
| Mol Cl⁻ | Tetap | Tetap | Prinsip kekekalan massa, jumlah partikel Cl⁻ tidak bertambah atau berkurang, hanya diencerkan. |
Konsep Mol dan Disosiasi Ion
Inti dari perhitungan kimia semacam ini selalu bermuara pada pemahaman tentang mol. Mol adalah jembatan antara dunia mikroskopis (jumlah partikel) dan dunia makroskopis (yang bisa kita ukur di lab). Ketika kita mengetahui volume dan molaritas, kita langsung bisa mengakses informasi tentang jumlah mol zat terlarut. Dari situlah segalanya dimulai.
Perbedaan antara konsentrasi senyawa dan ion menjadi krusial. Menganggap molaritas CaCl₂ sama dengan molaritas Cl⁻ adalah kesalahan umum yang bisa menggagalkan perhitungan. Selalu ingat untuk mengalikannya dengan jumlah ion yang dihasilkan. Untuk senyawa AlCl₃ misalnya, faktor pengalinya akan lebih besar lagi.
Contoh: Dalam 1 L larutan AlCl₃ 0,1 M, terdapat 0,1 mol AlCl₃. Karena setiap AlCl₃ terdisosiasi menjadi Al³⁺ dan 3 Cl⁻, maka mol ion Cl⁻ yang dihasilkan adalah 0,1 mol × 3 = 0,3 mol. Jadi, molaritas Cl⁻ dalam larutan awal tersebut adalah 0,3 M.
Menghitung Kondisi Awal Larutan
Mari kita mulai dari apa yang kita punya. Kita memegang 500 mL larutan CaCl₂ dengan konsentrasi 0,15 M. Langkah pertama adalah menghitung berapa sebenarnya “modal” zat yang kita miliki, dalam bentuk mol. Ini seperti menghitung berapa banyak bahan baku sebelum kita mulai mengolahnya.
Perhitungan mol awal CaCl₂ sangat straightforward: Molaritas dikali Volume dalam Liter. Setelah itu, kita konversi menjadi mol ion Cl⁻ dengan mengalikan dua, karena setiap unit CaCl₂ memberikan dua unit Cl⁻. Berikut langkah-langkah rincinya.
- Volume larutan awal: V₁ = 500 mL = 0,5 L.
- Molaritas CaCl₂ awal: M₁ = 0,15 M.
- Mol CaCl₂ awal = M₁ × V₁ = 0,15 mol/L × 0,5 L = 0,075 mol.
- Karena setiap CaCl₂ → Ca²⁺ + 2Cl⁻, maka mol Cl⁻ awal = 2 × mol CaCl₂ = 2 × 0,075 mol = 0,15 mol.
Jadi, di dalam labu atau gelas ukur berisi 500 mL larutan itu, sebenarnya bersemayam 0,15 mol ion klorida. Jumlah inilah yang akan kita jaga tetap konstan selama proses pengenceran. Tidak ada ion Cl⁻ yang hilang atau muncul tiba-tiba; kita hanya akan menambahkan pelarut (air) untuk “merenggangkan” kerapatannya.
Ilustrasi Perhitungan untuk Senyawa Lain
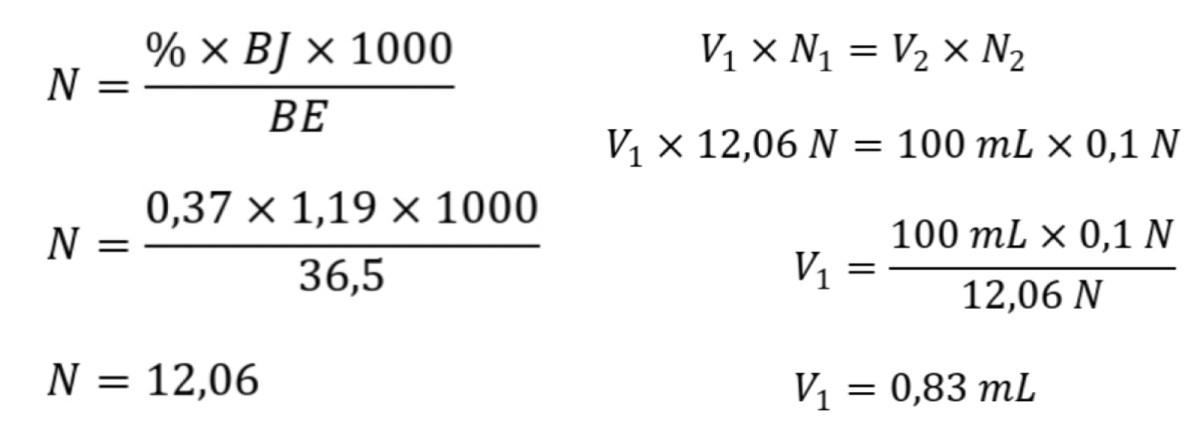
Source: googleusercontent.com
Logika yang sama berlaku universal untuk senyawa ionik apa pun. Ambil contoh garam magnesium bromida, MgBr₂. Jika kamu memiliki 250 mL larutan MgBr₂ 0,4 M, berapa mol ion Br⁻ yang ada? Pertama, hitung mol MgBr₂: 0,4 M × 0,25 L = 0,1 mol. Karena setiap MgBr₂ melepaskan 2 ion Br⁻, maka mol Br⁻ adalah 0,2 mol.
Polanya selalu sama: hitung mol senyawa, lalu kalikan dengan jumlah ion yang diminta dalam rumus kimia.
Merancang dan Melakukan Perhitungan Pengenceran
Kini kita masuk ke jantung persoalan. Kita sudah punya “modal” 0,15 mol ion Cl⁻. Kita ingin konsentrasi akhir ion Cl⁻ ini menjadi 0,05 M. Ingat rumus dasar molaritas: M = mol / V. Jika M kita targetkan dan mol kita sudah tahu, maka V (volume akhir) dengan mudah dapat ditemukan.
Prinsip kekekalan jumlah mol zat terlarut sebelum dan sesudah pengenceran adalah panduan utamanya.
Rumusnya sederhana: Mol Cl⁻ awal = Mol Cl⁻ akhir. Karena Mol = M × V, maka:
(M × V) Cl⁻ awal = (M × V) Cl⁻ akhir.
Namun, hati-hati: M Cl⁻ awal bukan 0,15 M (itu M CaCl₂), melainkan 0,30 M. Jadi perhitungannya menjadi:
Mol Cl⁻ tetap → (0,30 M) × (0,5 L) = (0,05 M) × V₂
,15 mol = 0,05 M × V₂
V₂ = 0,15 mol / 0,05 M = 3 L atau 3000 mL.
Jadi, volume akhir larutan setelah pengenceran haruslah 3 liter. Artinya, kita perlu menambahkan air ke dalam 500 mL larutan awal kita hingga total volumenya mencapai 3000 mL. Penambahan airnya adalah 3000 mL – 500 mL = 2500 mL.
Nah, hitung-hitungan volume akhir larutan CaCl₂ 0,15 M 500 ml biar konsentrasi Cl⁻ jadi 0,05 M itu seru, lho! Butuh logika dan sedikit feeling, kayak lagi nebak Berapa Banyak Rambutan Dimakan Rangga dalam cerita. Setelah dapat insight dari sana, balik lagi ke lab: intinya kita perlu pengenceran sampai volume akhir tertentu agar ion klorida nya pas sesuai target.
Gampang, kan?
| Variabel | Nilai | Keterangan |
|---|---|---|
| Mol Cl⁻ Awal | 0,15 mol | Diperoleh dari perhitungan awal. |
| Konsentrasi Cl⁻ Target (M₂) | 0,05 M | Kondisi yang diinginkan. |
| Volume Akhir (V₂) | 3 L (3000 mL) | Hasil perhitungan. |
| Volume Air yang Ditambahkan | 2500 mL | V₂
|
Perbandingan Metode Penyelesaian
Ada dua jalan yang bisa ditempuh untuk sampai pada jawaban yang sama, dan memahami keduanya akan memperdalam insight kamu.
- Metode Konsep Mol (seperti di atas): Metode ini sangat fundamental. Kita hitung dulu jumlah mol zat yang tidak berubah (mol Cl⁻), lalu gunakan target konsentrasi untuk mencari volume akhir. Metode ini sangat kuat karena langsung menyentuh esensi persoalan dan hampir mustahil salah jika langkah disosiasi ion sudah benar.
- Metode Rumus Pengenceran “Cepat”: Beberapa orang langsung menggunakan M₁V₁ = M₂V₂. Tapi sekali lagi, perhatian! M₁ dan M₂ di sini harus merujuk pada spesies yang sama. Jika kita mau pakai rumus ini untuk ion Cl⁻, maka M₁ adalah molaritas Cl⁻ awal (0,30 M), V₁ adalah volume larutan awal (0,5 L), M₂ adalah 0,05 M, dan V₂ yang dicari. Hasilnya akan persis sama: (0,30)(0,5) = (0,05)(V₂) → V₂ = 3 L.
Kesalahan fatal terjadi jika M₁ yang digunakan adalah 0,15 M (molaritas CaCl₂).
Kedua metode sah-sah saja, tetapi metode konsep mol seringkali lebih aman karena memaksa kita untuk memikirkan apa yang sebenarnya ada di dalam larutan.
Prosedur Praktikum dan Validasi Hasil
Teori sudah, sekarang praktek. Bagaimana cara mewujudkan ini di laboratorium? Kamu akan membutuhkan alat ukur volume yang presisi, karena akurasi hasil sangat bergantung padanya. Gelas ukur 500 mL dan 1000 mL mungkin bisa digunakan, tetapi untuk hasil terbaik, penggunaan labu takar (volumetric flask) 3 L adalah pilihan ideal. Labu takar didesain khusus untuk menghasilkan volume yang sangat akurat.
Prosedur singkatnya: Pindahkan seluruh 500 mL larutan CaCl₂ 0,15 M awal ke dalam sebuah wadah yang cukup besar (atau labu takar 3 L jika ada). Kemudian, tambahkan air destilasi atau air deionisasi secara bertahap sambil dihomogenkan, hingga tanda batas 3 liter pada labu takar tercapai. Jika menggunakan gelas ukur, tambahkan kurang lebih 2500 mL air. Ingat, selalu tambahkan pelarut ke zat terlarut, bukan sebaliknya, untuk menghindari percikan atau panas berlebih yang tidak perlu.
Faktor yang Mempengaruhi Akurasi, Menghitung volume akhir larutan CaCl₂ 0,15 M 500 ml agar Cl⁻ 0,05 M
Beberapa hal praktis perlu diwaspadai. Ketelitian pembacaan meniskus pada alat ukur, suhu larutan (karena volume bisa sedikit berubah dengan suhu), dan kebersihan alat dari kontaminan adalah faktor kunci. Penggunaan pipet volumetrik untuk memindahkan larutan awal akan lebih baik daripada gelas ukur. Selalu pastikan larutan benar-benar homogen sebelum digunakan untuk keperluan berikutnya.
Verifikasi dengan Titrasi Argentometri (Metode Mohr)
Bagaimana kita tahu pengenceran kita sudah tepat? Salah satu cara klasik dan terpercaya adalah dengan titrasi argentometri, khususnya metode Mohr untuk menentukan kadar klorida. Prinsipnya, kita akan menitrasi larutan hasil pengenceran kita (yang seharusnya 0,05 M Cl⁻) dengan larutan standar perak nitrat (AgNO₃) misalnya 0,1 M, menggunakan kalium kromat (K₂CrO₄) sebagai indikator.
Ion Ag⁺ dari titran akan bereaksi dengan ion Cl⁻ membentuk endapan putih AgCl. Setelah semua Cl⁻ habis diendapkan, kelebihan sedikit saja ion Ag⁺ akan bereaksi dengan ion CrO₄²⁻ dari indikator membentuk endapan berwarna bata merah (Ag₂CrO₄). Titik warna merah bata inilah yang menandai akhir titrasi.
Secara teoritis, untuk menguji 25 mL larutan kita (0,05 M Cl⁻), dibutuhkan volume AgNO₃ 0,1 M sebanyak: Mol Cl⁻ = 0,025 L × 0,05 M = 0,00125 mol. Karena reaksi 1:1 (Ag⁺ + Cl⁻ → AgCl), maka mol AgNO₃ juga 0,00125 mol. Volume AgNO₃ = mol / M = 0,00125 mol / 0,1 M = 0,0125 L atau 12,5 mL.
Jika volume titran yang kita dapatkan mendekati 12,5 mL, maka konsentrasi Cl⁻ kita valid.
Di meja lab, kamu akan melihat rangkaian alat titrasi: buret berisi larutan AgNO₃ berwarna jernih, labu Erlenmeyer berisi sampel larutan kita yang juga jernih ditambah beberapa tetes indikator K₂CrO₄ berwarna kuning. Selama titrasi, endapan putih AgCl akan terbentuk tetapi larutan tetap berwarna kuning. Mendekati titik akhir, endapan putih semakin banyak. Tiba-tiba, setelah satu tetes terakhir AgNO₃, warna kuning larutan berubah menjadi oranye kemerahan yang persisten karena terbentuk Ag₂CrO₄.
Itulah momen yang ditunggu.
Aplikasi dan Variasi Soal Terkait: Menghitung Volume Akhir Larutan CaCl₂ 0,15 M 500 ml Agar Cl⁻ 0,05 M
Konsep ini bukan cuma untuk CaCl₂. Ini adalah pola pikir yang digunakan di segala penjuru kimia analitik dan preparatif. Untuk mengasah kemampuan, coba terapkan pada senyawa-senyawa dengan rumus yang berbeda. Perubahan koefisien stoikiometri ion akan langsung mengubah “faktor pengali” dalam perhitungan mol ion, yang pada akhirnya mempengaruhi volume akhir pengenceran.
Nah, ngitung volume akhir larutan CaCl₂ 0,15 M 500 ml biar konsentrasi Cl⁻ jadi 0,05 M itu sebenarnya soal pengenceran. Prinsip dasarnya mirip kayak memahami Dimensi Satuan Kerja, Usaha, dan Energi —semua butuh analisis satuan dan hubungan yang tepat. Jadi, setelah paham konsep dasarnya, kamu bisa langsung aplikasikan rumus M₁V₁ = M₂V₂ untuk mencari volume akhir yang dibutuhkan dengan lebih percaya diri.
Misalnya, untuk senyawa yang melepaskan 3 ion seperti Na₃PO₄, molaritas ion fosfat (PO₄³⁻) akan sama dengan molaritas senyawanya, tetapi molaritas ion natrium (Na⁺) akan tiga kali lipat. Ini berarti jika target pengenceran adalah mengatur konsentrasi ion Na⁺, perhitungannya akan lebih “ekstrem” karena faktor pengali yang besar.
Berikut tiga contoh variasi soal untuk latihan. Coba hitung volume akhir pengenceran jika larutan awal 200 mL diencerkan hingga konsentrasi ion tertentu.
| Senyawa Awal (200 mL) | Molaritas Awal | Ion Target | Konsentrasi Ion Target | Volume Akhir (Hasil) |
|---|---|---|---|---|
| MgBr₂ | 0,2 M | Br⁻ | 0,05 M | 1600 mL (1,6 L) |
| Na₃PO₄ | 0,1 M | Na⁺ | 0,04 M | 1500 mL (1,5 L) |
| Al₂(SO₄)₃ | 0,05 M | SO₄²⁻ | 0,01 M | 1500 mL (1,5 L) |
Penerapan nyata konsep ini sangat luas. Di laboratorium klinis, farmasi, atau industri makanan, para analis selalu bekerja dengan larutan stok pekat yang kemudian diencerkan ke berbagai konsentrasi kerja sesuai kebutuhan analisis atau formulasi. Membuat buffer fosfat untuk kultur sel, larutan standar untuk kalibrasi instrument, atau sediaan obat dengan dosis tertentu—semuanya bermula dari perhitungan molaritas dan pengenceran yang tepat seperti ini.
Kemampuan ini adalah salah satu keterampilan paling fundamental dan powerful yang akan selalu kamu gunakan.
Ringkasan Penutup
Jadi, setelah semua tahap dilalui, angka akhirnya telah ditemukan. Proses menghitung volume akhir larutan CaCl₂ ini lebih dari sekadar menjawab soal; ini adalah latihan fundamental dalam menguasai bahasa larutan. Konsep yang diterapkan di sini—mulai dari stoikiometri ion hingga prinsip pengenceran—adalah senjata pamungkas yang akan sangat berguna, baik di meja laboratorium saat menyiapkan reagen maupun di dunia industri yang presisi. Intinya, sekali paham, kita bisa menaklukkan berbagai variasi soal serupa dengan percaya diri.
Bagian Pertanyaan Umum (FAQ)
Apakah hasil perhitungan ini akurat di dunia nyata?
Tidak sepenuhnya. Perhitungan ini mengasumsikan disosiasi sempurna dan pengenceran ideal. Dalam praktiknya, akurasi alat ukur volume (seperti gelas ukur atau labu takar) dan suhu lingkungan dapat memengaruhi hasil akhir.
Mengapa kita fokus pada ion Cl⁻, bukan CaCl₂-nya langsung?
Karena soal secara spesifik menargetkan konsentrasi ion klorida (Cl⁻). Satu molekul CaCl₂ menghasilkan dua ion Cl⁻, sehingga konsentrasi ion Cl⁻ selalu dua kali lipat konsentrasi CaCl₂-nya dalam larutan yang sama.
Bisakah rumus pengenceran biasa (M₁V₁ = M₂V₂) digunakan langsung di sini?
Tidak bisa langsung. Rumus M₁V₁ = M₂V₂ berlaku untuk zat terlarut yang sama. Di sini, “zat terlarut” yang kita jaga jumlah molnya adalah ion Cl⁻, bukan CaCl₂. Jadi, kita harus menghitung molaritas Cl⁻ awal terlebih dahulu (0,30 M) baru menerapkan rumus tersebut: (0,30 M)
– (0,5 L) = (0,05 M)
– V₂.
Apa yang terjadi jika larutan awal bukan CaCl₂ tapi AlCl₃?
Perhitungan akan berubah total! Karena AlCl₃ melepaskan tiga ion Cl⁻, maka konsentrasi Cl⁻ awal akan tiga kali lipat konsentrasi AlCl₃. Untuk mencapai target Cl⁻ yang sama, volume air yang dibutuhkan akan jauh lebih banyak dibandingkan dengan menggunakan CaCl₂.
Bagaimana cara memastikan konsentrasi Cl⁻ benar-benar sudah 0,05 M setelah pengenceran?
Di lab, konsentrasi ion Cl⁻ dapat diverifikasi melalui metode titrasi, misalnya titrasi Argentometri (metode Mohr) menggunakan larutan perak nitrat (AgNO₃) sebagai titran dan kalium kromat (K₂CrO₄) sebagai indikator. Terbentuknya endapan merah bata menandai titik akhir titrasi.