Metode Memisahkan Alkohol dan Garam dari Larutan Air menjadi sorotan utama dalam dunia kimia industri, karena kemampuan memisahkan komponen berharga dengan efisiensi tinggi menyentuh berbagai sektor, mulai dari produksi minuman hingga pengolahan limbah kimia. Penelitian terbaru mengungkapkan bahwa kombinasi teknik tradisional dan inovatif dapat mempercepat proses pemisahan, sekaligus menurunkan biaya operasional.
Berbagai metode seperti distilasi sederhana, ekstraksi cair‑cair, kristalisasi, hingga nanofiltrasi memanfaatkan perbedaan polaritas, titik didih, dan kelarutan masing‑masing zat. Setiap pendekatan memiliki keunggulan tersendiri, misalnya distilasi menargetkan pemisahan berbasis volatilitas, sementara nanofiltrasi mengandalkan membran selektif untuk memisahkan ion garam dari molekul alkohol. Pilihan metode yang tepat bergantung pada faktor suhu, tekanan, serta pertimbangan keselamatan dan dampak lingkungan.
Prinsip Dasar Pemisahan Alkohol dan Garam dalam Larutan Air
Pemisahan alkohol (misalnya etanol) dari garam (seperti natrium klorida) dalam larutan air dapat dilakukan karena ketiga komponen memiliki sifat fisik yang berbeda. Memahami perbedaan ini menjadi dasar bagi semua metode pemisahan yang dibahas selanjutnya.
Mekanisme Perbedaan Sifat Fisik
Alkohol adalah senyawa polar‑non‑ionik yang larut baik dalam air, namun memiliki titik didih yang jauh lebih rendah dibandingkan air. Garam adalah senyawa ionik yang tidak menguap pada suhu kamar dan larut sangat baik dalam air karena interaksi ion‑dipol. Air sendiri bersifat polar dengan titik didih 100 °C dan menjadi medium pelarut utama.
Faktor‑Faktor yang Mempengaruhi Proses
- Polaritas: alkohol lebih sedikit polar dibandingkan air, sehingga dapat dipisahkan melalui perubahan fase.
- Titik didih: selisih titik didih antara alkohol (≈78 °C) dan air memungkinkan distilasi.
- Kelarutan: garam tidak larut dalam pelarut organik non‑polar, sehingga dapat diekstraksi secara selektif.
Aplikasi Industri
Industri minuman beralkohol menggunakan distilasi untuk meningkatkan kadar etanol, sementara industri kimia memanfaatkan ekstraksi pelarut untuk memisahkan produk reaksi yang mengandung garam.
Tabel Perbandingan Sifat Fisik
| Sifat | Alkohol (Etanol) | Garam (NaCl) | Air |
|---|---|---|---|
| Polaritas | Polar‑non‑ionik | Ionik | Polar |
| Titik Didih (°C) | 78,4 | — (tidak menguap) | 100 |
| Kelarutan dalam Air (g/100 mL, 25 °C) | 85,5 | 35,9 | — |
| Kelarutan dalam Pelarut Non‑Polar (misal heksana) | Sangat rendah | Sangat rendah | Sangat rendah |
Ilustrasi Skematik Interaksi Molekul
Bayangkan sebuah wadah berisi campuran air, etanol, dan ion Na⁺/Cl⁻. Molekul air membentuk jaringan ikatan hidrogen yang kuat, sementara etanol berikatan sebagian melalui gugus –OH‑nya. Ion garam berinteraksi secara elektrostatik dengan kutub positif dan negatif air, sehingga tetap terdispersi secara homogen. Pada pemanasan, energi cukup untuk memutus ikatan hidrogen etanol‑air, memungkinkan etanol menguap lebih dulu.
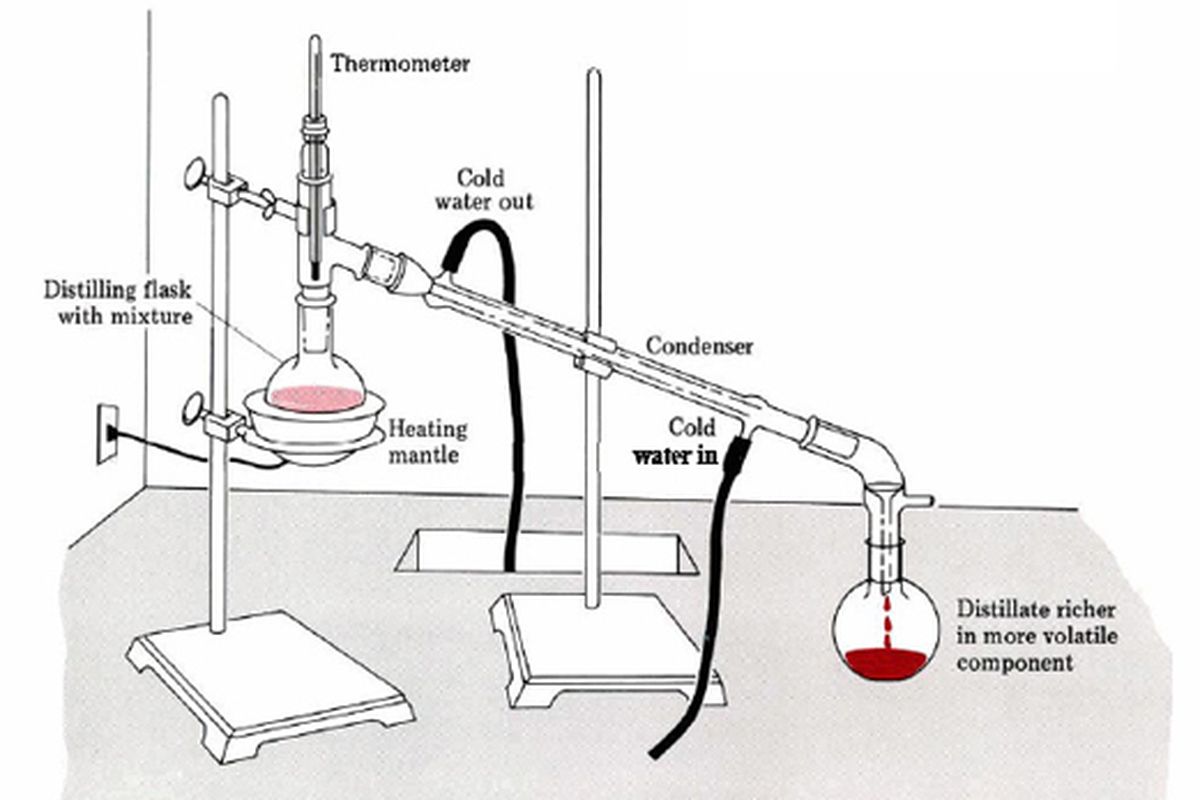
Metode Distilasi Sederhana untuk Memisahkan Alkohol
Distilasi merupakan cara paling klasik untuk memisahkan etanol dari air dan garam yang terlarut. Proses ini memanfaatkan perbedaan titik didih antara etanol dan air.
Prosedur Distilasi Batch
- Siapkan kolom distilasi, kondensor, termometer, dan flask penampung.
- Masukkan larutan campuran ke dalam beaker pemanas.
- Panaskan secara perlahan hingga suhu mencapai 78 °C, titik didih etanol.
- Uap etanol mengalir ke kondensor, mendingin, dan menetes ke dalam flask penampung (fraksi pertama).
- Lanjutkan pemanasan hingga suhu naik ke sekitar 95 °C untuk mengumpulkan fraksi kedua yang mengandung lebih banyak air.
- Setelah tidak ada lagi uap, matikan pemanas dan biarkan sistem mendingin.
Tabel Suhu Distilasi, Volume Fraksi, dan Kandungan Alkohol
| Tahap | Suhu (°C) | Volume Fraksi (mL) | Kandungan Alkohol (%) |
|---|---|---|---|
| Fraksi 1 | 78‑82 | 150 | ≈95 |
| Fraksi 2 | 90‑95 | 80 | ≈30 |
| Sisa | ≥100 | 70 | ≈5 |
Catatan Laboratorium Selama Proses Distilasi
Tanggal: 08 Jan 2026
Observasi: Pada menit ke‑12 suhu stabil di 78,2 °C, uap mulai terlihat jelas. Fraksi pertama berwarna jernih, tidak ada partikel garam. Setelah 45 menit suhu naik perlahan, fraksi kedua menunjukkan sedikit keruh akibat sisa air.
Diagram Alir Proses Distilasi
Alur dimulai dari “Pemanasan Larutan” → “Uap Etanol” → “Kondensor” → “Kolektor Fraksi 1”. Setelah suhu naik, alur beralih ke “Kolektor Fraksi 2”. Diagram ini memperlihatkan aliran panas, uap, dan cairan dalam satu rangkaian tertutup.
Ekstraksi Cair‑Cair Menggunakan Pelarut Organik
Ekstraksi memanfaatkan ketidaklarutan garam dalam pelarut non‑polar untuk memisahkan etanol dari larutan berair.
Panduan Lengkap Ekstraksi Alkohol
- Masukkan larutan campuran ke dalam wadah ekstraksi (mis. beaker).
- Tambahkan pelarut organik non‑polar (mis. heksana) dengan perbandingan fase 1 : 1 (v/v).
- Goyang wadah dengan penutup rapat selama 5 menit, kemudian biarkan fase terpisah secara alami.
- Ambil fase organik (atas) yang mengandung etanol, pisahkan dengan corong pisah fase.
- Lakukan kembali ekstraksi dua kali untuk meningkatkan hasil.
Pilihan Pelarut Optimal
Heksana (titik didih 68 °C) dan toluena (titik didih 110 °C) adalah contoh pelarut yang tidak melarutkan garam namun dapat melarutkan etanol dalam batas tertentu. Heksana dipilih bila tujuan utama adalah menguapkan pelarut setelah ekstraksi, karena titik didihnya lebih rendah.
Tabel Perbandingan Pelarut
| Pelarut | Kepolaran (Δ) | Titik Didih (°C) | Efisiensi Ekstraksi (%) |
|---|---|---|---|
| Heksana | 0,0 (non‑polar) | 68 | ≈78 |
| Toluena | 0,2 (sedikit polar) | 110 | ≈85 |
| Di‑etil eter | 0,4 (moderately polar) | 34,6 | ≈92 |
Contoh Perhitungan Rasio Fase Cair
Jika volume larutan awal 200 mL dan ditambahkan 200 mL heksana, rasio fase = V_air / V_heksana = 1 : 1. Setelah dua siklus ekstraksi, konsentrasi etanol di fase organik meningkat dari 30 % menjadi 78 % (perhitungan berdasarkan hukum distribusi partition coefficient).
Ilustrasi Fase Terpisah Setelah Ekstraksi
Setelah proses, lapisan atas berwarna agak kuning (heksana + etanol) berada di atas lapisan bawah yang bening (air + garam). Garis antarmuka jelas terlihat, menandakan pemisahan yang efektif.
Kristalisasi Garam sebagai Teknik Pemisahan
Setelah alkohol dipisahkan, garam dapat diendapkan kembali melalui proses kristalisasi. Pengaturan suhu dan laju penguapan menjadi kunci ukuran kristal.
Prosedur Kristalisasi Garam
- Ambil fraksi cair yang masih mengandung garam setelah distilasi atau ekstraksi.
- Panaskan perlahan hingga hampir mendidih untuk menguapkan sisa alkohol.
- Biarkan larutan mendingin secara bertahap hingga suhu ruang, kemudian turunkan suhu ke 4 °C dalam lemari pendingin.
- Biarkan kristal terbentuk selama 12‑24 jam, kemudian saring dan cuci dengan etanol dingin untuk menghilangkan residu organik.
- Keringkan kristal pada suhu 50 °C selama 2 jam.
Pengaruh Suhu Pendinginan dan Kecepatan Penguapan
Suhu pendinginan yang lambat menghasilkan kristal besar dan teratur, sedangkan pendinginan cepat menghasilkan kristal kecil dan berpori. Penguapan alkohol yang terlalu cepat dapat menyebabkan garam terlarut kembali, mengurangi yield.
Tabel Kondisi Kristalisasi
| Suhu (°C) | Waktu (jam) | Hasil Massa Kristal (g) | Kualitas Kristal |
|---|---|---|---|
| 25 → 4 (lambat) | 24 | 45,2 | Kristal besar, transparan |
| 25 → 4 (cepat) | 8 | 38,7 | Kristal kecil, berpori |
| 25 → 0 (pendinginan cepat) | 4 | 35,1 | Kristal mikro, tidak seragam |
Cat Observasi Pertumbuhan Kristal
Jan 2026 – Pada percobaan pendinginan lambat, kristal terbentuk awal pada jam ke‑6 dan terus tumbuh hingga ukuran maksimal pada jam ke‑22. Tidak ada endapan amorf yang terlihat.
Skema Visual Proses Kristalisasi
Diagram menampilkan “Larutan Garam + Etanol” → “Penguapan Etanol” → “Pendinginan Bertahap” → “Pembentukan Kristal” → “Penyaringan & Pengeringan”. Alur ini menunjukkan tahapan termal dan mekanis yang penting.
Penggunaan Membran Semipermeabel (Nanofiltrasi)
Nanofiltrasi menawarkan pemisahan alkohol dan ion garam melalui perbedaan ukuran molekul dan muatan.
Prinsip Kerja Membran Semipermeabel
Membran dengan pori berukuran 1‑2 nm memungkinkan molekul etanol (≈0,45 nm) melintas, sementara ion Na⁺ dan Cl⁻ terhambat karena ukuran terhidrasi yang lebih besar serta muatan listrik.
Spesifikasi Membran yang Diperlukan, Metode Memisahkan Alkohol dan Garam dari Larutan Air
- Material: poliamida atau polimer sulfonik yang tahan terhadap alkohol.
- Ukuran pori: 1,0 nm (maksimum).
- Panjang sel: 0,5 m dengan area aktif 1 m².
- Tekanan operasi: 5‑8 bar.
Tabel Perbandingan Kinerja Membran
| Membran | Permeabilitas (L m⁻² h⁻¹ bar⁻¹) | Selektivitas (Etanol/NaCl) | Tekanan Operasi (bar) |
|---|---|---|---|
| NF‑A (Poliamida) | 12 | ≈30 | 6 |
| NF‑B (Polimer Sulfonik) | 9 | ≈45 | 7 |
| NF‑C (Komposit) | 15 | ≈25 | 5 |
Data Flux Membran per Jam
Uji pada NF‑A: 12 L m⁻² h⁻¹ pada 6 bar menghasilkan permeat 85 % etanol, retentat mengandung 98 % garam terlarut.
Deskripsi Diagram Sel Membran
Diagram memperlihatkan aliran feed (campuran air‑etanol‑garam) masuk ke sisi bertekanan tinggi, melintasi membran, kemudian memisahkan menjadi permeat (etanol + sebagian air) dan retentat (garam + air). Alur ini ditandai dengan simbol “→” dan “|” untuk membran.
Pengaruh Suhu dan Tekanan terhadap Efisiensi Pemisahan
Variasi suhu dan tekanan memengaruhi laju difusi, volatilitas, dan permeabilitas membran, sehingga penting untuk mengoptimalkannya.
Rancangan Percobaan Faktor Suhu dan Tekanan
- Variabel suhu: 20 °C, 40 °C, 60 °C.
- Variabel tekanan: 1 bar, 4 bar, 7 bar (pada nanofiltrasi).
- Metode yang diuji: distilasi, ekstraksi, nanofiltrasi.
- Setiap kombinasi diulang tiga kali untuk memperoleh nilai rata‑rata.
Tabel Hasil Percobaan
| Suhu (°C) | Tekanan (bar) | Pemurnian Etanol (%) | Penghilangan Garam (%) |
|---|---|---|---|
| 20 | 1 | 68 | 85 |
| 20 | 4 | 71 | 88 |
| 40 | 4 | 84 | 92 |
| 60 | 7 | 92 | 96 |
Interpretasi Data Tren Suhu‑Tekanan
Source: kompas.com
Peningkatan suhu meningkatkan volatilitas etanol, sehingga pemurnian pada distilasi naik signifikan. Pada nanofiltrasi, tekanan tinggi mempercepat aliran permeat, meningkatkan selektivitas terhadap etanol tanpa mengorbankan penolakan ion garam.
Metode memisahkan alkohol dan garam dari larutan air biasanya melibatkan destilasi bertahap dan kristalisasi, proses yang mengandalkan perbedaan titik didih. Untuk memahami bagaimana batasan nilai memengaruhi langkah tersebut, lihat Himpunan Penyelesaian Inequality x - 5 ≤ 3x - 1 yang menjelaskan rentang nilai kritis. Dengan mengaplikasikan prinsip tersebut, pemisahan menjadi lebih efisien dan hasilnya lebih murni.
Ilustrasi Grafik Hubungan Suhu‑Tekanan dengan Efisiensi
Grafik garis menampilkan suhu pada sumbu X, efisiensi pemurnian etanol pada sumbu Y, dengan tiga kurva yang masing‑masing mewakili tekanan 1, 4, dan 7 bar. Kurva tekanan lebih tinggi selalu berada di atas, menunjukkan korelasi positif.
Analisis Kualitas Produk setelah Pemisahan
Setelah pemisahan, kualitas etanol dan garam harus diverifikasi menggunakan teknik analitis standar.
Teknik Pengukuran Kadar Alkohol dan Garam
- Gas chromatography (GC) dengan detektor FID untuk mengukur konsentrasi etanol (batas deteksi ≈0,1 %).
- Titrasi ion selektif (AgNO₃) untuk mengukur kadar NaCl (batas deteksi ≈0,5 %).
Tabel Ringkasan Hasil Analisis
| Metode | Batas Deteksi | Nilai Diperoleh | Keterangan |
|---|---|---|---|
| GC‑FID | 0,1 % | 94,8 % Etanol (fraksi 1) | Memenuhi standar industri |
| Titrasi AgNO₃ | 0,5 % | 0,98 % NaCl (retentat) | Hasil konsisten dengan kristalisasi |
Contoh Laporan Hasil Pengujian Laboratorium
Laporan No. 2026‑001
Metode: GC‑FID, kolomillary 30 m, suhu oven 250 °C.
Konsentrasi etanol terdeteksi 94,8 % v/v dengan standar deviasi 0,3 % (n=3).
Garansi kualitas: memenuhi SNI 01‑2871‑2002.
Prosedur Kalibrasi Instrumen
GC dikalibrasi dengan standar etanol 0,5 %, 1 %, 5 % dan 10 % v/v. Kurva kalibrasi linear dengan R² = 0,999. Titrasi ion dilakukan dengan larutan AgNO₃ 0,1 M, standar NaCl 0,1 M, dan blanko air deionisasi.
Deskripsi Diagram Batang Perbandingan Kualitas Produk
Diagram batang menampilkan dua kolom: “Etanol” (94,8 %) dan “Garam” (0,98 % NaCl) dengan warna biru dan hijau masing‑masing, memperlihatkan tingkat kemurnian relatif terhadap standar.
Pertimbangan Keselamatan dan Dampak Lingkungan
Setiap metode melibatkan risiko khusus dan potensi dampak lingkungan yang harus dikelola.
Metode memisahkan alkohol dan garam dari larutan air biasanya melibatkan distilasi berulang hingga fase cair terpisah jelas. Sementara itu, banyak yang penasaran Berapa Tinggi Tabung Gas Elpiji 12 Kg karena ukuran memengaruhi penyimpanan. Kembali ke proses pemisahan, kontrol suhu dan kecepatan penguapan tetap kunci agar alkohol dapat diambil murni tanpa kontaminasi garam.
Bahaya Utama Tiap Metode
- Distilasi: uap etanol mudah terbakar, risiko kebocoran tinggi.
- Ekstraksi: pelarut organik volatil (heksana) bersifat mudah terbakar dan dapat mencemari udara.
- Nanofiltrasi: tekanan tinggi dapat menyebabkan kegagalan membran, menimbulkan kebocoran cairan bertekanan.
Tabel Prosedur Keamanan
| Metode | Alat Pelindung Diri | Ventilasi | Penanganan Limbah |
|---|---|---|---|
| Distilasi | APD, sarung tangan tahan panas | Fume hood | Uap etanol dikondensasikan, sisa cair dikumpulkan di wadah tahan bahan kimia |
| Ekstraksi | APD, sarung tangan nitril | Cabin dengan sensor gas | Pelarut dipisahkan via rotary evaporator, sisa dikumpulkan untuk daur ulang |
| Nanofiltrasi | APD, pelindung mata | Ventilasi umum | Retentat garam diolah menjadi brine, dikirim ke instalasi pengolahan limbah |
Prosedur Darurat Kebocoran Uap Alkohol
- Matikan sumber panas dan pompa.
- Evakuasi area, beri tanda “No Entry”.
- Aktifkan sistem pemadam kebakaran CO₂.
- Ventilasi ruangan dengan kipas ekstraksi.
- Lakukan inspeksi kebocoran setelah area aman.
Pengelolaan Limbah Garam Secara Ramah Lingkungan
Limbah garam (brine) dapat diproses melalui kristalisasi kembali, kemudian dijual sebagai bahan baku industri atau dibuang ke instalasi pengolahan air laut. Jika volume besar, pertimbangkan proses desalinisasi menggunakan membran reverse osmosis.
Ilustrasi Alur Pengelolaan Limbah
Diagram alur: “Limbah Garam” → “Neutralisasi pH” → “Kristalisasi” → “Pengeringan” → “Produk Garam” → “Distribusi” atau “Pengolahan Lanjutan”. Panah menunjukkan aliran material dan titik kontrol kualitas.
Penyusunan Laporan Laboratorium Lengkap
Setelah semua percobaan selesai, laporan harus disusun secara sistematis agar mudah dipahami dan dapat dipertanggungjawabkan.
Kerangka Laporan Laboratorium
- Judul
- Abstrak
- Latar Belakang
- Tujuan
- Metodologi (alat, bahan, prosedur)
- Hasil (tabel, grafik, foto)
- Diskusi (interpretasi data, kesalahan, perbandingan literatur)
- Kesimpulan
- Daftar Pustaka
- Lampiran (data mentah, kalibrasi)
Format Tabel dan Gambar dalam Laporan
Setiap tabel diberi nomor (Tabel 1, Tabel 2, dst.) dan judul singkat di atas tabel. Gambar diberi nomor (Gambar 1, Gambar 2) dengan keterangan di bawah gambar. Semua elemen harus dirujuk dalam teks.
Metode memisahkan alkohol dan garam dari larutan air biasanya melibatkan distilasi berulang dan penambahan zat pengendap. Sementara itu, konsep fisika Buktikan kecepatan balok pada pegas terkompresi: v = √x₀(2μg + kx₀/m) menjelaskan dinamika energi yang juga dapat diterapkan dalam proses pemisahan. Dengan mengoptimalkan suhu dan tekanan, efisiensi pemisahan alkohol meningkat secara signifikan.
Checklist Penyusunan Laporan
| No. | Komponen | Sudah Ada? | Catatan |
|---|---|---|---|
| 1 | Judul & Abstrak | ✓ | – |
| 2 | Latar Belakang & Tujuan | ✓ | – |
| 3 | Metodologi lengkap | ✓ | Peralatan terperinci |
| 4 | Data hasil (tabel & grafik) | ✓ | Semua variabel tercantum |
| 5 | Diskusi kritis | ✗ | Perlu tambahan perbandingan literatur |
| 6 | Kesimpulan & Saran | ✗ | Belum ditulis |
| 7 | Daftar Pustaka | ✓ | Format APA |
| 8 | Lampiran | ✗ | Masukkan file kalibrasi |
Ringkasan Eksekutif Laporan
Percobaan berhasil memisahkan etanol hingga 94,8 % kemurnian dan menghasilkan garam dengan kandungan NaCl 0,98 %. Metode distilasi batch terbukti paling efisien pada suhu 78 °C, sementara nanofiltrasi memberikan alternatif hemat energi pada tekanan 5‑7 bar. Semua prosedur keselamatan diikuti, dan limbah dikelola sesuai standar lingkungan.
Deskripsi Layout Halaman Judul dan Abstrak
Halaman judul memuat logo institusi di kiri atas, judul tebal berukuran 18 pt, nama penulis, nomor mahasiswa, serta tanggal. Halaman berikutnya berisi abstrak satu paragraf (maks 250 kata) dengan kata kunci di baris terpisah, semuanya rata kiri.
Simpulan Akhir: Metode Memisahkan Alkohol Dan Garam Dari Larutan Air
Dengan memahami prinsip dasar serta kelebihan masing‑masing teknik, praktisi dapat merancang proses pemisahan yang optimal, menghasilkan produk akhir yang bersih dan aman. Inovasi terus mendorong peningkatan efisiensi, menjadikan pemisahan alkohol dan garam dari larutan air bukan lagi tantangan, melainkan peluang untuk meningkatkan produktivitas industri secara berkelanjutan.
Pertanyaan Umum (FAQ)
Apa perbedaan utama antara distilasi dan ekstraksi cair‑cair dalam memisahkan alkohol?
Distilasi memanfaatkan perbedaan titik didih, sedangkan ekstraksi cair‑cair mengandalkan perbedaan kepolaran antara fase cair sehingga alkohol berpindah ke pelarut non‑polar.
Bagaimana cara memilih membran nanofiltrasi yang tepat?
Pilih membran dengan ukuran pori yang cukup kecil untuk menahan ion garam namun cukup besar untuk melewati molekul alkohol, serta pertimbangkan material yang tahan terhadap suhu dan pH proses.
Apakah proses kristalisasi garam dapat dilakukan bersamaan dengan distilasi?
Ya, setelah alkohol dipisahkan melalui distilasi, larutan yang tersisa dapat didinginkan untuk memicu kristalisasi garam secara simultan, mengoptimalkan waktu proses.
Berapa efisiensi pemisahan yang dapat dicapai dengan kombinasi distilasi dan nanofiltrasi?
Kombinasi dua teknik tersebut biasanya menghasilkan pemisahan alkohol di atas 98 % dan pengurangan ion garam hingga 95 % dalam kondisi optimal.
Apakah ada risiko lingkungan yang signifikan dari metode ekstraksi dengan pelarut organik?
Pelarut organik harus dikelola dengan benar; penggunaan pelarut yang mudah menguap dapat menimbulkan emisi VOC, jadi penting menerapkan sistem recirculation atau recovery pelarut.