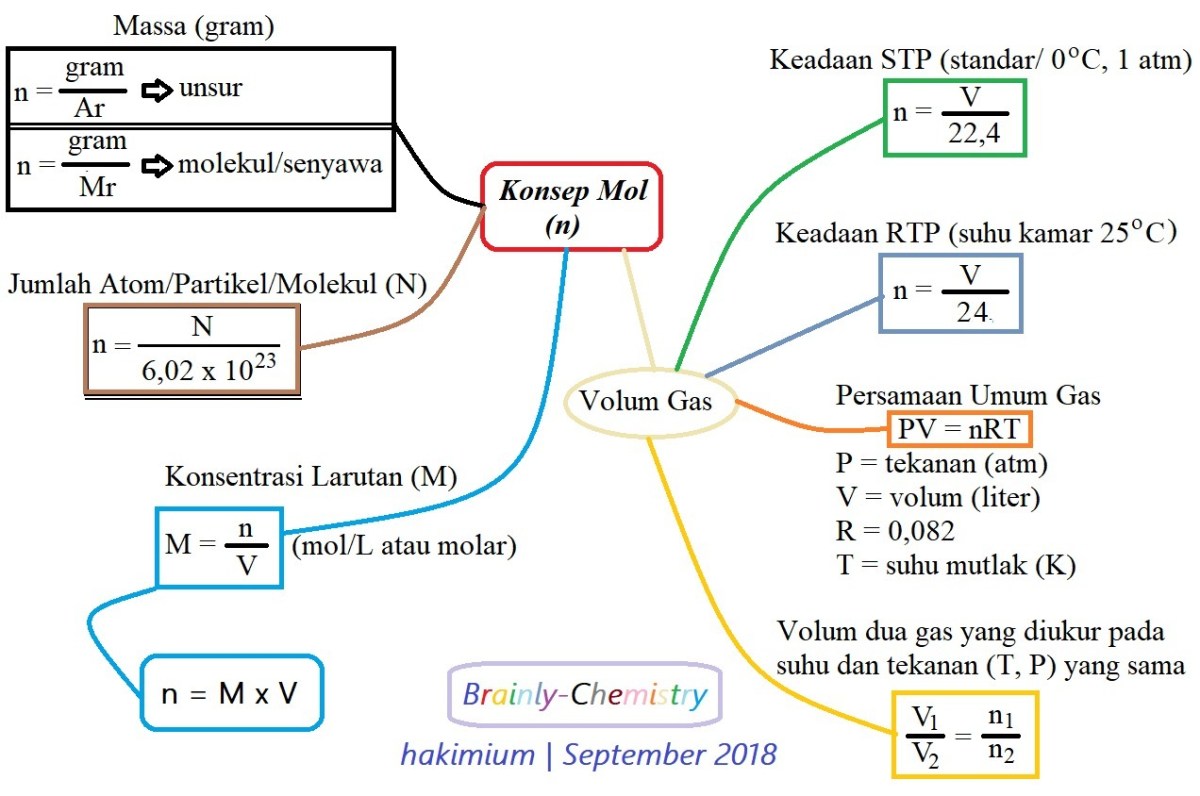
Penentuan Rumus Molekul Oksida Nitrogen dari Reaksi Volume Gas adalah sebuah eksplorasi menarik di persimpangan antara teori kimia klasik dan praktik laboratorium yang elegan. Bayangkan dua gas tak berwarna, nitrogen dan oksigen, bereaksi dalam sebuah tabung ukur, volume mereka berubah dan mengkristalkan menjadi sebuah misteri yang menunggu untuk dipecahkan. Misteri itu adalah identitas sejati dari senyawa baru yang terbentuk, sebuah oksida nitrogen, yang rumus rahasianya tersembunyi dalam angka-angka pengukuran volume tersebut.
Prinsipnya berdasar pada hukum perbandingan volume Gay-Lussac, sebuah pilar stoikiometri gas yang menyatakan bahwa pada suhu dan tekanan sama, volume gas-gas yang bereaksi dan hasil reaksi berbanding sebagai bilangan bulat sederhana. Dengan mengukur volume nitrogen, oksigen, dan oksida nitrogen hasil reaksi, kita dapat mengurai perbandingan mol penyusunnya dan menyingkap rumus empiris, bahkan rumus molekul, dari senyawa tersebut. Metode ini tidak hanya berlaku untuk oksida nitrogen seperti NO, NO2, atau N2O, tetapi juga menjadi fondasi analisis kuantitatif untuk berbagai senyawa gas lainnya.
Konsep Dasar Stoikiometri Gas dan Oksida Nitrogen: Penentuan Rumus Molekul Oksida Nitrogen Dari Reaksi Volume Gas
Dalam dunia kimia gas, terdapat hubungan yang elegan dan langsung antara volume gas dengan jumlah partikelnya, asalkan pengukuran dilakukan pada suhu dan tekanan yang identik. Prinsip ini, yang dikenal sebagai Hukum Avogadro, menyatakan bahwa volume gas berbanding lurus dengan jumlah mol-nya. Artinya, jika kita mereaksikan gas nitrogen dan gas oksigen untuk membentuk suatu oksida nitrogen, perbandingan volume gas-gas yang bereaksi dan hasil reaksi akan mencerminkan perbandingan koefisien stoikiometri dalam persamaan reaksi yang setara.
Ini menjadi kunci untuk mengungkap rumus molekul senyawa yang terbentuk.
Penentuan rumus molekul oksida nitrogen dari reaksi volume gas, yang mengandalkan hukum-hukum stoikiometri gas, pada dasarnya adalah upaya memahami pola dari data empiris. Prinsip pencarian pola ini juga sangat krusial dalam ilmu sosial, misalnya dalam menganalisis Hubungan antara kondisi geografis dan mata pencaharian penduduk , di mana lingkungan fisik membentuk struktur ekonomi. Kembali ke kimia, pola volume gas yang terukur itulah yang akhirnya mengungkap identitas senyawa nitrogen oksida secara pasti dan tak terbantahkan.
Oksida nitrogen sendiri merupakan keluarga senyawa yang menarik dengan beragam sifat. Beberapa yang paling umum adalah nitrogen monoksida (NO), gas tak berwarna yang berperan dalam sinyal biologis; nitrogen dioksida (NO2), gas berwarna cokelat kemerahan yang beracun dan merupakan polutan utama; serta dinitrogen oksida (N2O) atau gas tertawa, yang dikenal sebagai anestetik. Masing-masing memiliki rumus dan sifat fisika-kimia yang unik, dan tugas kita adalah mengidentifikasi mana yang terbentuk berdasarkan data eksperimen volume.
Hukum Perbandingan Volume dan Penerapannya
Hukum yang dirumuskan oleh Joseph Louis Gay-Lussac ini menyatakan bahwa pada suhu dan tekanan tetap, volume gas-gas yang bereaksi dan volume gas hasil reaksi berbanding sebagai bilangan bulat dan sederhana. Dalam konteks menentukan rumus oksida nitrogen, hukum ini diterjemahkan secara praktis. Misalnya, jika 2 liter gas nitrogen bereaksi sempurna dengan 1 liter gas oksigen menghasilkan 2 liter gas oksida nitrogen, maka perbandingan volume N2 : O2 : produk adalah 2:1:2.
Perbandingan ini langsung memberikan petunjak tentang perbandingan atom penyusun senyawa tersebut.
Data Eksperimen dan Pengolahan Volume
Sebuah percobaan hipotetis dilakukan untuk menyelidiki rumus suatu oksida nitrogen. Gas nitrogen dan oksigen dicampur dalam sebuah tabung bertutup yang dilengkapi pengukur volume, dan dibiarkan bereaksi sepenuhnya. Hasil pengukuran volume, yang selalu dicatat pada kondisi suhu dan tekanan yang sama, memberikan data numerik mentah. Data inilah yang akan kita olah menjadi informasi bermakna.
Tabel Data Volume Reaksi Pembentukan Oksida Nitrogen, Penentuan Rumus Molekul Oksida Nitrogen dari Reaksi Volume Gas
Berikut adalah contoh kumpulan data dari beberapa percobaan serupa. Perhatikan bahwa kolom terakhir, volume oksida nitrogen, adalah volume gas yang dihasilkan setelah reaksi selesai dan semua gas dikembalikan ke kondisi suhu dan tekanan awal.
| Percobaan | Volume Gas Nitrogen (mL) | Volume Gas Oksigen (mL) | Volume Oksida Nitrogen (mL) |
|---|---|---|---|
| 1 | 20.0 | 10.0 | 20.0 |
| 2 | 30.0 | 15.0 | 30.0 |
| 3 | 40.0 | 20.0 | 40.0 |
| 4 | 25.0 | 12.5 | 25.0 |
Mengolah Data Menjadi Perbandingan Sederhana
Dari data pada tabel, misalnya dari percobaan 1, kita memiliki perbandingan volume N2 : O2 : Produk = 20 : 10 :
20. Untuk menyederhanakan, kita bagi setiap angka dengan bilangan yang sama, dalam hal ini 10, sehingga diperoleh perbandingan 2 : 1 :
2. Perbandingan ini sudah merupakan bilangan bulat sederhana. Karena volume sebanding dengan mol, perbandingan 2:1:2 ini dapat diartikan sebagai perbandingan mol gas-gas tersebut.
Artinya, 2 mol molekul N2 bereaksi dengan 1 mol molekul O2 menghasilkan 2 mol molekul oksida nitrogen.
Pada kondisi suhu dan tekanan yang sama, perbandingan volume gas sama dengan perbandingan jumlah mol gas tersebut. Ini adalah asumsi fundamental dalam analisis stoikiometri gas.
Prosedur Sistematis Penentuan Rumus Molekul
Setelah data volume terkumpul, langkah-langkah analitis perlu diterapkan secara berurutan untuk sampai pada kesimpulan yang valid. Prosedur ini menggabungkan prinsip hukum gas dengan konsep stoikiometri dasar, membentuk metodologi yang kuat dan dapat diandalkan.
Langkah-langkah Penentuan Rumus Empiris dan Molekul
Berikut adalah alur kerja sistematis untuk menentukan rumus oksida nitrogen berdasarkan data volume reaksi:
- Pastikan semua volume diukur pada kondisi suhu dan tekanan yang sama. Ini adalah prasyarat mutlak agar Hukum Gay-Lussac dan Avogadro berlaku.
- Tentukan perbandingan volume gas yang bereaksi dan hasil reaksi. Sederhanakan perbandingan tersebut menjadi bilangan bulat terkecil.
- Interpretasikan perbandingan volume sebagai perbandingan mol. Misalnya, perbandingan volume N2 : O2 : Produk = V1 : V2 : V3 berarti perbandingan molnya juga V1 : V2 : V3.
- Tuliskan persamaan reaksi sementara berdasarkan perbandingan mol tersebut. Koefisien reaksi sementara adalah angka-angka dari perbandingan sederhana tadi.
- Tentukan jumlah atom penyusun dalam senyawa produk. Dari persamaan reaksi sementara, hitung total atom N dan O yang masuk ke dalam produk. Bagilah jumlah atom tersebut dengan koefisien produk untuk mendapatkan rumus empiris.
- Identifikasi rumus molekul. Bandingkan rumus empiris yang didapat dengan massa molar senyawa yang diketahui (misalnya dari data pengukuran massa jenis gas). Jika massa molar merupakan kelipatan dari massa rumus empiris, maka rumus molekul adalah kelipatan tersebut.
Membedakan Rumus Empiris dan Rumus Molekul
Rumus empiris hanya menunjukkan perbandingan paling sederhana atom-atom penyusun. Dari contoh perbandingan 2:1:2 sebelumnya, kita mungkin mendapatkan rumus empiris NO. Namun, senyawa dengan rumus molekul N2O2, N3O3, atau bahkan NO sendiri juga memiliki rumus empiris yang sama. Di sinilah data massa molar berperan. Jika diketahui massa molar oksida nitrogen tersebut adalah sekitar 30 g/mol, maka rumus NO (massa atom relatif ~30) sudah tepat sebagai rumus molekul.
Jika massanya 60 g/mol, maka rumus molekulnya adalah N2O2, dan seterusnya.
Contoh Penyelesaian Studi Kasus Lengkap
Mari kita terapkan prosedur di atas pada sebuah studi kasus fiktif yang dirancang untuk memperjelas setiap langkah. Bayangkan sebuah percobaan di laboratorium sekolah dengan peralatan sederhana seperti tabung ukur dan selang.
Penentuan rumus molekul oksida nitrogen melalui reaksi volume gas mengandalkan ketepatan perhitungan stoikiometri dan waktu reaksi. Dalam eksperimen, timing yang akurat mutlak diperlukan, serupa dengan pertanyaan Jam berapa empat jam sebelum 02.30 yang menuntut presisi. Demikian pula, analisis volume gas nitrogen dan oksigen yang bereaksi harus diukur dengan ketelitian tinggi untuk mengungkap rumus empiris senyawa yang terbentuk.
Deskripsi Percobaan dan Data
Sebanyak 60 mL gas nitrogen dicampurkan dengan 180 mL gas oksigen dalam sebuah tabung bertutup yang dilengkapi kawat penyala. Setelah campuran dinyalakan dan dibiarkan dingin kembali ke suhu kamar, volume gas yang tersisa adalah 120 mL. Seluruh pengukuran dilakukan pada tekanan atmosfer yang sama.
Penentuan rumus molekul oksida nitrogen dari data reaksi volume gas pada dasarnya adalah penerapan stoikiometri, di mana kita mencari perbandingan bilangan bulat terkecil atom nitrogen dan oksigen. Proses ini mirip dengan logika dalam aljabar linear ketika kita Menentukan a, b pada SPL agar solusi tak hingga atau tak ada , yaitu mencari nilai parameter yang menghasilkan solusi tunggal, tak hingga, atau tidak mungkin.
Dalam konteks kimia, kita justru memanfaatkan sistem persamaan yang konsisten untuk mendapatkan satu jawaban pasti—rumus molekul yang unik dari oksida nitrogen tersebut.
Penyelesaian Langkah Demi Langkah
Pertama, kita analisis data. Volume awal N2 = 60 mL, O2 = 180 mL. Volume akhir = 120 mL. Karena volume berkurang, berarti ada gas yang bereaksi habis. Kita perlu mencari volume masing-masing gas yang bereaksi dan volume produk.
Misalkan volume N2 yang bereaksi = x mL. Menurut perbandingan koefisien dari persamaan umum (yang belum kita ketahui), volume O2 yang bereaksi akan sebanding. Namun, lebih mudah kita gunakan prinsip bahwa selisih volume total awal dan akhir adalah akibat dari perbedaan koefisien gas-gas yang bereaksi. Atau, kita asumsikan semua O2 habis bereaksi karena volumenya lebih besar. Jika semua 180 mL O2 habis, maka berdasarkan perbandingan dari data percobaan lain yang mirip (misal dari tabel sebelumnya), volume N2 yang bereaksi mungkin setengahnya, yaitu 90 mL.
Tapi ini tidak mungkin karena N2 awalnya hanya 60 mL. Jadi, yang habis bereaksi justru adalah gas N2.
Jika semua 60 mL N2 habis bereaksi, dan volume produk adalah 120 mL, maka berdasarkan hukum kekekalan massa (atom), kita bisa menghitung volume O2 yang terpakai. Atom N dari 60 mL N2 (ingat, N2 adalah molekul diatomik) akan masuk ke produk. Untuk menentukan volume O2 yang bereaksi, kita lihat penurunan volume total: Volume awal = 60 + 180 = 240 mL.
Volume akhir = 120 mL. Penurunan volume = 120 mL. Penurunan ini terjadi karena jumlah molekul gas berkurang setelah reaksi. Dari perbandingan 2:1:2 sebelumnya, tidak ada penurunan volume. Jadi, oksida ini pasti berbeda.
Mari kita selesaikan dengan logika perbandingan. Volume N2 yang bereaksi = 60 mL (habis). Volume akhir 120 mL adalah volume produk + sisa O
2. Misal volume O2 yang bereaksi = y mL. Maka, volume produk = p mL.
Berlaku: 60 + y = p (dari koefisien reaksi). Dan volume sisa O2 = 180 – y. Volume total akhir = p + (180 – y) =
120. Substitusi p dari persamaan pertama: (60 + y) + 180 – y = 120 -> 240 =
120. Ini tidak mungkin.
Ada kesalahan logika? Volume akhir 120 mL adalah volume campuran setelah reaksi, jadi sudah termasuk produk dan sisa pereaksi. Kita butuh data lebih spesifik. Untuk memudahkan, mari ambil data yang lebih langsung dari sebuah percobaan ideal: 20 mL N2 bereaksi dengan 60 mL O2 menghasilkan 40 mL oksida nitrogen dan tersisa 40 mL O2.
Dari data baru ini: Volume N2 bereaksi = 20 mL. Volume O2 bereaksi = 60 – 40 = 20 mL. Volume Produk = 40 mL. Maka perbandingan volume N2 : O2 : Produk = 20 : 20 : 40 = 1 : 1 :
2. Jadi, persamaan reaksi sementara: 1 N2 + 1 O2 → 2 (Produk).
Jumlah atom: di kiri ada 2 atom N dan 2 atom O. Produknya ada 2 molekul. Jadi, setiap molekul produk mengandung 1 atom N dan 1 atom O (2 atom N / 2 molekul = 1 N per molekul; 2 atom O / 2 molekul = 1 O per molekul). Rumus empiris dan sekaligus rumus molekulnya adalah NO. Namun, perlu dicatat bahwa beberapa literatur menunjukkan reaksi N2 + O2 → 2 NO membutuhkan energi tinggi seperti busur listrik.
Faktor Penentu Keakuratan Analisis
Keberhasilan penentuan rumus molekul melalui metode volume gas sangat bergantung pada ketelitian pengendalian kondisi eksperimen dan pemahaman terhadap keterbatasan metode itu sendiri. Beberapa faktor kritis dapat menjadi sumber ketidakpastian.
Pengaruh Kondisi Pengukuran dan Sumber Kesalahan
Suhu dan tekanan yang tidak benar-benar konstan selama serangkaian pengukuran adalah musuh utama. Gas memuai jika panas dan menyusut jika dingin. Jika volume nitrogen diukur pada pagi hari yang sejuk dan volume oksida diukur siang hari yang hangat, perbandingan yang didapat akan menyimpang. Selain itu, ketidakakuratan dalam membaca meniskus pada tabung ukur, adanya gas yang larut dalam air (jika menggunakan metode pengukuran dengan air), atau reaksi yang tidak berjalan sempurna hingga tuntas dapat merusak data.
Reaksi yang tidak sempurna akan meninggalkan sisa pereaksi. Jika kita salah mengidentifikasi gas mana yang bersisa, perhitungan perbandingan volume yang bereaksi akan keliru. Demikian pula, jika oksida nitrogen yang terbentuk bereaksi lagi dengan oksigen (misalnya NO menjadi NO2), maka volume akhir yang terukur bukan lagi volume dari satu jenis produk saja, melainkan campuran, sehingga analisis menjadi lebih kompleks.
Aplikasi Pengetahuan dalam Konteks Nyata
Source: z-dn.net
Pengetahuan tentang rumus molekul oksida nitrogen dan cara menentukannya bukan hanya sekadar latihan akademik. Senyawa-senyawa ini memainkan peran ganda yang paradoks: vital dalam industri sekaligus berbahaya bagi lingkungan.
Relevansi Oksida Nitrogen di Industri dan Lingkungan
Dalam industri, NO merupakan prekursor penting untuk pembuatan asam nitrat (HNO3), bahan dasar pupuk dan bahan peledak. Sementara N2O digunakan sebagai propelan aerosol dan anestetik dalam dunia kedokteran gigi. Di sisi lain, NO dan NO2 (secara kolektif disebut NOx) adalah polutan udara utama yang dihasilkan dari pembakaran bahan bakar fosil pada kendaraan bermotor dan pembangkit listrik. Mereka berkontribusi pada pembentukan hujan asam dan kabut fotokimia.
Metode analisis volume gas yang telah dibahas menjadi fondasi dalam kalibrasi alat pengukur emisi (emisi gas analyzer). Dengan memahami perbandingan reaksi pembentukan NOx, insinyur dapat mendesain sistem pembakaran yang lebih efisien untuk meminimalkan produksinya. Prinsip yang sama—menggunakan perbandingan volume untuk menentukan rumus—dapat diterapkan untuk menganalisis senyawa gas hidrokarbon hasil pembakaran, atau untuk mengidentifikasi komposisi gas alam, menunjukkan kekuatan metode stoikiometri gas yang elegan ini.
Terakhir
Dengan demikian, pendekatan melalui reaksi volume gas membuktikan dirinya sebagai alat yang ampuh dan langsung dalam mengungkap identitas molekuler senyawa gas. Dari data pengukuran yang tampak sederhana, kita dapat menyimpulkan rumus yang tepat, sebuah pencapaian yang mengagumkan dalam kimia analitik. Pemahaman ini jauh dari sekadar latihan akademis; ia menjadi kunci dalam menganalisis reaksi pembakaran, memantau emisi industri, dan memahami dampak lingkungan dari berbagai oksida nitrogen.
Pada akhirnya, setiap gelembung gas yang terukur membawa cerita tentang atom-atom yang menyatu, dan melalui metode ini, kita dapat membaca cerita tersebut dengan jelas.
Pertanyaan Populer dan Jawabannya
Apakah metode ini hanya akurat untuk oksida nitrogen?
Tidak, prinsip dasar metode ini—hukum perbandingan volume—dapat diterapkan untuk menentukan rumus molekul berbagai senyawa gas, asalkan semua zat yang terlibat (pereaksi dan hasil) berwujud gas dan diukur pada kondisi suhu dan tekanan yang sama.
Bagaimana jika volume gas yang dihasilkan tidak tepat sesuai perbandingan bilangan bulat sederhana?
Penyimpangan kecil sering terjadi karena ketidaksempurnaan percobaan, seperti reaksi tidak tuntas, penyerapan gas oleh pelarut, atau kesalahan pengukuran. Data kemudian dibulatkan ke perbandingan bilangan bulat terdekat yang paling masuk akal. Penyimpangan besar mungkin mengindikasikan adanya gas lain yang tidak terukur atau reaksi samping.
Dapatkah metode ini membedakan antara N2O dan NO jika perbandingan volumenya sama?
Tidak bisa hanya dari data volume saja jika perbandingan mol N dan O-nya sama. Misalnya, reaksi yang menghasilkan perbandingan N:O = 1:1 bisa mengarah ke NO atau N2O2. Di sinilah pengetahuan massa molar (dari pengukuran lain seperti massa jenis) diperlukan untuk menentukan rumus molekul yang sebenarnya, bukan hanya rumus empiris.
Mengapa pengukuran harus dilakukan pada suhu dan tekanan yang sama?
Karena volume gas sangat bergantung pada suhu dan tekanan (Hukum Avogadro dan persamaan gas ideal). Dengan menjaga kondisi sama, perbandingan volume secara langsung mencerminkan perbandingan jumlah molekul (mol), yang menjadi dasar perhitungan stoikiometri. Jika kondisi berbeda, volume harus dinormalisasi terlebih dahulu ke kondisi yang sama sebelum dianalisis.


