Penggunaan Magnesium sebagai Pelindung Katodik untuk Besi mungkin terdengar seperti topik teknis yang berat, tapi bayangkan ini: ada logam yang dengan sukarela mengorbankan dirinya demi menyelamatkan besi dari kehancuran berkarat. Ceritanya jauh lebih menarik dari sekadar teori di buku, lho. Ini adalah tentang sebuah pertahanan diam-diam yang bekerja di bawah tanah, di dasar laut, dan di balik dinding tangki penyimpanan kita, menjaga infrastruktur vital tetap aman dan utuh.
Mekanismenya sungguh elegan, berdasarkan prinsip elektrokimia di mana magnesium, yang lebih aktif, bertindak sebagai anoda kurban. Ia mengalirkan elektronnya kepada besi, membuat besi menjadi katoda yang terlindungi dari oksidasi. Proses pengorbanan yang terukur ini telah menjadi tulang punggung proteksi korosi untuk pipa, kapal, dan tangki selama puluhan tahun, sebuah solusi cerdas yang mengubah logam biasa menjadi pahlawan tak ternilai.
Magnesium sebagai Pahlawan Korosi yang Terlupakan dalam Sejarah Material
Sebelum kita memahami teori elektrokimia dengan rapi, praktik melindungi besi dari karat sudah berjalan, seringkali berdasarkan trial and error yang cerdas. Magnesium, meski tidak sepopuler seng dalam catatan sejarah, sebenarnya memainkan peran empiris yang menarik. Pada era revolusi industri, khususnya dalam aplikasi kelautan dan pipa awal, para insinyur lapangan memperhatikan bahwa menyambungkan logam putih ringan tertentu ke besi bisa memperlambat kerusakan yang mengkhawatirkan.
Mereka belum mengenal istilah “anoda korban” atau “potensial elektrokimia”, tetapi pengamatan bahwa besi bertahan lebih lama ketika bersentuhan dengan magnesium adalah pengetahuan praktis yang berharga.
Penggunaan empiris magnesium ini terutama terlihat pada komponen kapal kayu berlapis besi atau pada tongkang. Logam magnesium, yang lebih mudah didapat dari elektrolisis garam dibandingkan aluminium murni pada masa itu, sering dipasang sebagai pelat atau bongkahan pada badan kapal di bawah garis air. Para pekerja melihat bahwa logam putih ini yang justru terkikis dengan cepat, sementara paku besi dan bautnya tetap utuh.
Mekanisme di baliknya adalah misteri, tetapi hasilnya nyata. Catatan dari bengkel kapal abad ke-19 bahkan menyebutkan “logam pengorbanan” yang harus diganti secara berkala untuk keselamatan kapal.
Perbandingan Material Pelindung Era Awal
Pada masa itu, beberapa logam lain juga dicoba untuk fungsi serupa. Berikut adalah perbandingan berdasarkan pengamatan praktis di lapangan sebelum teori modern sepenuhnya dianut.
| Material | Ketersediaan (Akhir 1800-an) | Kemudahan Pemasangan Empiris | Efektivitas yang Diamati |
|---|---|---|---|
| Magnesium | Sedang, mulai diproduksi secara komersial | Mudah dibentuk dan dipasang, tetapi sangat reaktif saat dipotong/dibor | Sangat efektif, terkikis sangat cepat; perlindungan kuat namun umur pendek. |
| Seng (Zinc) | Tinggi, sudah digunakan luas untuk pelapis | Sudah familiar, bisa dituang menjadi bentuk yang diinginkan | Efektif dan bertahan lebih lama, perlindungan lebih stabil di air laut. |
| Aluminium Murni Awal | Sangat rendah dan mahal | Sulit, logam yang relatif baru dan proses fabrikasi rumit | Tidak konsisten; sering membentuk lapisan oksida pasif yang menghambat proteksi. |
| Besi Cor (sebagai pembanding) | Tinggi | Mudah, tetapi berat | Tidak melindungi; justru korosi dipercepat karena potensialnya mirip. |
Ilustrasi Proses Korosi di Air Laut Abad ke-19
Bayangkan sebuah kapal uap dari besi yang berlabuh di pelabuhan tropis abad ke-19. Pada lambungnya yang tidak dilindungi, permukaan besi yang terbuka langsung berhadapan dengan air laut yang kaya elektrolit. Bercak karat berwarna coklat kemerahan akan muncul dengan cepat, dimulai dari sambungan paku atau area yang tergores. Karat ini seperti kanker, membengkak dan mengelupas, memperlihatkan logam baru di bawahnya yang siap untuk dikonsumsi lagi.
Dalam beberapa bulan, pelat besi di garis air akan menjadi tipis dan berlubang, mengancam integritas kapal.
Sekarang, lihat kapal yang sama dengan pelat magnesium besar yang diikat kuat ke lambungnya di bawah permukaan air. Perubahan visual yang paling mencolok adalah pada magnesium itu sendiri. Permukaannya yang awalnya keperakan dan bersih akan segera ditutupi oleh gumpalan putih keabu-abuan yang berupa produk korosi magnesium hidroksida. Terkadang gelembung gas hidrogen kecil terlihat keluar. Yang penting, permukaan besi di sekitarnya tetap relatif bersih.
Mungkin ada sedikit endapan karat, tetapi tidak ada ekspansi dan pengelupasan yang merusak seperti sebelumnya. Para awak kapal akan tahu waktunya mengganti anoda ketika pelat magnesium itu sudah hampir habis terkikis, sementara lambung kapal tetap solid.
Simfoni Elektron dan Reaksi Reduksi di Bawah Permukaan Tanah: Penggunaan Magnesium Sebagai Pelindung Katodik Untuk Besi
Proteksi katodik adalah tentang mengarahkan pergerakan elektron. Di dalam tanah lembab yang merupakan elektrolit alami, magnesium dan besi membentuk sel galvanik sederhana yang canggih. Pada tingkat mikroskopis, atom-atom magnesium di anoda melepaskan dua elektron dan berubah menjadi ion magnesium yang larut. Pelepasan ini terjadi karena magnesium memiliki energi yang lebih tinggi untuk melepaskan elektron dibandingkan besi.
Elektron-elektron yang dibebaskan ini tidak hilang. Mereka mengalir melalui sambungan logam (kabel) menuju struktur besi yang dilindungi. Di permukaan besi, elektron-elektron ini bertemu dengan spesies yang lapar elektron yang ada di tanah, seperti ion hidrogen (H+) dari air atau oksigen terlarut (O2). Elektron-elektron tersebut kemudian digunakan dalam reaksi reduksi. Jika yang direduksi adalah oksigen dan air, hasilnya adalah ion hidroksida (OH-).
Proses ini secara efektif “membanjiri” permukaan besi dengan elektron berlebih, menaikkan potensial elektrokimianya ke daerah yang lebih negatif sehingga reaksi oksidasi (pembentukan karat) menjadi tidak mungkin secara termodinamika. Komposisi mineral tanah, seperti keberadaan klorida, sulfat, atau karbonat, mempengaruhi konduktivitas elektrolit dan dengan demikian kecepatan serta efisiensi aliran elektron ini.
Prinsip utama proteksi katodik menggunakan magnesium adalah dengan menjadikannya anoda yang dikorbankan dalam sel galvanik yang terbentuk secara alami dengan besi. Magnesium, yang memiliki potensial elektrokimia lebih negatif, secara spontan teroksidasi dan melepaskan elektron. Aliran elektron ini kemudian dialirkan ke struktur besi, memaksa permukaan besi menjadi katoda dimana reaksi reduksi (seperti reduksi oksigen) yang terjadi, bukan reaksi oksidasi pembentukan karat. Dengan demikian, korosi hanya dialami oleh magnesium, sementara besi tetap terlindungi selama magnesium masih tersedia.
Pengaruh Ion Terlarut dan Lingkungan Mikro
Ketika magnesium terkikis, ion Mg2+ yang terlarut tidak serta merta hilang. Di sekitar anoda, konsentrasi ion magnesium menjadi tinggi. Ion-ion ini kemudian bereaksi dengan ion hidroksida (OH-) yang dihasilkan dari reaksi katodik di permukaan besi, membentuk magnesium hidroksida (Mg(OH)2) yang berwarna putih dan sedikit larut. Endapan sekunder ini bisa membentuk lapisan longgar di sekitar anoda dan kadang pada permukaan besi di dekatnya.
Pembentukan magnesium hidroksida ini memiliki implikasi penting terhadap pH lingkungan mikro. Reaksi katodik di besi menghasilkan ion OH-, yang bersifat basa. Akibatnya, pH tanah atau air di sekitar area yang dilindungi, terutama dekat permukaan besi, akan meningkat menjadi basa (bisa mencapai pH 10 atau lebih). Lingkungan basa ini justru menguntungkan karena memperlambat laju korosi besi secara umum dan menstabilkan lapisan pasif alami pada baja.
Prinsip perlindungan katodik dengan magnesium itu sederhana: logam yang lebih reaktif ini “mengorbankan” dirinya untuk melindungi besi dari korosi. Nah, prinsip pengorbanan untuk kebaikan ini mirip dengan etika sosial kita, di mana meminta bantuan pun perlu dilakukan dengan cara yang tepat agar hubungan tetap terjaga, seperti yang dijelaskan dalam panduan Cara Meminta Tolong dengan Sopan. Jadi, baik dalam ilmu material maupun interaksi manusia, pendekatan yang tepat dan penuh kesadaran—seperti magnesium yang sengaja dikorbankan—akan menghasilkan perlindungan dan harmoni yang jauh lebih efektif dalam jangka panjang.
Namun, lapisan Mg(OH)2 yang terlalu tebal di anoda dapat menghambat kontak antara magnesium dengan elektrolit, menurunkan efektivitasnya, sehingga desain anoda harus mempertimbangkan kemampuan produk korosi untuk terlepas.
Kinerja Anoda Magnesium di Berbagai Jenis Tanah
Efektivitas proteksi katodik sangat bergantung pada karakteristik tanah yang berperan sebagai elektrolit. Resistivitas tanah, kadar air, dan kandungan mineral adalah faktor penentu utama.
| Jenis Tanah | Resistivitas (Perkiraan) | Laju Konsumsi Anoda Magnesium | Efektivitas Proteksi |
|---|---|---|---|
| Tanah Berpasir | Tinggi hingga sangat tinggi | Rendah (arus sulit mengalir) | Cenderung rendah, membutuhkan lebih banyak anoda atau backfill khusus. |
| Tanah Lempung | Rendah hingga sedang | Optimal (konduktivitas baik) | Tinggi, lingkungan ideal untuk proteksi katodik galvanik. |
| Tanah Gambut | Variabel, sering rendah saat basah | Tinggi (asam organik mempercepat korosi) | Cukup, tetapi umur anoda lebih pendek karena konsumsi cepat. |
| Tanah Liat Padat | Sedang hingga tinggi | Tidak merata (kontak buruk) | Sedang, sering memerlukan backfill bentonit untuk meningkatkan kontak. |
Mengukur Pengorbanan Magnesium dalam Skala Waktu dan Biaya
Menggunakan magnesium sebagai anoda korban adalah komitmen untuk perawatan berkala. Laju pengorbanannya tidak konstan; ia dipengaruhi oleh sekumpulan faktor lingkungan dan operasional. Memahami faktor-faktor ini krusial untuk merencanakan penggantian dan menjaga proteksi yang konsisten.
Suhu lingkungan memiliki pengaruh ganda. Suhu yang lebih tinggi umumnya meningkatkan laju reaksi elektrokimia, sehingga magnesium akan terkikis lebih cepat. Kadar oksigen terlarut di dalam tanah atau air adalah faktor pengendali utama untuk reaksi katodik. Jika oksigen berlimpah, reaksi reduksi di permukaan besi berjalan lancar, menarik lebih banyak elektron dari magnesium dan mempercepat pengorbanannya. Sebaliknya, di lingkungan anaerob (tanpa oksigen), laju mungkin turun, tetapi mikroorganisme seperti bakteri pereduksi sulfat (SRB) bisa mengambil alih peran penerima elektron.
Keberadaan SRB justru bisa meningkatkan kebutuhan arus proteksi dan mempercepat konsumsi anoda. Faktor lain adalah resistivitas elektrolit yang sudah dibahas, serta polarisasi pada permukaan anoda akibat penumpukan produk korosi.
Prosedur Perhitungan Masa Pakai Anoda Magnesium
Untuk merencanakan dengan baik, insinyur melakukan perhitungan estimasi masa pakai anoda magnesium. Berikut adalah langkah-langkah umum yang dilakukan.
- Tentukan Arus Perlindungan yang Dibutuhkan (I): Hitung total luas permukaan besi yang akan dilindungi (dalam m²). Kalikan dengan densitas arus proteksi yang direkomendasikan untuk lingkungan tersebut (biasanya antara 1-20 mA/m², tergantung kondisi). Hasilnya adalah arus total dalam Ampere (A).
- Hitung Kapasitas Anoda: Setiap material anoda memiliki kapasitas teoritis, yaitu jumlah arus yang dapat dihasilkan per kilogram material. Untuk magnesium murni, nilainya sekitar 2200 Ah/kg. Untuk paduan, lihat spesifikasi pabrikan.
- Perhitungkan Efisiensi Arus: Dalam praktek, tidak semua kapasitas teoritis termanfaatkan karena faktor polarisasi dan produk korosi. Efisiensi arus untuk magnesium biasanya diambil 50-60%. Kalikan kapasitas teoritis dengan faktor efisiensi ini.
- Estimasi Masa Pakai: Gunakan rumus: Masa Pakai (tahun) = [Berat Anoda (kg) x Kapasitas Efektif (Ah/kg) x Faktor Utilisasi (biasanya 0,85)] / [Arus (A) x 8760 (jam/tahun)]. Perhitungan ini memberikan estimasi konservatif.
Perbandingan Biaya dengan Metode Pelapisan
Analisis biaya siklus hidup antara proteksi katodik magnesium dan cat epoksi berlapis menunjukkan trade-off yang jelas. Metode cat epoksi memiliki biaya awal yang lebih rendah untuk aplikasi pada struktur baru. Biayanya terutama untuk persiapan permukaan (sandblasting) dan pengecatan itu sendiri. Namun, dalam jangka panjang 20 tahun, cat akan mengalami degradasi, retak, dan kerusakan lapisan. Ini memerlukan inspeksi rutin, perbaikan spot (touch-up), dan seringkali pelapisan ulang total sebelum periode 20 tahun berakhir, yang melibatkan biaya tenaga kerja dan downtime yang signifikan.
Di sisi lain, instalasi sistem proteksi katodik dengan anoda magnesium memiliki biaya awal yang lebih tinggi, mencakup harga anoda, kabel, dan tenaga ahli untuk instalasi yang tepat. Akan tetapi, setelah terpasang, sistem ini bekerja secara pasif dan terus menerus. Biaya operasional utamanya adalah inspeksi tahunan untuk memeriksa potensial dan penggantian anoda magnesium setiap 5-15 tahun tergantung lingkungan, yang biayanya relatif rendah.
Dalam periode 20 tahun, total biaya kumulatif proteksi katodik seringkali lebih kompetitif dan memberikan jaminan proteksi yang lebih konsisten, terutama untuk struktur yang sulit diakses atau berada di lingkungan agresif dimana cat saja tidak cukup.
Interaksi Tak Terduga Magnesium dengan Lingkungan Industri Modern
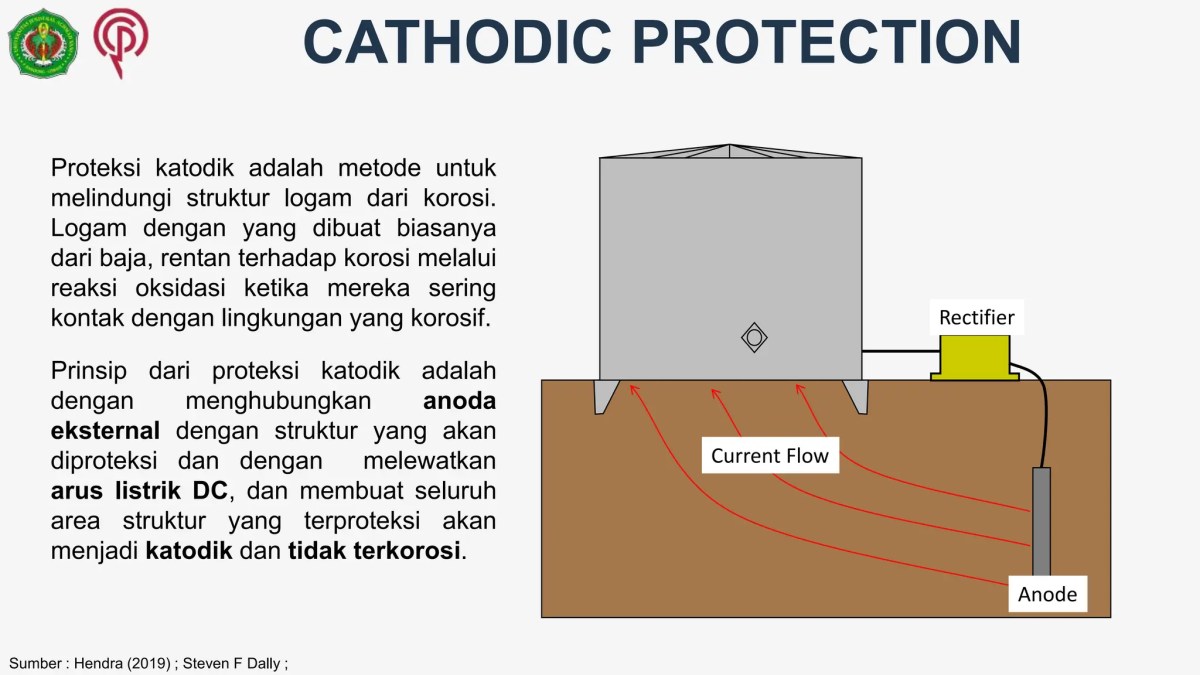
Source: slidesharecdn.com
Dalam lingkungan industri yang padat dengan infrastruktur listrik dan logam, anoda magnesium bisa menghadapi tantangan tak terduga. Salah satunya adalah interferensi dari arus liar (stray current). Arus ini berasal dari sumber DC eksternal seperti sistem rel kereta listrik, tram, atau bahkan instalasi katodik tetangga yang tidak terkoordinasi. Arus ini mengalir melalui tanah, mencari jalan kembali ke sumbernya.
Jika arus liar ini memasuki struktur pipa yang dilindungi magnesium dan keluar melalui anoda magnesium, efeknya bisa dramatis. Pada titik dimana arus meninggalkan anoda (berperan sebagai anoda yang tidak diinginkan), laju korosi magnesium akan meningkat secara drastis, jauh melampaui laju pengorbanan yang direncanakan. Anoda bisa habis dalam waktu singkat, dan yang lebih berbahaya, arus yang keluar dari titik lain di pipa bisa menyebabkan korosi parah pada struktur besi itu sendiri.
Solusi mitigasinya meliputi pemasangan bond kabel untuk mengalirkan arus dengan aman, penggunaan insulator listrik (insulating flange) untuk memisahkan bagian struktur, atau instalasi sistem drainase arus yang secara aktif mengalirkan arus liar kembali ke sumbernya dengan aman.
Fenomena Passivasi Permukaan Magnesium
Di beberapa kondisi, magnesium justru bisa menjadi terlalu “pasif”. Passivasi adalah pembentukan lapisan film oksida atau hidroksida yang sangat stabil, padat, dan tidak mudah larut di permukaan magnesium. Lapisan ini bersifat isolator dan menghalangi kontak antara logam magnesium dengan elektrolit, sehingga reaksi oksidasi terhambat dan arus proteksi yang dihasilkan menurun drastis. Fenomena ini sering terjadi pada lingkungan dengan pH sangat tinggi (basa kuat) atau pada air yang memiliki kandungan bikarbonat (HCO3-) tinggi dengan kesadahan tertentu.
Pencegahan passivasi menjadi kunci. Salah satu caranya adalah dengan menggunakan paduan magnesium yang dirancang khusus, misalnya dengan kandungan mangan (Mn) yang membantu produk korosi terbentuk dalam bentuk yang lebih porous dan mudah terlepas. Cara lain adalah dengan memastikan lingkungan di sekitar anoda tidak menjadi terlalu basa, misalnya dengan menggunakan backfill khusus seperti campuran bentonit, gipsum, dan natrium sulfat. Backfill ini menjaga kelembaban dan komposisi kimia yang ideal di sekitar anoda, mencegah pembentukan lapisan pasif yang rapat dan memastikan magnesium terus berkorosi secara terkendali.
Contoh kasus kegagalan terjadi pada tangki penyimpanan air industri yang dilindungi anoda magnesium di area dengan air tanah berkadar bikarbonat tinggi. Dalam dua tahun, pemeriksaan potensial menunjukkan proteksi tidak memadai. Investigasi menemukan anoda magnesium tertutup lapisan kerak putih yang keras dan padat (passivasi). Sebaliknya, contoh keberhasilan terlihat pada tangki bahan kimia bawah tanah di pabrik yang menggunakan backfill khusus dan anoda magnesium paduan. Setelah 8 tahun, anoda terkikis merata, potensial proteksi tetap dalam rentang aman, dan inspeksi fisik tangki menunjukkan tidak ada tanda korosi.
Inovasi Material Komposit untuk Masa Depan Proteksi Katodik
Magnesium murni, meski efektif, memiliki kekurangan seperti laju korosi yang terlalu cepat di beberapa media dan kecenderungan untuk membentuk produk korosi yang menempel kuat (passivasi). Inovasi untuk mengatasinya adalah melalui rekayasa paduan (alloy). Dengan menambahkan unsur lain dalam jumlah kecil, sifat elektrokimia dan fisik magnesium dapat dioptimalkan.
Penambahan aluminium (sekitar 6%) dan seng (sekitar 3%) menghasilkan paduan Mg-Al-Zn, seperti AZ63, yang sangat umum. Paduan ini memiliki potensial yang sedikit lebih positif (masih jauh lebih negatif daripada besi) tetapi lebih tahan terhadap korosi seragam, sehingga umurnya lebih panjang dan efisiensi arusnya lebih tinggi. Unsur mangan (Mn) sekitar 0.5% sering ditambahkan untuk meningkatkan ketahanan terhadap korosi galvanik antar butir dan membantu produk korosi yang terbentuk lebih mudah terlepas, mencegah passivasi.
Penelitian terbaru juga mengeksplorasi penambahan unsur tanah jarang (seperti Yttrium, Neodymium) atau kalsium untuk menciptakan paduan dengan performa lebih stabil pada suhu tinggi atau lingkungan yang sangat spesifik. Tujuannya selalu sama: mendapatkan anoda yang mengorbankan dirinya secara konsisten, dapat diprediksi, dan dengan produk sampingan yang tidak mengganggu.
Evolusi Material Anoda Magnesium
Perkembangan material anoda magnesium menunjukkan evolusi dari yang sederhana ke yang lebih canggih, menyesuaikan dengan tuntutan aplikasi teknik.
| Karakteristik | Magnesium Murni (Grade M1) | Magnesium Paduan (Mg-Al-Zn-Mn) | Material Komposit Generasi Baru |
|---|---|---|---|
| Potensial vs. CSE | -1.75 V (sangat negatif) | -1.55 s.d. -1.60 V | Dapat diatur (-1.5 s.d. -1.7 V) |
| Efisiensi Arus | ~50% | ~55-65% | Hingga 70%+ |
| Produk Korosi | Mg(OH)2, cenderung menempel | Lebih porous, mudah lepas | Dirancang untuk mudah tersapu |
Aplikasi Unggulan
| Air tawar, tanah resistivitas tinggi |
Standar untuk air laut & tanah kebanyakan |
Lingkungan spesifik (suhu tinggi, kandungan organik) |
|
Skenario Pita Magnesium di Petrokimia Masa Depan, Penggunaan Magnesium sebagai Pelindung Katodik untuk Besi
Bayangkan sebuah kompleks pabrik petrokimia dengan jaringan pipa bawah tanah yang sangat rumit, berliku, dan saling terhubung. Melindunginya dengan anoda batang konvensional akan membutuhkan ratusan titik galian dan instalasi yang mahal. Solusi futuristiknya adalah menggunakan pita atau ribbon magnesium komposit. Pita fleksibel ini, yang mungkin terdiri dari inti logam paduan magnesium berkinerja tinggi yang dibungkus dalam selubung konduktif khusus, dapat dikubur secara paralel dengan jalur pipa dalam parit yang panjang.
Pita ini bertindak sebagai anoda linier yang memberikan distribusi arus proteksi yang lebih merata sepanjang pipa, menghilangkan titik “dingin” yang kurang terlindungi. Sistem monitoring cerdas yang terintegrasi dengan sensor potensial sepanjang pipa dapat memberikan data real-time tentang kondisi proteksi dan sisa umur pita anoda. Ketika waktunya penggantian, pekerja hanya perlu menggali parit akses dan menarik pita lama sambil memasang yang baru, dengan gangguan minimal terhadap operasi pabrik yang sangat sensitif downtime-nya.
Pendekatan ini mengubah proteksi katodik dari pekerjaan titik menjadi sistem infrastruktur yang terintegrasi dan dapat dipelihara dengan efisien.
Ringkasan Penutup
Jadi, setelah menyelami dunia proteksi katodik, terlihat jelas bahwa magnesium bukan sekadar logam ringan biasa. Ia adalah penjaga yang setia, elemen yang dengan rendah hati menanggung kerusakan demi melindungi aset yang lebih besar. Dari penerapan empiris di masa lalu hingga inovasi paduan mutakhir hari ini, perjalanannya mencerminkan upaya manusia yang terus-menerus untuk berdamai dengan alam yang korosif.
Pada akhirnya, memilih magnesium sebagai pelindung katodik adalah sebuah keputusan yang menggabungkan kecerdasan sains, pertimbangan ekonomi, dan visi keberlanjutan. Ia mengajarkan bahwa terkadang, pengorbanan yang terukur dan terkendali justru adalah kunci untuk melestarikan hal-hal yang berharga. Dalam simfoni perlindungan logam yang tak terlihat, magnesium memainkan nada yang penting dan sangat menentukan.
Ringkasan FAQ
Apakah anoda magnesium bisa digunakan di air tawar?
Bisa, tetapi efektivitasnya umumnya lebih rendah dibandingkan di air asin atau tanah lembab karena konduktivitas elektrolit (air tawar) yang lebih rendah. Resistivitas lingkungan yang tinggi dapat membatasi aliran arus protektif.
Bagaimana cara mengetahui jika anoda magnesium sudah habis dan perlu diganti?
Anoda magnesium yang sudah habis biasanya akan terlihat menyusut secara fisik, berbentuk tidak beraturan, atau tertutup oleh produk korosi yang keras. Pengukuran potensial listrik antara besi yang dilindungi dan elektroda referensi adalah cara teknis yang akurat untuk memantau masa pakainya.
Apakah ada risiko lingkungan dari penggunaan magnesium yang terkikis?
Risikonya sangat minimal. Ion magnesium adalah unsur alami yang tidak beracun dan justru merupakan nutrisi bagi beberapa organisme. Produk korosinya umumnya berupa magnesium hidroksida yang bersifat basa, namun dalam skala aplikasi proteksi katodik, dampaknya sangat lokal dan kecil.
Bisakah magnesium melindungi logam selain besi atau baja?
Prinsipnya bisa, asalkan logam yang dilindungi lebih “mulia” (kurang aktif) daripada magnesium dalam seri galvanik. Magnesium dapat digunakan untuk melindungi baja, besi cor, dan beberapa jenis logam lainnya, tetapi tidak efektif untuk logam yang sudah sangat mulia seperti tembaga atau stainless steel pasif.
Mengapa anoda magnesium kadang dibungkus dalam bahan tertentu?
Pembungkus (biasanya dari kain atau bahan berpori) berfungsi sebagai “bagian belakang” yang diisi dengan campuran tanah liat atau bahan kimia untuk menjaga lingkungan sekitar anoda tetap lembab dan konduktif. Ini sangat penting untuk pemasangan di tanah kering agar anoda dapat bekerja optimal sejak awal.

