Perhitungan Entalpi Reaksi Hidratasi Etilena dari Energi Ikatan bukan sekadar rumus di papan tulis, melainkan kunci untuk membuka efisiensi di balik salah satu proses industri kimia yang paling vital. Bayangkan, dari molekul gas sederhana bernama etilena dan setetes air, terciptalah etanol yang menjadi jantung dari bahan bakar hingga produk sehari-hari. Proses transformasi ajaib ini menyimpan cerita tentang energi, ikatan kimia, dan bagaimana para ilmuwan merancang pabrik yang hemat biaya dan ramah lingkungan.
Dengan menganalisis kekuatan ikatan yang putus dan terbentuk, kita dapat memperkirakan panas yang dilepas atau diserap selama reaksi berlangsung. Metode perhitungan menggunakan data energi ikatan rata-rata ini menawarkan cara yang elegan dan cepat untuk mengintip sifat termodinamika suatu reaksi, meskipun dengan sederet asumsi. Artikel ini akan mengajak kita menyelami langkah-langkah perhitungannya, menganalisis keakuratannya, dan melihat implikasi nyatanya dalam dunia industri.
Konsep Dasar dan Latar Belakang
Dalam industri kimia, transformasi etilena (C₂H₄) menjadi etanol (C₂H₅OH) melalui reaksi hidratasi adalah proses yang sangat penting. Etilena, yang umumnya diperoleh dari cracking minyak bumi, diolah dengan menambahkan molekul air (H₂O) menggunakan katalis asam untuk menghasilkan etanol. Produk akhir ini memiliki beragam aplikasi, mulai dari bahan baku industri hingga bahan bakar nabati, menjadikan pemahaman mendalam tentang reaksi ini sangat krusial dari sisi ekonomi dan teknis.
Perhitungan entalpi reaksi hidratasi etilena dari energi ikatan memberikan gambaran mendalam tentang perubahan panas dalam reaksi kimia. Prinsip perhitungan energi serupa juga diterapkan untuk memahami kelarutan senyawa, seperti yang dijelaskan dalam analisis Konsentrasi ion Ca²⁺ pada larutan jenuh kalsium hidroksida pH 12,25. Dengan menguasai kedua konsep ini, pemahaman kita tentang termokimia dan kesetimbangan larutan menjadi lebih solid, yang akhirnya memperkaya analisis untuk reaksi seperti hidratasi etilena.
Inti dari analisis efisiensi proses kimia semacam ini sering terletak pada perhitungan termokimia, khususnya perubahan entalpi (ΔH). Entalpi reaksi secara sederhana adalah ukuran panas yang diserap atau dilepaskan oleh suatu sistem pada tekanan konstan selama reaksi berlangsung. Jika ΔH bernilai negatif, reaksi bersifat eksotermik dan melepaskan panas. Sebaliknya, nilai positif menandakan reaksi endotermik yang membutuhkan pasokan panas. Untuk reaksi hidratasi etilena, mengetahui nilai ΔH membantu insinyur merancang reaktor yang tepat, seperti menentukan kebutuhan sistem pemanas atau pendingin.
Sebuah pendekatan teoretis yang elegan untuk memperkirakan ΔH adalah dengan menggunakan data energi ikatan rata-rata. Prinsipnya berdasar pada hukum kekekalan energi: energi total yang dibutuhkan untuk memutus semua ikatan dalam reaktan, dikurangi energi total yang dilepaskan ketika semua ikatan baru dalam produk terbentuk, akan memberikan perkiraan perubahan entalpi reaksi. Metode ini memberikan gambaran cepat tanpa perlu data entalpi pembentukan standar yang lebih spesifik.
Energi Ikatan Kunci dalam Reaksi Hidratasi
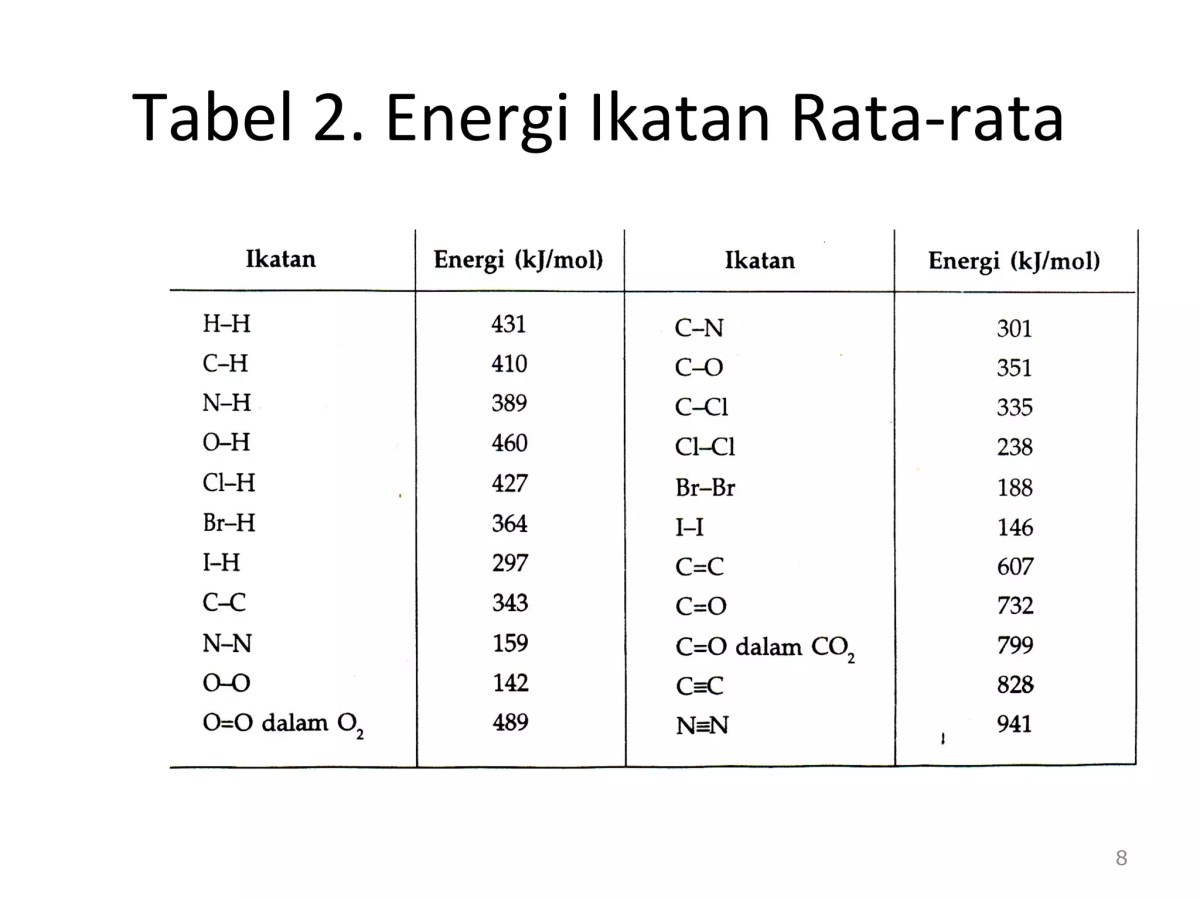
Untuk menghitung ΔH reaksi hidratasi etilena, kita perlu fokus pada ikatan-ikatan yang mengalami perubahan signifikan. Ikatan rangkap dua C=C pada etilena dan ikatan O-H pada air akan terputus. Sementara itu, dalam produk etanol, terbentuk ikatan C-O dan O-H yang baru, serta ikatan C-C berubah dari tipe ikatan rangkap menjadi ikatan tunggal. Berikut adalah perbandingan energi ikatan rata-rata (dalam kJ/mol) yang relevan untuk reaktan dan produk.
| Jenis Ikatan | Pada Reaktan | Pada Produk | Energi Ikatan Rata-rata (kJ/mol) |
|---|---|---|---|
| C=C | Ada di C₂H₄ | Tidak ada (berubah jadi C-C) | 614 |
| C-C | Tidak ada (masih berupa C=C) | Ada di C₂H₅OH | 347 |
| O-H | Ada di H₂O | Ada (baru) di C₂H₅OH | 463 |
| C-H | Ada di C₂H₄ | Ada di C₂H₅OH | 413 |
| C-O | Tidak ada | Ada di C₂H₅OH | 358 |
Perlu dicatat bahwa ikatan C-H dan O-H yang tidak terlibat langsung dalam reaksi inti tetap ada, namun nilainya sering kali saling menghitung dalam perhitungan kasar karena jumlahnya sama di kedua sisi. Fokus utama adalah pada ikatan yang benar-benar berubah.
Metodologi Perhitungan dengan Energi Ikatan
Menghitung perubahan entalpi dengan energi ikatan mengikuti logika yang cukup intuitif. Bayangkan proses reaksi terjadi dalam dua tahap teoretis: pertama, semua ikatan dalam molekul reaktan diputus hingga menjadi atom-atom bebas (membutuhkan energi), lalu atom-atom tersebut menyusun diri membentuk ikatan baru pada produk (melepaskan energi). Selisih antara energi yang dilepaskan dan energi yang dibutuhkan inilah ΔH reaksi.
Langkah-langkah Perhitungan Sistematis, Perhitungan Entalpi Reaksi Hidratasi Etilena dari Energi Ikatan
Untuk reaksi hidratasi etilena: C₂H₄ + H₂O → C₂H₅OH, kita dapat mengidentifikasi dan menghitung energi pemutusan dan pembentukan ikatan dengan langkah-langkah berikut.
- Identifikasi Ikatan yang Putus (Reaktan):
Pada molekul etilena (C₂H₄), satu ikatan C=C (614 kJ/mol) dan empat ikatan C-H (4 x 413 kJ/mol) diputus. Pada molekul air (H₂O), dua ikatan O-H (2 x 463 kJ/mol) diputus. Total energi yang dibutuhkan adalah jumlah dari semua energi ikatan ini. - Identifikasi Ikatan yang Terbentuk (Produk):
Pada molekul etanol (C₂H₅OH), ikatan-ikatan yang terbentuk adalah: satu ikatan C-C (347 kJ/mol), satu ikatan C-O (358 kJ/mol), lima ikatan C-H (5 x 413 kJ/mol), dan satu ikatan O-H (463 kJ/mol). Total energi yang dilepaskan adalah jumlah energi ikatan yang terbentuk. - Rumus dan Perhitungan:
ΔH reaksi = Σ Energi Ikatan yang Putus (Reaktan)
-Σ Energi Ikatan yang Terbentuk (Produk).
Demonstrasi Perhitungan Numerik
Source: slidesharecdn.com
Dalam perhitungan entalpi reaksi hidratasi etilena dari energi ikatan, kita mengandalkan ketepatan data numerik. Prinsip ketelitian ini serupa dengan saat kita menentukan Persamaan Garis Melalui Titik (-3,6) dan (1,4) , di mana akurasi titik krusial untuk hasil akhir. Dengan pendekatan yang sama, analisis energi ikatan pun membutuhkan presisi tinggi agar prediksi perubahan entalpi dalam reaksi kimia ini menjadi valid dan dapat diandalkan.
Mari kita masukkan angka-angka berdasarkan data energi ikatan rata-rata. Pertama, kita hitung total energi untuk memutus semua ikatan dalam reaktan.
Energi Pemutusan Ikatan = [1*(C=C) + 4*(C-H) + 2*(O-H)]
= [1*(614) + 4*(413) + 2*(463)] kJ/mol
= [614 + 1652 + 926] kJ/mol
= 3192 kJ/mol
Kedua, kita hitung total energi yang dilepaskan saat semua ikatan dalam produk terbentuk.
Energi Pembentukan Ikatan = [1*(C-C) + 1*(C-O) + 5*(C-H) + 1*(O-H)]
= [1*(347) + 1*(358) + 5*(413) + 1*(463)] kJ/mol
= [347 + 358 + 2065 + 463] kJ/mol
= 3233 kJ/mol
Terakhir, kita cari selisihnya untuk mendapatkan ΔH reaksi.
ΔH reaksi = 3192 kJ/mol – 3233 kJ/mol = -41 kJ/mol
Hasil perhitungan ini menunjukkan bahwa reaksi hidratasi etilena diperkirakan bersifat eksotermik dengan pelepasan panas sekitar 41 kJ/mol.
Analisis Data dan Pembahasan
Hasil perhitungan kita sebesar -41 kJ/mol memberikan estimasi awal yang menarik. Namun, ketika dibandingkan dengan nilai eksperimen atau data termokimia yang lebih akurat (misalnya dari entalpi pembentukan standar), nilai ΔH untuk hidratasi etilena umumnya berada di kisaran -44 hingga -45 kJ/mol. Terdapat sedikit perbedaan sekitar 3-4 kJ/mol antara hasil metode energi ikatan dan nilai literatur.
Penyimpangan ini bukanlah suatu kesalahan, melainkan mencerminkan keterbatasan inherent dari metode energi ikatan rata-rata. Metode ini mengasumsikan bahwa kekuatan suatu ikatan, misalnya ikatan C-H, adalah sama di semua molekul, padahal kenyataannya lingkungan kimia sekitar ikatan mempengaruhi kekuatannya. Asumsi ini menjadi khususnya problematik untuk molekul yang tidak jenuh seperti etilena. Ikatan C=C dan ikatan C-H yang berada di sebelah ikatan rangkap (ikatan vinil C-H) memiliki karakter yang sedikit berbeda dibandingkan ikatan serupa dalam alkana seperti etanol.
Faktor Penyebab Penyimpangan Hasil Perhitungan
Beberapa faktor kunci yang menyebabkan hasil perhitungan energi ikatan tidak selalu tepat persis dengan realita eksperimen antara lain:
- Energi Ikatan Rata-rata: Data yang digunakan adalah nilai rata-rata dari berbagai senyawa, sehingga tidak merepresentasikan secara sempurna ikatan dalam molekul spesifik etilena, air, atau etanol.
- Perubahan Energi Lain: Metode ini mengabaikan kontribusi energi lain seperti energi vibrasi, rotasi, dan interaksi van der Waals, yang juga berubah selama reaksi.
- Asumsi Tahapan Reaksi: Model pemutusan ikatan total menjadi atom bebas adalah simplifikasi ekstrem. Dalam kenyataannya, reaksi berlangsung melalui keadaan transisi yang kompleks.
“Meskipun memberikan nilai yang mendekati, metode energi ikatan rata-rata lebih cocok digunakan untuk estimasi cepat dan pemahaman konseptual tentang apakah suatu reaksi cenderung eksotermik atau endotermik, bukan untuk perhitungan desain proses yang presisi.”
Dengan memahami keterbatasan ini, kita dapat tetap menghargai utilitas metode ini sebagai alat pembelajaran dan pendekatan awal sebelum melakukan analisis yang lebih mendalam dengan data termodinamika yang lebih komprehensif.
Aplikasi dan Implikasi dalam Konteks yang Lebih Luas
Prediksi bahwa reaksi hidratasi etilena bersifat eksotermik memiliki implikasi langsung dalam perancangan pabrik. Pelepasan panas sebesar sekitar 45 kJ/mol (berdasarkan data eksperimen) berarti reaktor membutuhkan sistem pendingin yang efektif untuk menjaga suhu operasi tetap optimal. Jika panas yang dihasilkan tidak dibuang, suhu reaktor akan terus naik dan berpotensi merusak katalis, mengurangi selektivitas, atau bahkan menimbulkan bahaya keselamatan.
Dari sudut pandang stabilitas, nilai ΔH yang negatif mengindikasikan bahwa produk (etanol) secara keseluruhan lebih stabil secara termodinamika dibandingkan gabungan reaktannya (etilena dan air). Hal ini ditunjukkan oleh energi total ikatan dalam produk yang lebih rendah (atau lebih negatif) dibandingkan reaktan. Namun, perlu diingat bahwa reaksi masih memerlukan katalis dan kondisi tertentu untuk berjalan dengan laju yang ekonomis, karena faktor kinetika (energi aktivasi) juga berperan penting.
Visualisasi Proses Pemutusan dan Pembentukan Ikatan
Bayangkan sebuah ilustrasi yang menggambarkan proses ini. Di sisi kiri, terdapat molekul etilena yang digambarkan dengan dua atom karbon terhubung oleh dua garis pendek (ikatan rangkap dua) dan masing-masing mengikat dua atom hidrogen. Di sebelahnya, molekul air dengan atom oksigen terikat pada dua hidrogen. Panah panas mengarah ke sistem, melambangkan energi yang diserap untuk memutus ikatan. Ikatan C=C yang kokoh dan ikatan O-H pada air mulai meregang dan putus.
Di bagian tengah ilustrasi, atom-atom bebas (C, H, O) berada dalam keadaan tidak terikat untuk sesaat. Kemudian, di sisi kanan, atom-atom tersebut menyusun diri kembali. Dua atom karbon sekarang terhubung dengan satu garis tunggal (C-C). Salah satu atom karbon terikat pada gugus -OH melalui ikatan C-O yang baru. Susunan atom hidrogen juga berubah, membentuk lima ikatan C-H dan satu ikatan O-H pada gugus hidroksil.
Perhitungan entalpi reaksi hidratasi etilena dari energi ikatan memerlukan analisis yang cermat, mirip bagaimana kita mempelajari pola gerak dasar. Pemahaman tentang Empat Macam Gerak Lokomotor mengajarkan kita tentang struktur dan variasi, prinsip yang juga berlaku saat menganalisis pemutusan dan pembentukan ikatan kimia untuk menentukan perubahan panas dalam reaksi tersebut secara teoretis.
Dari proses penyusunan ulang ini, memancar energi panas ke lingkungan, yang divisualisasikan dengan panah panas keluar dari molekul etanol yang baru terbentuk.
Eksperimen Pemikiran dan Variasi Kondisi: Perhitungan Entalpi Reaksi Hidratasi Etilena Dari Energi Ikatan
Menarik untuk mengeksplorasi bagaimana perhitungan ini akan berubah jika kita mengganti etilena dengan alkena lain. Prinsipnya tetap sama, tetapi detail ikatan yang putus dan terbentuk akan berbeda, terutama terkait dengan ikatan rangkap C=C dan jumlah ikatan C-H yang berubah jenisnya. Perubahan ini akan mempengaruhi total energi pemutusan dan pembentukan, sehingga nilai ΔH reaksi hidratasi juga akan berbeda.
Berdasarkan analisis energi ikatan murni, pengaruh suhu dan tekanan terhadap nilai ΔH reaksi itu sendiri relatif kecil untuk rentang kondisi operasi biasa. Entalpi reaksi standar (ΔH°) dihitung pada kondisi referensi. Namun, suhu dan tekanan sangat mempengaruhi arah kesetimbangan reaksi (melalui konstanta kesetimbangan K) dan laju reaksi. Reaksi eksotermik seperti ini, menurut prinsip Le Chatelier, akan lebih disukai pada suhu rendah.
Tetapi suhu rendah juga memperlambat laju reaksi, sehingga dalam industri dicari titik optimal yang menghasilkan konversi dan laju yang ekonomis.
Proyeksi Perhitungan ΔH untuk Beberapa Alkena
Dengan menggunakan metodologi yang sama dan asumsi energi ikatan rata-rata yang konsisten, kita dapat memproyeksikan perkiraan ΔH untuk hidratasi beberapa alkena lain. Perhitungan ini menyederhanakan dengan menganggap semua ikatan C-H dan C-C memiliki energi yang sama, dan hanya fokus pada perubahan ikatan di sekitar situs reaksi (C=C yang menjadi C-C dan terbentuknya C-O dan O-H baru). Berikut tabel proyeksinya.
| Alkena | Reaksi Hidratasi Menjadi | Ikatan Kunci yang Berubah | Proyeksi ΔH (kJ/mol)* |
|---|---|---|---|
| Propilena (C₃H₆) | 2-Propanol | 1 C=C, 1 C-H (sekunder) putus; 1 C-C, 1 C-O, 1 C-H (baru) terbentuk. | ≈ -40 hingga -45 |
| 1-Butena (C₄H₈) | 1-Butanol | 1 C=C, 1 C-H (primer) putus; 1 C-C, 1 C-O, 1 C-H (baru) terbentuk. | ≈ -40 hingga -45 |
| Siklobuten (C₄H₆) | Siklobutanol | 1 C=C (dalam cincin), strain cincin mempengaruhi; 1 C-C, 1 C-O terbentuk. Strain cincin yang berbeda sangat mempengaruhi. | Bervariasi, bisa lebih atau kurang eksotermik akibat energi strain. |
*Catatan: Nilai-nilai ini adalah perkiraan kasar berdasarkan model energi ikatan sederhana. Nilai eksperimen yang sebenarnya dapat berbeda karena faktor-faktor seperti stabilitas relatif isomer alkohol yang dihasilkan dan pengaruh gugus alkil.
Ringkasan Penutup
Melalui penelusuran Perhitungan Entalpi Reaksi Hidratasi Etilena dari Energi Ikatan, kita diajak untuk melihat lebih dari sekadar angka. Nilai entalpi negatif yang diperoleh bukanlah akhir, melainkan pintu gerbang untuk memahami stabilitas molekul produk, merancang reaktor yang optimal, dan bahkan memprediksi perilaku senyawa sejenis. Meski memiliki keterbatasan, pendekatan ini tetap menjadi alat konseptual yang powerful, mengajarkan bahwa terkadang, rahasia besar sebuah reaksi kimia tersembunyi dalam kekuatan ikatan-ikatan kecil yang membentuknya.
Pemahaman ini adalah fondasi bagi inovasi proses kimia yang lebih cerdas dan berkelanjutan ke depannya.
Pertanyaan yang Sering Diajukan
Apakah metode energi ikatan bisa digunakan untuk semua jenis reaksi?
Metode ini paling baik untuk reaksi sederhana di fase gas. Akurasinya menurun untuk reaksi yang melibatkan ion, senyawa dengan struktur resonansi, atau molekul dengan strain ikatan tinggi seperti cincin kecil.
Mengapa hasil perhitungan energi ikatan sering berbeda dengan nilai eksperimen?
Perbedaan muncul karena metode menggunakan nilai energi ikatan rata-rata dari berbagai senyawa, sehingga tidak memperhitungkan pengaruh spesifik lingkungan molekul, interaksi sterik, atau perubahan entropi dalam reaksi.
Bagaimana cara meningkatkan akurasi perhitungan entalpi selain menggunakan energi ikatan?
Akurasi yang lebih tinggi dapat diperoleh dengan metode termokimia seperti Hukum Hess menggunakan data entalpi pembentukan standar, atau melalui perhitungan komputasi kimia kuantum yang lebih detail.
Apa hubungan antara tanda entalpi reaksi (negatif/positif) dengan kemudahan proses berlangsung?
Entalpi reaksi negatif (eksotermik) mengindikasikan reaksi cenderung mudah melepaskan panas, tetapi kemudahan berlangsungnya reaksi juga sangat bergantung pada faktor kinetika seperti energi aktivasi dan kondisi operasi.
