Periode 4 mengandung 18 unsur, periode 3 hanya 8 unsur – Periode 4 mengandung 18 unsur, periode 3 hanya 8 unsur, sebuah perbedaan mendasar yang mengungkap cerita kompleksitas atom di balik keteraturan tabel periodik. Perbedaan jumlah ini bukanlah kebetulan, melainkan konsekuensi langsung dari prinsip-prinsip mekanika kuantum yang mengatur pengisian elektron dalam struktur atom. Pola pengisian elektron pada kulit dan subkulit yang berbeda menjadi kunci untuk memahami mengapa kapasitas setiap periode berubah secara dramatis.
Periode ketiga, yang dimulai dari natrium dan diakhiri argon, hanya mengisi subkulit 3s dan 3p, sehingga terbatas pada delapan unsur. Sebaliknya, setelah subkulit 3p terisi penuh, elektron berikutnya pada periode keempat mulai mengisi subkulit 4s yang lebih tinggi energinya, sebelum akhirnya “masuk” untuk mengisi sepuluh elektron pada subkulit 3d yang sebelumnya kosong. Keberadaan subkulit 3d inilah yang menambahkan sepuluh unsur transisi, memperluas periode keempat menjadi delapan belas unsur dan membuka dunia kimia yang jauh lebih kaya.
Dasar-Dasar Struktur Periodik Unsur: Periode 4 Mengandung 18 Unsur, Periode 3 Hanya 8 Unsur
Tabel periodik modern bukan sekadar daftar, melainkan peta yang teratur dari semua unsur kimia. Keteraturannya berasal dari konfigurasi elektron, yang menentukan sifat dan perilaku setiap atom. Dua konsep kunci untuk membaca peta ini adalah periode dan golongan. Periode adalah baris horizontal, yang nomornya menunjukkan jumlah kulit elektron utama yang terisi. Golongan adalah kolom vertikal, yang mengelompokkan unsur dengan konfigurasi elektron valensi serupa, sehingga memiliki sifat kimia yang mirip.
Perbedaan jumlah unsur antara periode 3 (8 unsur) dan periode 4 (18 unsur) berakar pada cara elektron mengisi orbital. Pada periode 3, pengisian hanya terjadi pada kulit ketiga, tepatnya pada subkulit 3s dan 3p. Setelah subkulit 3p terisi penuh dengan 6 elektron, kulit itu mencapai konfigurasi stabil gas mulia (Argon). Prinsip Aufbau, yang menyatakan elektron mengisi orbital dari tingkat energi terendah ke tertinggi, menjelaskan lompatan ini.
Setelah 3p penuh, elektron berikutnya justru masuk ke orbital 4s yang tingkat energinya sedikit lebih rendah daripada 3d.
Prinsip Aufbau dan Pola Pengisian Elektron
Aturan Aufbau memandu jalannya elektron dalam mengisi orbital. Urutan pengisian dimulai dari 1s, kemudian 2s, 2p, 3s, 3p, lalu 4s, baru kemudian 3d. Inilah kunci perbedaan antara periode 3 dan 4. Periode 3 berakhir ketika subkulit 3p terisi penuh, sehingga hanya memuat 8 unsur (dari Na 3s¹ hingga Ar 3p⁶). Sebaliknya, periode 4 dimulai dengan pengisian 4s (2 unsur), lalu dilanjutkan dengan pengisian sepuluh orbital 3d (10 unsur logam transisi), dan diakhiri dengan pengisian 4p (6 unsur).
Totalnya menjadi 18 unsur.
| Periode | Unsur (Contoh) | Konfigurasi Elektron Valensi | Blok |
|---|---|---|---|
| 3 | Natrium (Na) | 3s¹ | s |
| 3 | Aluminium (Al) | 3s² 3p¹ | p |
| 3 | Klorin (Cl) | 3s² 3p⁵ | p |
| 4 | Kalium (K) | 4s¹ | s |
| 4 | Kalsium (Ca) | 4s² | s |
| 4 | Skandium (Sc) | 3d¹ 4s² | d |
| 4 | Besi (Fe) | 3d⁶ 4s² | d |
Analisis Jumlah Unsur pada Periode 3 dan 4
Perbedaan signifikan dalam jumlah unsur antara kedua periode ini bukanlah kebetulan, melainkan konsekuensi langsung dari struktur elektronik atom. Periode 3 mewakili transisi yang sederhana dan langsung, sementara periode 4 memperkenalkan kompleksitas baru yang memperluas dunia kimia secara dramatis.
Batasan Periode 3 dan Ekspansi Periode 4
Periode 3 hanya menampung 8 unsur karena hanya melibatkan pengisian dua subkulit: 3s (kapasitas 2 elektron) dan 3p (kapasitas 6 elektron). Setelah argon mencapai konfigurasi 3s² 3p⁶ yang stabil, kulit ketiga secara efektif “tertutup” untuk pengisian lebih lanjut menurut urutan energi saat itu. Elektron berikutnya memilih untuk mengisi orbital 4s yang lebih mudah diakses. Periode 4 kemudian berekspansi karena memasukkan blok-d.
Setelah 4s terisi, sepuluh elektron berikutnya masuk ke dalam orbital 3d, menciptakan sepuluh unsur logam transisi sebelum pengisian 4p dimulai.
Visualisasinya seperti ini: Bayangkan tabel periodik dibagi menjadi blok berdasarkan subkulit terakhir yang terisi. Blok-s (kiri, 2 kolom) dan blok-p (kanan, 6 kolom) membentuk wilayah utama. Periode 3 hanya terdiri dari blok ini. Di periode 4, sebuah “pulau” baru, blok-d (10 kolom), menyisip diri di antara blok-s dan blok-p, sehingga memperpanjang baris tersebut secara signifikan.
Unsur-Unsur Transisi Periode 4 dan Sifat Khasnya, Periode 4 mengandung 18 unsur, periode 3 hanya 8 unsur
Sepuluh unsur dari Skandium (Sc) hingga Seng (Zn) ini adalah jantung dari perbedaan sifat kimia antara periode 3 dan
4. Mereka bukan hanya tambahan jumlah, tetapi membawa karakter baru. Berikut adalah daftar unsur transisi pertama periode 4 beserta beberapa sifat khasnya:
- Skandium (Sc), Itrium (Y), Lantanum (La): Sering dikelompokkan sebagai logam tanah jarang, meskipun Sc dan Y berada di periode 4 dan 5. Mereka cenderung memiliki bilangan oksidasi +3.
- Titanium (Ti): Ringan, kuat, dan tahan korosi. Bilangan oksidasi +4 yang stabil membuat TiO₂ (titanium dioksida) sangat penting sebagai pigmen putih.
- Vanadium (V): Memiliki berbagai bilangan oksidasi (+2, +3, +4, +5), yang sering menampilkan warna larutan yang berbeda-beda.
- Kromium (Cr): Bilangan oksidasi +3 sangat stabil dan memberikan warna hijau/biru; +6 bersifat oksidator kuat dan beracun. Paduannya, seperti stainless steel, tahan karat.
- Mangan (Mn): Penting dalam produksi baja; ion Mn²⁺ memiliki warna merah muda lemah, dan MnO₄⁻ (permanganat) berwarna ungu tua dan merupakan oksidator kuat.
- Besi (Fe): Logam paling vital dalam peradaban modern. Memiliki bilangan oksidasi +2 dan +3, dengan Fe³⁺ lebih stabil di udara. Inti besi adalah penyebab medan magnet Bumi.
- Kobalt (Co): Digunakan dalam paduan super dan baterai lithium-ion. Ion Co²⁺ memberikan warna biru khas, seperti pada kaca dan keramik.
- Nikel (Ni): Tahan korosi, digunakan untuk pelapis dan paduan. Katalis penting dalam industri dan dalam proses pemurnian hidrogen.
- Tembaga (Cu): Konduktor listrik dan panas yang sangat baik. Bilangan oksidasi +1 dan +2, dengan senyawa Cu²⁺ (biru) sangat umum. Paduannya, perunggu dan kuningan, telah digunakan sejak zaman kuno.
- Seng (Zn): Logam yang relatif reaktif, digunakan untuk melapisi besi (galvanisasi) mencegah karat. Ion Zn²⁺ tidak berwarna dan penting sebagai kofaktor dalam banyak enzim.
Implikasi Perbedaan Jumlah Unsur terhadap Sifat Kimia
Keberadaan blok-d di periode 4 tidak hanya menambah variasi unsur, tetapi juga mengacak dan memperkaya tren periodik yang terlihat lebih linear di periode 3. Sifat-sifat seperti ukuran atom dan kecenderungan melepas elektron menjadi lebih kompleks dan menarik untuk diamati.
Pengaruh terhadap Tren Periodik dan Bilangan Oksidasi
Di periode 3, jari-jari atom berkurang secara konsisten dari kiri ke kanan seiring bertambahnya muatan inti, sementara energi ionisasi meningkat. Di periode 4, tren ini mengalami “tonjolan”. Jari-jari atom menyusut dengan cepat dari K ke Sc, lalu hampir konstan melalui deretan transisi karena elektron yang masuk ke orbital 3d yang dalam kurang efektif dalam perisai, sebelum akhirnya menyusut lagi di blok-p.
Energi ionisasi juga tidak naik mulus; misalnya, energi ionisasi Zn lebih tinggi daripada Cu karena konfigurasi 3d¹⁰ 4s² Zn yang penuh lebih stabil.
Variasi bilangan oksidasi juga jauh lebih dramatis. Unsur periode 3 seperti fosfor (biasanya +5, +3) atau sulfur (+6, +4, +2) memiliki variasi terbatas. Sebaliknya, logam transisi seperti mangan bisa menunjukkan bilangan oksidasi dari +2, +3, +4, +6, hingga +7. Besi biasa hadir sebagai Fe²⁺ dan Fe³⁺. Fleksibilitas ini muncul karena energi level orbital 3d dan 4s yang berdekatan, memungkinkan jumlah elektron valensi yang berbeda terlibat dalam ikatan.
Perbandingan Sifat Fisika dan Pembentukan Senyawa Kompleks
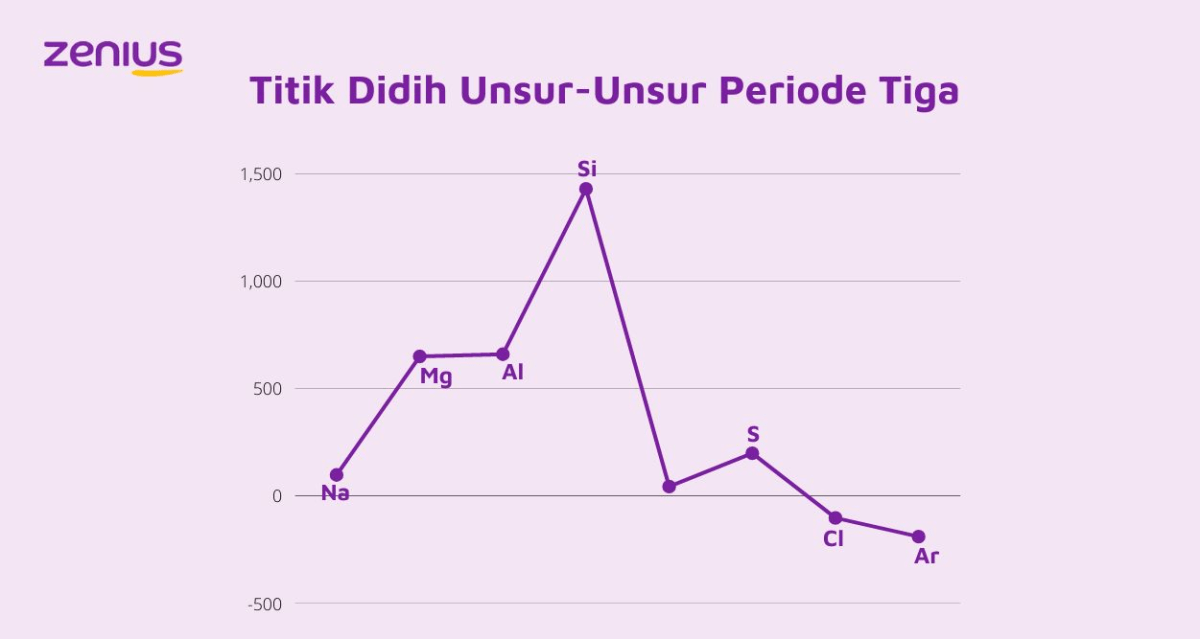
Sifat fisika, terutama titik leleh dan titik didih, menunjukkan kontras yang mencolok antara unsur utama periode 3 dan logam transisi periode 4. Unsur periode 3 bervariasi dari logam (Na, Mg, Al) dengan titik leleh rendah hingga menengah, melalui semikonduktor (Si), hingga nonlogam dengan titik didih rendah (Cl sebagai gas, Ar gas). Logam transisi, sebaliknya, umumnya memiliki titik leleh dan didih yang sangat tinggi karena ikatan logam yang kuat melibatkan elektron d.
| Kategori | Unsur (Periode 3) | Titik Leleh (°C, approx.) | Unsur (Periode 4 Transisi) | Titik Leleh (°C, approx.) |
|---|---|---|---|---|
| Logam | Magnesium (Mg) | 650 | Kromium (Cr) | 1907 |
| Metaloid | Silikon (Si) | 1414 | Mangan (Mn) | 1246 |
| Nonlogam | Fosfor (P, putih) | 44 | Besi (Fe) | 1538 |
| Gas Mulia | Argon (Ar) | -189 | Nikel (Ni) | 1455 |
Perbedaan paling mendalam mungkin terletak pada kemampuan membentuk senyawa kompleks. Unsur transisi periode 4 seperti kobalt, nikel, tembaga, dan besi mudah membentuk senyawa kompleks seperti [Co(NH₃)₆]³⁺ (kobalt heksammin) atau [Fe(CN)₆]⁴⁻ (ferosianida). Ini karena ion logam transisi memiliki orbital d yang tidak terisi penuh, dapat menerima pasangan elektron ligan, dan ukuran serta muatan intinya tepat. Unsur periode 3 umumnya tidak memiliki orbital d yang mudah diakses (kecuali Si, P, S yang bisa memperluas oktet, tetapi tidak membentuk kompleks warna-warni dengan ligan seperti amonia atau air dalam cara yang sama).
Konteks Historis dan Pengembangan Tabel Periodik
Perjalanan tabel periodik dari pengelompokan berdasarkan massa atom hingga pemahaman berdasarkan nomor atom dan konfigurasi elektron adalah sebuah narasi ilmiah yang epik. Perbedaan antara periode 3 dan 4, yang kini kita pahami secara elektronik, dahulu adalah teka-teki yang memacu prediksi berani.
Prediksi Mendeleev dan Penemuan Unsur Transisi
Dmitri Mendeleev, pada 1869, menyusun tabel berdasarkan massa atom dan sifat kimia yang periodik. Dia dengan jenius meninggalkan celah untuk unsur yang belum ditemukan, seperti “eka-aluminium,” “eka-boron,” dan “eka-silikon,” yang kemudian ternyata adalah Gallium (Ga), Skandium (Sc), dan Germanium (Ge)—semuanya berada di periode 4. Pola periode yang dia aman memungkinkan prediksi ini. Namun, tabelnya belum bisa sepenuhnya menjelaskan mengapa periode keempat lebih panjang; itu membutuhkan pemahaman tentang struktur atom abad ke-20.
Penemuan unsur-unsur periode 4, khususnya logam transisi, terjadi secara bertahap, sering terikat dengan perkembangan teknologi metalurgi dan analitis.
- Zaman Kuno – Abad Pertengahan: Besi (Fe), Tembaga (Cu), Seng (Zn) telah dikenal dan digunakan.
- Abad ke-18: Kobalt (Co) dan Nikel (Ni) diidentifikasi sebagai unsur tersendiri.
- Abad ke-19: Mangan (Mn), Kromium (Cr), Titanium (Ti), Vanadium (V) ditemukan berkat kemajuan kimia analitik dan elektrolisis.
- 1879: Lars Fredrik Nilson menemukan Skandium (Sc), mengkonfirmasi prediksi Mendeleev.
“Sifat-sifat unsur adalah fungsi periodik dari nomor atom mereka.” – Pernyataan Hukum Periodik Modern oleh Henry Moseley (1913). Kutipan ini menggeser dasar tabel dari massa atom ke nomor atom (muatan inti), yang akhirnya memberikan penjelasan teoretis yang kokoh untuk panjang periode yang berbeda.
Posisi dalam Blok Tabel Modern
Source: emaze.com
Dalam tabel periodik modern berbasis konfigurasi elektron, posisi unsur periode 3 dan 4 menjadi sangat jelas. Periode 3 seluruhnya terdiri dari unsur blok-s (Na, Mg) dan blok-p (Al hingga Ar). Periode 4 dimulai dengan dua unsur blok-s (K, Ca), kemudian diikuti oleh sepuluh unsur blok-d (dari Sc hingga Zn, logam transisi), dan diakhiri oleh enam unsur blok-p (dari Ga hingga Kr).
Pengelompokan ini secara visual dan konseptual menjelaskan mengapa periode 4 adalah jembatan menuju dunia kimia yang lebih luas dan kompleks.
Aplikasi dan Contoh Unsur dalam Kehidupan Sehari-hari
Dari smartphone hingga struktur bangunan, dari proses biologis dalam tubuh kita hingga cat di dinding, unsur-unsur periode 3 dan 4 adalah aktor utama di panggung kehidupan modern. Namun, keragaman yang dibawa oleh logam transisi periode 4 memberikan palet aplikasi yang jauh lebih kaya dan berwarna.
Peran Vital Unsur Periode 4 dalam Industri dan Biologi
Unsur-unsur periode 4 bukanlah penghuni pasif tabel periodik. Besi (Fe) adalah tulang punggung industri konstruksi dan otomotif. Tembaga (Cu) adalah darah dari jaringan listrik dan elektronik kita karena konduktivitasnya yang luar biasa. Seng (Zn) melindungi besi dari karat melalui galvanisasi dan merupakan mineral esensial untuk fungsi kekebalan tubuh. Kromium (Cr) memberikan kilau tahan karat pada peralatan dapur dan bumper mobil.
Kobalt (Co) adalah komponen kritis dalam baterai lithium-ion yang menggerakkan perangkat portabel dan mobil listrik. Mangan (Mn) digunakan dalam produksi baja untuk meningkatkan kekerasan dan ketahanan.
Perbandingan Kegunaan Unsur Periode 3 dan Periode 4
Unsur periode 3 memiliki aplikasi penting namun cenderung lebih terspesialisasi. Silikon (Si) adalah raja semikonduktor, fondasi dari seluruh industri mikrochip dan panel surya. Magnesium (Mg) digunakan dalam paduan ringan untuk komponen pesawat dan roda kemudi. Aluminium (Al) untuk kemasan dan badan pesawat karena ringan. Fosfor (P) untuk pupuk.
Sementara itu, logam transisi periode 4 sering menggabungkan beberapa sifat sekaligus: kekuatan, titik leleh tinggi, ketahanan korosi, warna, sifat magnetik, dan kemampuan katalitik. Kombinasi ini membuatnya tidak tergantikan untuk aplikasi yang menuntut performa tinggi.
Senyawa Penting dari Periode 3 dan 4
- Dari Periode 3:
- SiO₂ (Silika): Dasar kaca, keramik, dan chip komputer.
- Al₂O₃ (Alumina): Digunakan sebagai abrasif, dalam keramik, dan sebagai bahan dasar untuk ekstraksi aluminium.
- NaCl (Natrium Klorida): Garam dapur dan bahan baku industri kimia.
- H₃PO₄ (Asam Fosfat): Bahan pupuk dan penambah rasa pada minuman bersoda.
- Dari Periode 4:
- Fe₂O₃ (Hematit): Bijih besi utama dan pigmen merah (oker).
- CuSO₄·5H₂O (Tembaga(II) Sulfat Pentahidrat): Fungisida dan reagen laboratorium.
- KMnO₄ (Kalium Permanganat): Disinfektan dan oksidator kuat dalam sintesis kimia.
- TiO₂ (Titanium Dioksida): Pigmen putih super pada cat, plastik, dan tabir surya.
- [Ag(NH₃)₂]⁺ (Ion Diamminperak): Senyawa kompleks yang digunakan dalam cermin perak dan tes Tollens untuk gula pereduksi.
Alasan mengapa periode 4, khususnya logam transisinya, memberikan lebih banyak variasi aplikasi teknologi kembali pada sifat elektroniknya. Kemampuan untuk memiliki berbagai bilangan oksidasi, membentuk senyawa berwarna dan kompleks, serta bertindak sebagai katalis yang efisien (seperti nikel dalam hidrogenasi atau besi dalam proses Haber) adalah keunggulan yang tidak dimiliki oleh kebanyakan unsur periode 3. Singkatnya, periode 4 memperkenalkan “kecerdikan” kimia yang memungkinkan teknologi maju yang kita andalkan hari ini.
Penutupan Akhir
Dengan demikian, perbandingan antara periode 3 dan 4 menyajikan narasi yang jelas tentang evolusi kompleksitas dalam tabel periodik. Perbedaan mendasar dari sepuluh unsur tambahan di periode 4, yang berasal dari pengisian subkulit-d, tidak hanya sekadar menambah jumlah, tetapi secara fundamental mengubah lanskap sifat kimia dan fisika. Dari tren periodik yang terinterupsi hingga kelimpahan aplikasi teknologi, keberagaman ini menegaskan bahwa aturan pengisian elektron adalah arsitek utama yang membentuk keragaman materi di alam semesta, di mana setiap lonjakan kapasitas periode menandai babak baru dalam kimia unsur.
Pertanyaan yang Sering Muncul
Mengapa pengisian elektron “melompat” dari 3p ke 4s, bukannya langsung ke 3d?
Hal ini terjadi karena prinsip Aufbau dan aturan Hund. Berdasarkan urutan energi, subkulit 4s memiliki energi yang sedikit lebih rendah daripada subkulit 3d untuk atom dalam keadaan dasar (netral). Oleh karena itu, elektron akan mengisi orbital 4s terlebih dahulu sebelum mulai mengisi orbital 3d.
Apakah semua periode setelah ke-4 mengandung 18 unsur?
Tidak. Periode 5 juga mengandung 18 unsur, mengikuti pola yang sama dengan periode 4. Namun, periode 6 dan 7 lebih panjang lagi karena adanya pengisian subkulit 4f dan 5f (unsur lantanida dan aktinida), yang masing-masing mengandung 32 unsur.
Bagaimana perbedaan jumlah unsur ini mempengaruhi panjang fisik setiap periode dalam tabel periodik modern?
Dalam tabel periodik bentuk standar, periode 3 dan 4 ditampilkan sebagai baris yang terpisah. Periode 3 yang pendek (8 unsur) langsung diikuti oleh periode 4 yang lebih panjang (18 unsur). Sepuluh unsur tambahan di periode 4 (logam transisi) ditempatkan di tengah tabel, memisahkan blok-s kiri (Golongan 1 dan 2) dengan blok-p kanan (Golongan 13 hingga 18).
Apakah ada unsur gas mulia di akhir periode 4 seperti di periode 3?
Ya. Sama seperti periode 3 yang diakhiri argon (Ar, gas mulia), periode 4 juga diakhiri oleh sebuah gas mulia, yaitu kripton (Kr), dengan nomor atom 36. Pola ini berlanjut untuk periode-periode berikutnya.


