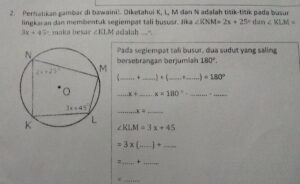
Persamaan Reaksi Dekarboksilasi Oksidatif Sederhana merupakan gerbang penting dalam dunia kimia organik dan biokimia, di mana molekul melepaskan karbon dioksida sekaligus mengalami perubahan tingkat oksidasi. Reaksi ini bukan sekadar proses pelepasan gugus, melainkan sebuah transformasi mendasar yang mengubah identitas suatu senyawa, seringkali mempersiapkannya untuk rangkaian reaksi selanjutnya yang lebih kompleks.
Pada intinya, reaksi ini menargetkan asam-asam karboksilat tertentu, seperti asam alfa-keto, untuk melepaskan gugus karboksil (-COOH) sebagai CO2. Yang membedakannya dari dekarboksilasi biasa adalah kehadiran agen oksidator yang secara bersamaan mengoksidasi sisa molekul, misalnya mengubah gugus karbonil menjadi turunan asam yang lebih reaktif seperti asetil-KoA. Proses ini menjadi fondasi bagi banyak jalur metabolisme energi dalam sel hidup.
Pengertian Dasar dan Prinsip Reaksi
Dalam dunia kimia organik, reaksi dekarboksilasi oksidatif sederhana merupakan transformasi molekuler yang cukup elegan dan penuh makna. Pada intinya, reaksi ini adalah proses pelepasan gugus karboksil (-COOH) dari suatu senyawa organik dalam bentuk karbon dioksida (CO₂), yang disertai dengan perubahan tingkat oksidasi pada atom karbon yang tersisa. Perubahan oksidasi inilah yang membedakannya dari dekarboksilasi biasa, karena melibatkan kehilangan elektron (oksidasi) sekaligus kehilangan gugus karboksil.
Prinsip dasarnya berpusat pada molekul yang memiliki gugus karbonil (C=O) berdekatan dengan gugus karboksil, seperti pada asam alfa-keto. Kedekatan ini memungkinkan pembentukan keadaan transisi yang stabil, memfasilitasi pelepasan CO₂. Selanjutnya, agen oksidator yang hadir dalam campuran reaksi segera “menangkap” elektron yang dilepaskan dari sisa molekul, mengoksidasinya menjadi gugus fungsi yang lebih tinggi, seperti gugus asil atau keton. Reaksi ini berbeda dengan dekarboksilasi termal murni yang hanya mengandalkan panas untuk memutus ikatan, tanpa melibatkan perubahan bilangan oksidasi.
Perbandingan dengan Jenis Dekarboksilasi Lainnya
Dekarboksilasi tidak selalu melibatkan oksidasi. Berbagai metode lain digunakan tergantung pada substrat dan tujuan sintesis. Tabel berikut merangkum perbedaan mendasar antara beberapa jenis dekarboksilasi.
| Jenis Dekarboksilasi | Sumber Energi | Produk Utama | Contoh Senyawa Substrat |
|---|---|---|---|
| Dekarboksilasi Oksidatif | Oksidator kimia (seperti Fe³⁺, Cu²⁺, atau sistem enzimatik) | Karbon dioksida dan senyawa teroksidasi (aldehida, keton, atau turunan asil) | Asam α-keto (asam piruvat), asam β-keto (asam asetoasetat) |
| Dekarboksilasi Termal | Panas tinggi | Karbon dioksida dan alkana (atau turunannya) | Garam natrium karboksilat dari asam alifatik (misalnya, natrium asetat dengan soda kapur) |
| Dekarboksilasi Fotokimia | Cahaya (foton) | Karbon dioksida dan radikal bebas atau alkana | Asam peroksida tertentu atau ester nitrobenzil |
| Dekarboksilasi Enzimatis Non-oksidatif | Katalis enzim (biasanya memerlukan koenzim seperti piridoksal fosfat/PLP) | Karbon dioksida dan amina (dari asam amino) | Asam amino aromatik (misalnya, histidin, tirosin) |
Mekanisme Reaksi dan Tahapan
Mekanisme dekarboksilasi oksidatif sederhana dapat dijelaskan melalui serangkaian tahapan logis yang melibatkan pergerakan elektron. Meskipun detailnya bisa bervariasi tergantung oksidator, pola umumnya tetap konsisten, terutama untuk asam α-keto.
Tahapan Umum Mekanisme Reaksi
Mekanisme ini sering dimulai dengan aktivasi substrat. Berikut adalah alur reaksi yang disederhanakan dalam bentuk poin-poin berurutan:
- Aktivasi dan Dekarboksilasi: Atom karbon karbonil (C=O) yang bersebelahan dengan gugus karboksil bersifat elektrofilik. Dalam banyak kasus, katalis logam transisi (sebagai oksidator) dapat mengkoordinasi dengan atom oksigen karbonil, menarik kerapatan elektron dan semakin mempolarisasi ikatan. Hal ini memudahkan pemutusan ikatan antara gugus karboksil dan kerangka karbon, melepaskan molekul CO₂. Hasil sementara adalah suatu anion enolat atau karbanion yang terstabilisasi.
- Oksidasi Intermediet: Spesi anionik yang sangat reaktif ini dengan cepat ditangkap oleh agen oksidator. Oksidator (misalnya, ion logam seperti Fe³⁺) menerima elektron dari anion tersebut. Proses transfer elektron ini mengoksidasi karbon yang sebelumnya membentuk karbanion.
- Protonasi dan Pembentukan Produk Akhir: Setelah oksidasi, spesi yang terbentuk biasanya adalah kation asil atau radikal bebas yang sangat reaktif. Spesi ini kemudian akan mengalami protonasi dari lingkungan atau bereaksi lebih lanjut untuk membentuk produk yang stabil, paling sering berupa turunan asil (seperti asetil-KoA dalam biokimia) atau aldehida/keton sederhana dalam sistem kimia organik.
Ilustrasi pada Asam Piruvat, Persamaan Reaksi Dekarboksilasi Oksidatif Sederhana

Source: slidesharecdn.com
Mari kita ambil contoh konkret pada asam piruvat (CH₃COCOOH). Secara deskriptif, bayangkan struktur tiga karbonnya: gugus metil (CH₃-), diikuti gugus karbonil (C=O), dan terakhir gugus karboksil (-COOH). Reaksi dimulai dengan pelepasan atom karbon dari gugus karboksil beserta dua atom oksigennya sebagai CO₂. Setelah CO₂ pergi, tersisa struktur dua karbon (CH₃CO-) yang membawa muatan negatif (enolat) pada atom karbon yang sebelumnya terikat pada gugus karboksil.
Muatan negatif ini segera “diserahkan” kepada agen oksidator, seperti ion Fe³⁺ yang direduksi menjadi Fe²⁺. Setelah kehilangan elektron, kerangka dua karbon tersebut sekarang menjadi gugus asetil (CH₃C+=O) yang sangat reaktif. Dalam sel, gugus reaktif ini langsung ditangkap oleh koenzim A (KoA-SH) untuk membentuk asetil-KoA (CH₃C(O)-SCoA) yang stabil dan kaya energi.
Senyawa Substrat dan Contoh Spesifik
Tidak semua asam karboksilat mudah mengalami dekarboksilasi. Reaksi ini memiliki preferensi yang kuat terhadap substrat dengan struktur tertentu, di mana pelepasan CO₂ dapat menghasilkan intermediet yang distabilkan secara resonansi atau oleh efek elektronik lainnya.
Karakteristik Substrat Umum
Senyawa substrat yang paling umum adalah asam α-keto dan asam β-keto. Pada asam α-keto, gugus karboksil terikat langsung pada atom karbon karbonil (C=O). Pada asam β-keto, terdapat satu atom karbon (methylene, -CH₂-) yang memisahkan gugus karbonil dan karboksil. Kedua struktur ini memungkinkan stabilisasi anion enolat atau karbanion yang terbentuk pasca-dekarboksilasi, baik melalui resonansi dengan gugus karbonil (pada α-keto) atau melalui delokalisasi muatan ke dua gugus karbonil (pada β-keto).
Contoh Persamaan Reaksi Kimia
Berikut adalah tiga contoh spesifik dengan persamaan reaksi setara:
- Asam Piruvat (α-keto): CH₃COCOOH + [Oksidator] → CH₃CHO (asetaldehida) + CO₂. (Catatan: Dalam biokimia dengan sistem enzimatik lengkap, produknya adalah asetil-KoA, bukan asetaldehida).
- Asam Oksaloasetat (α-keto): HOOC-CH₂-CO-COOH + [Oksidator] → HOOC-CH₂-CHO (asam malonat semialdehida) + CO₂.
- Asam Asetoasetat (β-keto): CH₃COCH₂COOH → CH₃COCH₃ (aseton) + CO₂. Reaksi ini sering terjadi secara termal tanpa memerlukan oksidator kuat karena stabilisasi intermediet enolat yang sangat baik.
Mengapa asam α-keto begitu rentan? Kunci kerentanannya terletak pada gugus karbonil yang berdekatan. Setelah dekarboksilasi, pasangan elektron yang tersisa pada karbon dapat segera beresonansi dengan orbital π dari gugus karbonil di sebelahnya, membentuk anion enolat yang jauh lebih stabil daripada karbanion biasa. Stabilisasi resonansi ini secara drastis menurunkan energi aktivasi untuk tahap pelepasan CO₂, membuat reaksi berlangsung lebih mudah pada kondisi yang relatif ringan dibandingkan dengan asam karboksilat sederhana.
Pengaruh Substituen pada Rantai Karbon
Substituen pada rantai karbon dapat mempercepat atau menghambat reaksi. Gugus penarik elektron (seperti -NO₂, -CN) yang terikat dekat dengan gugus karboksil dapat meningkatkan sifat asam dari proton pada karbon alfa dan membantu menstabilkan intermediet bermuatan negatif, sehingga mempercepat dekarboksilasi. Sebaliknya, gugus pendorong elektron (seperti gugus alkil) akan menstabilkan bentuk asam karboksilat awal dan mendestabilkan intermediet anionik, sehingga memperlambat reaksi. Selain itu, substituen yang besar dapat menyebabkan halangan sterik yang menghambat pendekatan katalis atau oksidator ke situs reaksi.
Kondisi Reaksi dan Faktor Penentu
Agar dekarboksilasi oksidatif berjalan efisien dan menghasilkan produk yang diinginkan, kontrol terhadap kondisi reaksi mutlak diperlukan. Kondisi ini tidak hanya mempengaruhi kecepatan, tetapi juga selektivitas reaksi untuk mencegah pembentukan produk samping.
Kondisi Reaksi yang Diperlukan
Reaksi ini umumnya memerlukan keberadaan agen oksidator spesifik, yang bisa berupa garam logam transisi seperti ion feri (Fe³⁺) atau kupri (Cu²⁺), atau sistem oksidasi enzimatik yang kompleks dalam sistem biologis. Suhu biasanya dijaga pada rentang sedang hingga hangat (30°C hingga 70°C untuk banyak reaksi kimia, dan 37°C dalam tubuh). Lingkungan reaksi bisa sedikit asam hingga netral, karena kondisi basa yang kuat dapat menyebabkan reaksi samping seperti hidrolisis atau kondensasi aldol pada substrat karbonil.
Katalis logam sering berperan ganda sebagai oksidator dan katalis Lewis untuk mengaktivasi gugus karbonil.
Faktor Penentu Laju dan Hasil Reaksi
Beberapa faktor kritis menentukan seberapa cepat dan seberapa murni produk reaksi ini terbentuk.
| Pengaruh Faktor | Kondisi Optimal | Dampak pada Laju Reaksi | Dampak pada Hasil Produk |
|---|---|---|---|
| Jenis dan Konsentrasi Oksidator | Oksidator dengan potensial reduksi yang sesuai (misalnya, NAD⁺ dalam biokimia, atau Fe³⁺ dalam kimia organik). | Semakin kuat dan semakin tinggi konsentrasinya, laju oksidasi intermediet semakin cepat, mendorong keseluruhan reaksi. | Oksidator yang salah dapat menyebabkan over-oksidasi (misalnya, aldehida menjadi asam) atau reaksi samping radikal. |
| Suhu | Suhu sedang (menyesuaikan dengan stabilitas substrat dan oksidator). | Meningkatkan suhu umumnya meningkatkan laju reaksi dengan menyediakan lebih banyak energi untuk mengatasi energi aktivasi. | Suhu terlalu tinggi dapat menguraikan oksidator, substrat, atau produk, dan meningkatkan reaksi samping termal. |
| pH Lingkungan | pH netral hingga sedikit asam. | pH mempengaruhi bentuk protonasi substrat dan katalis. Kondisi optimal memaksimalkan laju langkah penentu. | pH terlalu asam dapat menghambat pembentukan anion enolat. pH terlalu basa dapat memicu dekarboksilasi non-oksidatif atau degradasi lain. |
| Struktur Substrat | Substrat dengan gugus penarik elektron di posisi alfa atau beta. | Substrat yang menstabilkan intermediet enolat/karbanion bereaksi jauh lebih cepat. | Menentukan jenis produk akhir (misalnya, asam α-keto cenderung memberi turunan asil, asam β-keto memberi keton). |
Kontrol kondisi yang ketat sangat penting untuk mencegah reaksi samping. Misalnya, tanpa oksidator yang cukup atau dengan waktu reaksi yang terlalu lama, intermediet yang reaktif dapat mengalami dimerisasi, polimerisasi, atau bereaksi dengan pelarut, yang akan menurunkan rendemen produk yang diinginkan secara signifikan.
Aplikasi dan Signifikansi dalam Biokimia: Persamaan Reaksi Dekarboksilasi Oksidatif Sederhana
Di luar laboratorium kimia sintetik, reaksi dekarboksilasi oksidatif memainkan peran yang benar-benar sentral dalam kehidupan. Reaksi ini adalah jembatan penting yang menghubungkan berbagai jalur metabolisme, menjadikannya fondasi bagi respirasi seluler dan produksi energi.
Peran dalam Siklus Asam Sitrat dan Hubungan dengan Glikolisis
Dalam metabolisme, tahap paling terkenal dari reaksi ini adalah konversi asam piruvat menjadi asetil-KoA, yang terjadi di mitokondria. Proses ini, yang dikatalisis oleh kompleks enzim piruvat dehidrogenase, secara resmi menghubungkan akhir glikolisis (di sitoplasma) dengan awal siklus Krebs (di mitokondria). Asam piruvat hasil glikolisis diangkut ke mitokondria, lalu mengalami dekarboksilasi oksidatif: kehilangan satu atom karbon sebagai CO₂, dan dua karbon sisanya (gugus asetil) ditransfer ke Koenzim A, membentuk asetil-KoA yang kaya energi.
Asetil-KoA inilah yang kemudian memasuki siklus Krebs untuk dioksidasi lebih lanjut, menghasilkan energi dalam bentuk ATP, NADH, dan FADH₂.
Konsekuensi penghambatan reaksi ini dalam jalur metabolisme bisa sangat parah. Sebagai contoh, kekurangan tiamin (vitamin B1), yang merupakan koenzim penting untuk kompleks piruvat dehidrogenase, akan menghentikan produksi asetil-KoA dari piruvat. Akibatnya, piruvat akan terakumulasi dan dialihkan menjadi asam laktat di sitoplasma, menyebabkan asidosis laktat. Sel-sel, terutama neuron yang sangat bergantung pada metabolisme aerobik, akan mengalami krisis energi karena siklus Krebs terhenti, yang dapat bermanifestasi sebagai penyakit seperti beri-beri atau ensefalopati Wernicke.
Produk Antara dan Nasib Selanjutnya
Produk antara kunci dari reaksi dekarboksilasi oksidatif dalam biokimia adalah gugus asil yang terikat pada Koenzim A, seperti asetil-KoA. Nasib molekul-molekul ini sangat menentukan. Asetil-KoA tidak hanya menjadi bahan bakar siklus Krebs, tetapi juga merupakan prekursor untuk biosintesis asam lemak, badan keton, dan kolesterol. Dengan demikian, reaksi dekarboksilasi oksidatif berfungsi sebagai titik percabangan metabolik yang mengatur apakah molekul nutrisi akan dioksidasi untuk energi atau disimpan sebagai cadangan.
Visualisasi dan Persamaan Kimia
Memahami reaksi ini akan lebih lengkap dengan menggambarkan alur transformasi molekulnya. Berikut adalah representasi deskriptif dan persamaan yang relevan.
Representasi Visual Dekarboksilasi Oksidatif Asam Piruvat
Bayangkan sebuah diagram alur sederhana. Dari kiri, terdapat molekul asam piruvat (CH₃-CO-COOH) yang digambarkan dengan tiga atom karbon dalam garis lurus. Panah pertama mengarah ke kanan, dengan label “Dekarboksilasi + Oksidasi”. Di atas panah ini tertulis “Kompleks Piruvat Dehidrogenase, NAD⁺, KoA-SH”. Hasilnya di sebelah kanan panah terbagi dua: Sebuah molekul karbon dioksida (O=C=O) yang terlepas, dan molekul asetil-KoA yang strukturnya lebih kompleks, dengan gugus asetil (CH₃-C=O) terikat pada atom sulfur Koenzim A yang digambarkan sebagai struktur besar.
Di bawah panah reaksi, ditulis produk sampingan reduksi: NADH + H⁺.
Persamaan Reaksi Kimia Setara
Berikut adalah dua persamaan reaksi penting dalam biokimia selain konversi piruvat:
- Konversi α-Ketoglutarat menjadi Suksinil-KoA dalam Siklus Krebs:
α-Ketoglutarat (HOOC-CH₂-CH₂-CO-COOH) + NAD⁺ + CoA-SH → Suksinil-KoA (HOOC-CH₂-CH₂-C(O)-SCoA) + CO₂ + NADH + H⁺.
Reaksi ini adalah dekarboksilasi oksidatif kedua dalam siklus Krebs, dikatalisis oleh kompleks α-ketoglutarat dehidrogenase. - Dekarboksilasi Oksidatif Asam Mevalonat (dalam Jalur Sintesis Kolesterol):
Asam mevalonat 5-fosfat mengalami tiga kali fosforilasi dan satu dekarboksilasi oksidatif untuk membentuk isopentenil pirofosfat (IPP), unit pembangun isoprenoid. Persamaan keseluruhannya kompleks, tetapi inti reaksi dekarboksilasinya melibatkan pelepasan CO₂ dari asam β-keto yang terfosforilasi dengan bantuan ATP dan NAD⁺.
Ilustrasi Naratif Perubahan Struktur Molekul
Mari telusuri perubahan pada asam piruvat. Awalnya, kita memiliki rantai lurus: atom karbon pertama (C1) berupa metil (CH₃-), terikat pada karbon kedua (C2) yang merupakan karbon karbonil (C=O). Karbon kedua ini terikat pada karbon ketiga (C3), yaitu gugus karboksil (-COOH). Selama reaksi, ikatan antara C2 dan C3 putus. Seluruh gugus karboksil (C3 beserta dua oksigennya) meninggalkan molekul sebagai CO₂.
Atom C2, yang sekarang hanya terikat pada C1 dan sebuah atom oksigen, untuk sesaat memiliki pasangan elektron bebas (muatan negatif). Elektron-elektron ini kemudian diambil oleh NAD⁺ (yang direduksi menjadi NADH). Setelah kehilangan elektron, C2 sekarang membentuk ikatan ganda dengan oksigennya (tetap sebagai karbonil) dan memiliki muatan parsial positif. Muatan positif ini dinetralkan ketika atom sulfur dari Koenzim A (KoA-SH) menyerang C2, membentuk ikatan tioester (C=O disisipi sulfur) yang kuat, menghasilkan asetil-KoA.
Jadi, perubahan utama adalah hilangnya satu atom karbon sebagai CO₂ dan transformasi gugus α-keto menjadi gugus asetil yang terikat pada pembawa (KoA).
Langkah Menulis Persamaan Reaksi yang Akurat
- Identifikasi Substrat dan Produk: Tentukan senyawa awal (asam α- atau β-keto) dan produk akhir yang diketahui (asetil-KoA, aldehida, keton, dll.).
- Hitung Atom Karbon: Pastikan jumlah atom karbon di kiri dan kanan reaksi konsisten. Ingat, satu atom karbon hilang sebagai CO₂.
- Sertakan Agen Oksidator dan Reduktor: Dalam persamaan setara, tuliskan spesies yang menerima elektron (oksidator, seperti NAD⁺, FAD, atau ion logam) di sisi reaktan, dan bentuk tereduksinya (NADH, FADH₂, atau ion logam dengan bilangan oksidasi lebih rendah) di sisi produk.
- Perhatikan Ko-faktor dan Kofaktor: Untuk reaksi biokimia, jangan lupa menyertakan molekul pembawa seperti Koenzim A (CoA-SH) di reaktan dan bentuk asil-KoA-nya di produk.
- Seimbangkan Muatan dan Atom Hidrogen: Setelah atom karbon dan oksigen seimbang, seimbangkan atom hidrogen dan muatan keseluruhan dengan menambahkan H⁺ (proton) di sisi yang sesuai.
Penutupan Akhir
Dari penjelasan mekanisme hingga aplikasi biokimianya, terlihat jelas bahwa dekarboksilasi oksidatif sederhana jauh lebih dari sekadar persamaan di atas kertas. Reaksi ini adalah mesin molekuler yang efisien, mendorong siklus energi sel dengan melepaskan karbon yang tidak diperlukan dan sekaligus menyiapkan kerangka karbon untuk tahap oksidasi berikutnya. Pemahaman mendalam tentang reaksi ini tidak hanya mengungkap keanggunan kimia organik tetapi juga membuka wawasan tentang bagaimana kehidupan pada tingkat seluler mengatur aliran energi dan materi dengan presisi yang menakjubkan.
Bagian Pertanyaan Umum (FAQ)
Apakah reaksi ini hanya terjadi pada makhluk hidup?
Tidak. Meskipun sangat sentral dalam biokimia, reaksi dekarboksilasi oksidatif juga dapat dilakukan di laboratorium dengan menggunakan agen oksidator kimiawi tertentu, meski kondisi dan katalisnya mungkin berbeda dengan enzim dalam sel.
Mengapa asam piruvat menjadi contoh yang paling sering dibahas?
Karena asam piruvat adalah produk akhir glikolisis dan substrat kunci yang menjembatani metabolisme karbohidrat dengan siklus Krebs melalui dekarboksilasi oksidatif menjadi asetil-KoA. Posisinya yang strategis dalam metabolisme membuatnya menjadi model pembelajaran yang ideal.
Apakah semua hasil dekarboksilasi oksidatif langsung bergabung dengan Koenzim A?
Tidak selalu. Meskipun pembentukan asetil-KoA dari piruvat adalah contoh klasik, produk dari substrat lain bisa berupa berbagai asam karboksilat atau turunannya yang belum tentu terikat KoA. Ikatan dengan Koenzim A adalah strategi sel untuk mengaktivasi molekul untuk reaksi berikutnya.
Bagaimana cara membedakan persamaan reaksi dekarboksilasi oksidatif dengan dekarboksilasi biasa?
Pada persamaan dekarboksilasi oksidatif, di sisi produk akan terlihat senyawa yang tingkat oksidasinya lebih tinggi (misalnya, dari aldehida menjadi asam) disertai pelepasan CO2. Sementara dekarboksilasi biasa (seperti termal) hanya menghasilkan pelepasan CO2 dan senyawa netral seperti alkana atau alkena tanpa perubahan bilangan oksidasi pada atom karbon yang tersisa.