Persamaan Reaksi Propenaldehida Dioksidasi dengan KMnO4 bukan sekadar rumus di papan tulis, melainkan sebuah pertunjukan kimia yang dramatis di mana warna ungu yang khas perlahan memudar, menandai transformasi molekul yang kompleks. Reaksi ini menghadirkan duel reaktivitas yang menarik dalam satu molekul: gugus aldehida yang lapar akan oksidasi dan ikatan rangkap karbon-karbon yang siap diolah. Dengan agen pengoksidasi kuat Kalium Permanganat (KMnO4), propenaldehida menjalani perubahan struktural mendasar yang hasilnya sangat bergantung pada kondisi lingkungan reaksi.
Secara mendasar, reaksi ini dapat mengarah pada dua jalur utama. Dalam suasana asam, gugus aldehida akan teroksidasi penuh menjadi asam karboksilat, sementara ikatan rangkapnya terputus menghasilkan asam format. Sementara itu, dalam kondisi basa atau netral yang lebih ringan, oksidasi aldehida tetap terjadi, tetapi ikatan rangkap mengalami hidroksilasi membentuk gugus diol. Pemahaman terhadap mekanisme ini membuka jendela untuk aplikasi luas, mulai dari analisis kualitatif senyawa tak jenuh hingga sintesis senyawa organik bernilai.
Pengantar dan Struktur Molekul Propenaldehida
Propenaldehida, yang lebih dikenal dengan nama trivial akrolein, merupakan molekul organik yang menarik karena menyimpan dua pusat reaktivitas dalam satu struktur. Secara visual, bayangkan sebuah rantai tiga atom karbon. Atom karbon pertama terikat pada sebuah atom hidrogen dan membentuk ikatan rangkap dengan oksigen—inilah gugus fungsi aldehida (-CHO). Yang membuatnya spesial, antara atom karbon kedua dan ketiga terdapat sebuah ikatan rangkap dua (C=C), menjadikannya aldehida tak jenuh paling sederhana.
Keberadaan kedua gugus fungsional ini menciptakan dinamika reaksi yang kompleks. Gugus aldehida sangat rentan terhadap oksidasi karena atom karbon karbonilnya berada pada keadaan oksidasi yang relatif tinggi dan mudah diubah menjadi yang lebih tinggi lagi. Sementara itu, ikatan rangkap C=C, meskipun juga reaktif, cenderung menjalani reaksi adisi. Ketika bertemu dengan agen pengoksidasi kuat seperti kalium permanganat (KMnO4), kedua situs ini akan “bersaing” untuk bereaksi, dan hasil akhirnya sangat bergantung pada kondisi lingkungan reaksi.
Peran KMnO4 sebagai Agen Pengoksidasi Multifungsi
Kalium permanganat bukanlah reagen yang kaku. Sifat pengoksidasinya berubah secara dramatis tergantung pada apakah ia berada dalam lingkungan asam, basa, atau netral. Dalam suasana asam, KMnO4 termanifestasi sebagai oksidator yang sangat kuat dan non-selektif, mampu mengoksidasi hampir semua gugus fungsi organik, termasuk memutus ikatan rangkap karbon-karbon. Ion MnO4- akan direduksi menjadi ion Mn2+ yang berwarna merah muda pucat atau tak berwarna.
Dalam kondisi basa atau netral, kekuatannya lebih moderat. Di sini, ia sering bertindak sebagai agen untuk hidroksilasi ikatan rangkap (menghasilkan diol) sambil juga dapat mengoksidasi aldehida, dan produk reduksinya adalah MnO2 yang berwarna coklat dan mengendap.
Mekanisme Reaksi Oksidasi dengan KMnO4
Memahami mekanisme reaksi ini ibarat mengurai benang kusut dari dua proses yang bisa berjalan beriringan atau berurutan. Intinya, KMnO4 menyerang dua titik lemah pada propenaldehida: ujung aldehida dan jantung ikatan rangkapnya. Jalur mana yang dominan ditentukan oleh suhu dan pH medium reaksi.
Oksidasi Gugus Aldehida menjadi Karboksilat
Mekanisme oksidasi aldehida oleh KMnO4, terutama dalam suasana basa, melibatkan pembentukan intermediat hidrat. Atom hidrogen alfa pada gugus aldehida (yang terikat pada karbon karbonil) bersifat agak asam. Dalam lingkungan basa, dapat terjadi deprotonasi, memicu serangan nukleofilik oleh air atau ion hidroksida pada karbon karbonil, membentuk spesies hidrat (gem-diol). Spesies ini kemudian dengan mudah mentransfer hidrida ke permanganat, mengubah gugus -CHO menjadi anion karboksilat (-COO-).
Dalam suasana asam, prosesnya lebih langsung dan energetik, seringkali melalui transfer elektron langkah-demi-langkah yang kompleks.
Hidroksilasi Ikatan Rangkap Karbon-Karbon
Terhadap ikatan rangkap, KMnO4 bertindak sebagai sumber gugus hidroksil. Mekanisme klasiknya adalah melalui pembentukan kompleks siklik antara permanganat dan ikatan rangkap, membentuk intermediat ester manganat. Intermediat yang tidak stabil ini kemudian terhidrolisis dalam larutan, memutus ikatan rangkap dan menambahkan dua gugus hidroksil (-OH) pada masing-masing atom karbon yang sebelumnya terikat rangkap, menghasilkan senyawa diol (glikol). Reaksi ini stereospesifik sin, menghasilkan produk diol dengan konfigurasi tertentu.
Pengaruh Kondisi Reaksi terhadap Produk Akhir
Kondisi reaksi berperan sebagai sutradara yang menentukan produk akhir. Pada suhu rendah (0-10°C) dan suasana basa/netral yang encer, reaksi dapat dihentikan pada tahap pembentukan diol, dengan gugus aldehida mungkin juga teroksidasi. Namun, dalam kondisi yang lebih keras—seperti suasana asam, konsentrasi tinggi, atau pemanasan—KMnO4 akan mengoksidasi kedua bagian molekul secara agresif. Ikatan rangkap yang telah menjadi diol akan terus dioksidasi lebih lanjut, mengalami pemutusan ikatan C-C, sehingga akhirnya menghasilkan produk-produk asam karboksilat atau keton yang lebih sederhana.
Oksidasi propenaldehida dengan KMnO4 dalam suasana asam menghasilkan asam propanoat dan CO2, sebuah transformasi kimia yang presisi. Layaknya membutuhkan notasi yang tepat dalam seni, para pemula sering mencari panduan, misalnya untuk memainkan melodi klasik seperti Tolong Beri Nomor Lagu Fur Elise untuk Pianika. Keduanya menekankan pentingnya ketepatan “bahasa”, baik notasi musik maupun persamaan kimia, di mana reaksi propenaldehida tadi menjadi contoh nyata penerapan aturan stoikiometri yang ketat.
Persamaan Reaksi Kimia dan Produk yang Dihasilkan
Untuk memprediksi hasil akhir dari pertemuan antara propenaldehida dan KMnO4, kita harus menuliskan persamaan reaksi setara yang memperhitungkan kondisi reaksi. Persamaan-persamaan ini bukan hanya simbol belaka, melainkan peta jalan stoikiometri yang menunjukkan transformasi mendasar dari reaktan menjadi produk.
Oksidasi dalam Suasana Asam
Dalam lingkungan asam, KMnO4 yang kuat akan mengoksidasi propenaldehida secara total. Gugus aldehida teroksidasi menjadi gugus karboksil, dan ikatan rangkap C=C diputus sepenuhnya, menghasilkan dua molekul asam karboksilat. Persamaan reaksi setaranya adalah:
5 CH2=CH-CHO + 6 KMnO4 + 9 H2SO4 → 5 CH3COOH + 5 CO2 + 6 MnSO4 + 3 K2SO4 + 14 H2O
Perhatikan bahwa produk akhirnya adalah asam asetat (dari dua karbon pertama) dan karbon dioksida (dari karbon aldehida), disertai reduksi Mn(VII) menjadi Mn(II).
Oksidasi dalam Suasana Basa atau Netral
Pada kondisi yang lebih ringan ini, produk yang dihasilkan berbeda. Gugus aldehida teroksidasi menjadi gugus karboksilat (berbentuk garam kalium dalam basa), sementara ikatan rangkap mengalami hidroksilasi menjadi gugus diol. Persamaan untuk suasana basa encer dingin dapat direpresentasikan sebagai:
3 CH2=CH-CHO + 2 KMnO4 + H2O → 3 CH2(OH)-CH(OH)-COOK + 2 MnO2 + KOH
Produk utamanya adalah garam kalium dari asam 2,3-dihidroksipropanoat (asam gliserat), dengan endapan coklat MnO2.
Perbandingan Hasil Reaksi Berdasarkan Suasana
| Suasana Reaksi | Reaktan Utama | Produk Utama | Perubahan Warna KMnO4 |
|---|---|---|---|
| Asam (H2SO4, panas) | Propenaldehida, KMnO4, H2SO4 | Asam Asetat + CO2 | Ungu → Tak Berwarna (Mn2+) |
| Basa/Netral (dingin, encer) | Propenaldehida, KMnO4, H2O | Garam Asam 2,3-Dihidroksipropanoat (Diol) | Ungu → Coklat (Endapan MnO2) |
Aplikasi dan Contoh Reaksi Serupa
Reaksi oksidasi aldehida tak jenuh dengan KMnO4 bukan hanya sekadar eksperimen laboratorium. Prinsip ini memiliki gema dalam berbagai aplikasi analitis dan sintesis, menunjukkan keuniversalan pola reaksi kimia.
Contoh senyawa serupa yang menjalani reaksi analog adalah sinamaldehida (penyusun utama kayu manis) dan krotonaldehida. Sinamaldehida, dengan struktur cincin aromatik dan rantai samping -CH=CH-CHO, akan memberikan produk yang kompleks tergantung kondisi, mulai dari diol hingga asam benzoat. Reaksi ini menjadi dasar dari beberapa uji kualitatif klasik.
Aplikasi dalam Analisis dan Sintesis Kimia Organik
- Uji Kualitatif Ketidakjenuhan (Uji Baeyer): Penggunaan KMnO4 encer dalam suasana netral/basa dingin untuk menguji adanya ikatan rangkap karbon-karbon. Hilangnya warna ungu dan terbentuknya endapan coklat MnO2 merupakan indikasi positif.
- Sintesis Asam Karboksilat dan Diol: Reaksi ini menyediakan rute untuk mengonversi aldehida tak jenuh menjadi asam karboksilat (dalam asam) atau menjadi α-hidroksi asam (dalam basa). Asam 2,3-dihidroksipropanoat (asam gliserat) dari oksidasi basa propenaldehida adalah bahan bangunan senyawa biokimia penting.
- Degradasi Oksidatif untuk Elusidasi Struktur: Sebelum spektroskopi modern, pemutusan ikatan rangkap dengan KMnO4 digunakan untuk memecah molekul kompleks yang tidak diketahui menjadi fragmen yang lebih kecil dan mudah diidentifikasi, membantu menentukan struktur aslinya.
Data Observasi dan Penjelasan Visual
Reaksi ini adalah tontonan visual yang jelas, di mana perubahan warna dan fisik menjadi penanda proses kimia yang sedang berlangsung. Observasi ini memberikan bukti langsung tentang jalannya reaksi dan sifat produk yang dihasilkan.
Oksidasi propenaldehida dengan KMnO4 menghasilkan asam propanoat, sebuah reaksi penting dalam kimia organik. Prinsip stoikiometri serupa juga krusial dalam perhitungan sifat unsur, misalnya saat menentukan Massa Atom Relatif Unsur X dari 4,48 L X₂ pada STP yang melibatkan hubungan volume gas dan massa molekul. Pemahaman mendalam tentang kedua konsep ini, termasuk mekanisme oksidasi aldehida, sangat esensial untuk menganalisis transformasi kimia secara kuantitatif dan kualitatif.
Perubahan Warna dan Pembentukan Endapan
Saat tetesan larutan KMnO4 ungu pekat ditambahkan ke dalam propenaldehida, warna ungu tersebut akan memudar. Dalam suasana asam, warna ungu akan hilang sama sekali tanpa membentuk endapan, meninggalkan larutan yang jernih atau sedikit keruh, menandakan reduksi menjadi ion Mn2+ yang tak berwarna. Sebaliknya, dalam suasana basa atau netral, warna ungu memudar disertai dengan terbentuknya endapan berwarna coklat gelap seperti lumpur, yaitu mangan dioksida (MnO2).
Sifat Fisik Produk dan Ilustrasi Deskriptif Transformasi
Produk yang dihasilkan memiliki sifat fisik yang berbeda. Dalam suasana asam, produk akhir berupa asam asetat yang berbau tajam dan karbon dioksida yang berupa gas. Dalam suasana basa, produknya adalah garam organik yang larut dalam air dan endapan MnO2 padat. Secara visual, transformasi molekulnya dapat digambarkan: molekul propenaldehida lurus dengan ujung gugus CHO dan jantung ikatan rangkap. Serangan KMnO4 pertama-tama mengubah ujung CHO menjadi gugus COOH (atau COO-).
Secara simultan, ikatan rangkap C=C yang seperti pegas terkompresi, dibuka dan dua atom oksigen dari KMnO4 terikat, mengubah segmen -CH=CH- menjadi -CH(OH)-CH(OH)-. Pada kondisi keras, segmen diol ini kemudian terbelah, memutus rantai karbon sepenuhnya.
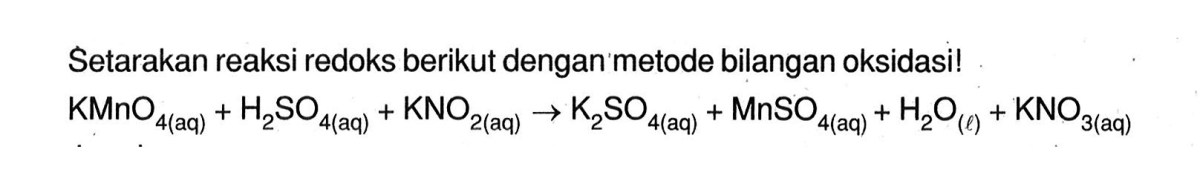
Faktor-Faktor yang Mempengaruhi Reaksi: Persamaan Reaksi Propenaldehida Dioksidasi Dengan KMnO4
Seperti kebanyakan reaksi kimia, hasil dan kecepatan oksidasi propenaldehida oleh KMnO4 tidak mutlak. Beberapa variabel eksperimental dapat dimanipulasi untuk mengarahkan reaksi ke produk yang diinginkan atau untuk mengamati fenomena yang berbeda.
Pengaruh Konsentrasi dan Suhu, Persamaan Reaksi Propenaldehida Dioksidasi dengan KMnO4
Source: amazonaws.com
Konsentrasi KMnO4 yang tinggi dan suhu reaksi yang dinaikkan akan mempercepat semua langkah reaksi, termasuk langkah-langkah oksidasi lanjutan yang merusak. Hal ini mendorong reaksi menuju produk oksidasi total (seperti asam asetat dan CO2). Sebaliknya, penggunaan KMnO4 encer pada suhu rendah (dengan penangas es) membantu “membekukan” reaksi pada tahap intermediat, seperti pembentukan diol, memberikan lebih banyak kendali dan selektivitas.
Prosedur Percobaan Laboratorium Sederhana
Untuk mendemonstrasikan reaksi ini dengan aman dan efektif di tingkat laboratorium pendidikan, dapat diikuti prosedur inti berikut:
Langkah 1: Siapkan dua tabung reaksi. Tabung A diisi dengan 2 mL propenaldehida dan 5 mL asam sulfat encer (1M). Tabung B diisi dengan 2 mL propenaldehida dan 5 mL larutan natrium karbonat 1M (suasana basa lemah).
Langkah 2: Dinginkan kedua tabung dalam penangas es selama beberapa menit.
Langkah 3: Dengan hati-hati dan tetes demi tetes, tambahkan larutan KMnO4 0,1 M ke dalam masing-masing tabung sambil dikocok perlahan. Amati hingga terjadi perubahan warna yang permanen pada setiap tetesan sebelum menambahkan tetesan berikutnya.
Langkah 4: Catat perbedaan kecepatan hilangnya warna ungu dan ada/tidaknya pembentukan endapan coklat di kedua tabung. Hentikan penambahan ketika warna ungu tidak lagi hilang (menandakan KMnO4 berlebih).
Oksidasi propenaldehida dengan KMnO4, yang menghasilkan asam propanoat, adalah contoh klasik reaksi aldehida menjadi asam karboksilat. Prinsip perubahan kimia ini juga terlihat dalam proses biologis, misalnya pada analisis Telur dan feses pada herbivora: hasilnya yang mengungkap transformasi materi dalam sistem pencernaan. Dengan demikian, baik di lab maupun di alam, pemahaman mendalam tentang mekanisme reaksi oksidasi tetap menjadi kunci utama dalam menginterpretasikan berbagai perubahan zat.
Analisis Bahaya dan Penanganan Limbah
Propenaldehida (akrolein) sangat mudah menguap, berbau tajam, dan bersifat iritan serta lachrymator (membuat mata berair). KMnO4 pekat adalah oksidator kuat dan dapat bereaksi hebat dengan bahan organik. Percobaan harus dilakukan dalam lemari asam atau ruang berventilasi sangat baik dengan menggunakan alat pelindung diri lengkap. Limbah reaksi, terutama yang mengandung ion mangan (baik Mn2+ atau MnO2), tidak boleh dibuang langsung ke saluran pembuangan.
Limbah harus dikumpulkan dalam wadah khusus untuk logam berat, dinetralkan sesuai protokol, dan ditangani oleh layanan pengelolaan limbah kimia berbahaya yang berwenang.
Ringkasan Penutup
Dari uraian di atas, terlihat jelas bahwa oksidasi propenaldehida oleh KMnO4 adalah contoh sempurna bagaimana kimia organik memanfaatkan reaktivitas spesifik untuk mencapai transformasi yang ditargetkan. Reaksi ini lebih dari sekadar perubahan warna dari ungu menjadi cokelat atau tak berwarna; ia adalah cerita tentang pemutusan dan pembentukan ikatan yang dikendalikan dengan presisi oleh pH dan suhu. Pengetahuan tentang persamaan reaksi dan mekanisme di baliknya menjadi fondasi penting, tidak hanya bagi eksperimen laboratorium tetapi juga untuk merancang sintesis senyawa yang lebih kompleks di industri farmasi atau material.
Dengan demikian, menguasai reaksi fundamental seperti ini berarti membekali diri dengan kunci untuk membuka banyak pintu dalam eksplorasi kimia yang lebih lanjut.
FAQ Terpadu
Apakah reaksi ini bisa digunakan sebagai uji kualitatif untuk propenaldehida?
Ya, reaksi dengan KMnO4 dapat menjadi uji pendukung. Penghilangan warna ungu KMnO4 menunjukkan adanya gugus yang dapat dioksidasi (seperti aldehida) atau ikatan rangkap. Namun, uji ini tidak spesifik hanya untuk propenaldehida karena banyak senyawa lain (seperti alkena atau aldehida lain) juga memberikan hasil positif. Diperlukan uji lebih lanjut seperti uji Tollens atau spektroskopi untuk konfirmasi spesifik.
Mengapa dalam suasana asam produknya adalah asam format dan bukan diol?
Dalam kondisi asam yang kuat, KMnO4 tereduksi menjadi Mn2+. Kondisi ini sangat energetik dan menyebabkan pemutusan oksidatif pada ikatan rangkap karbon-karbon. Ikatan rangkap tersebut tidak hanya dihidroksilasi, tetapi terputus sepenuhnya, mengubah gugus CH=CH- menjadi dua gugus karbonil, yang salah satunya adalah asam format (HCOOH).
Bagaimana cara membedakan hasil reaksi oksidasi suasana asam dan basa hanya dari pengamatan visual?
Perbedaan utama terletak pada endapan yang terbentuk. Dalam suasana asam, larutan akan berubah dari ungu menjadi tak berwarna (atau sangat pucat) tanpa endapan cokelat yang menetap, karena ion Mn2+ yang dihasilkan larut. Dalam suasana basa atau netral, warna ungu akan memudar menjadi hijau kemudian diikuti pembentukan endapan cokelat MnO2 yang keruh.
Apakah ada alternatif pengoksidasi selain KMnO4 untuk reaksi ini?
Tentu. Oksidator lain seperti asam kromat (reagen Jones) dapat mengoksidasi gugus aldehida dengan baik, tetapi mungkin kurang spesifik terhadap ikatan rangkap dalam satu langkah. Ozonolisis (O3) diikuti reduksi/oksidasi adalah alternatif kuat untuk memutus ikatan rangkap secara spesifik. Pemilihan oksidator bergantung pada produk yang diinginkan dan kondisi reaksi yang diizinkan.

