Presentase massa unsur O dalam 3 mol H₂CO₃ bukan sekadar angka acak, melainkan pintu masuk untuk memahami bahasa rahasia materi yang diungkap oleh stoikiometri. Dalam dunia kimia, setiap molekul menyimpan cerita komposisi yang bisa dihitung dengan presisi, membuka wawasan dari skala mikroskopis hingga aplikasi praktis di laboratorium. Asam karbonat (H₂CO₃), senyawa yang akrab dalam minuman berkarbonasi dan proses biologis, menjadi contoh sempurna untuk mengulik hubungan erat antara mol, massa molar, dan persentase komposisi unsur.
Perhitungan ini dimulai dari massa atom relatif (Ar) setiap penyusunnya: Hidrogen (H=1), Karbon (C=12), dan Oksigen (O=16). Dengan merakit nilai-nilai tersebut, massa molar H₂CO₃ dapat ditentukan sebagai 62 gram/mol. Dari sini, kontribusi massa dari tiga atom oksigen dalam satu molekulnya pun mulai terkuak, menjadi fondasi untuk menghitung berapa besar porsi massa yang disumbangkan unsur O dalam sampel yang lebih besar, yaitu tiga mol senyawa tersebut.
Konsep Dasar Stoikiometri dan Komposisi Senyawa: Presentase Massa Unsur O Dalam 3 mol H₂CO₃
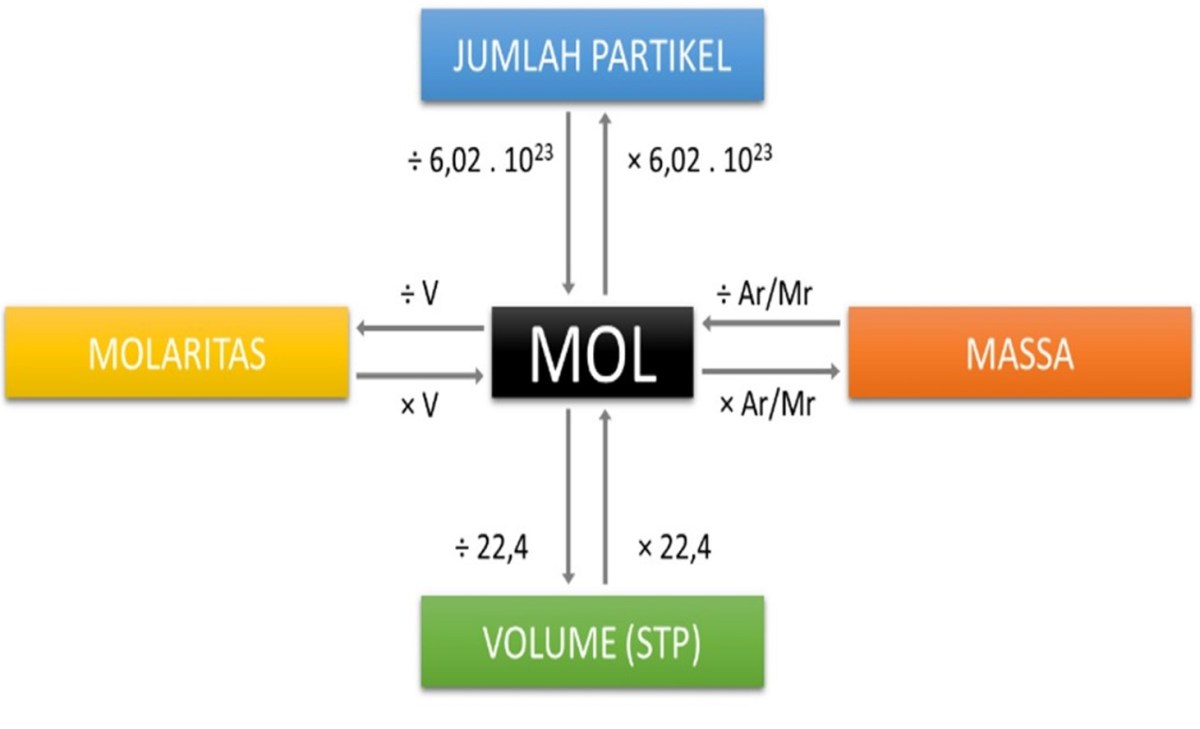
Memahami komposisi suatu senyawa, seperti asam karbonat (H₂CO₃), adalah fondasi dalam kimia. Konsep mol berperan sebagai jembatan yang menghubungkan dunia mikroskopis atom dengan dunia makroskopis yang bisa kita ukur. Satu mol bukan sekadar angka besar, melainkan sejumlah partikel (atom, molekul) yang setara dengan 12 gram atom Karbon-12, yaitu sekitar 6.022 x 10²³ partikel. Dalam konteks H₂CO₃, 1 mol berarti terdapat 6.022 x 10²³ molekul asam karbonat.
Untuk beralih dari jumlah partikel ke massa, kita memerlukan massa molar. Massa molar suatu senyawa adalah massa dari satu mol senyawa tersebut, yang secara numerik sama dengan massa molekul relatif (Mr) tetapi dinyatakan dalam satuan gram per mol (g/mol). Penentuannya dimulai dari massa atom relatif (Ar) setiap unsur penyusunnya. Untuk H₂CO₃, nilai Ar yang digunakan adalah: Hidrogen (H) = 1,008, Karbon (C) = 12,011, dan Oksigen (O) = 16,00.
Nilai-nilai ini merupakan rata-rata tertimbang dari isotop-isotop alami setiap unsur.
Langkah Penentuan Massa Molar H₂CO₃
Source: ac.id
Perhitungan massa molar H₂CO₃ dilakukan dengan menjumlahkan kontribusi massa dari semua atom dalam satu molekul. Proses ini sistematis dan dapat diterapkan pada senyawa apa pun. Pertama, identifikasi jumlah atom setiap unsur. Kemudian, kalikan jumlah atom tersebut dengan Ar-nya. Terakhir, jumlahkan semua hasil perkalian untuk mendapatkan Mr, yang sekaligus menjadi nilai massa molar dalam g/mol.
- Unsur Hidrogen (H): Terdapat 2 atom. Kontribusi massa = 2 × 1,008 = 2,016 g/mol.
- Unsur Karbon (C): Terdapat 1 atom. Kontribusi massa = 1 × 12,011 = 12,011 g/mol.
- Unsur Oksigen (O): Terdapat 3 atom. Kontribusi massa = 3 × 16,00 = 48,00 g/mol.
Dengan demikian, massa molar (Mr) H₂CO₃ = 2,016 + 12,011 + 48,00 = 62,027 g/mol. Artinya, satu mol H₂CO₃ memiliki massa sekitar 62,03 gram.
Perhitungan Massa Unsur dalam Senyawa
Setelah mengetahui massa molar senyawa, kita dapat mengurai berapa gram kontribusi setiap unsur dalam satu mol senyawa. Ini adalah langkah kunci sebelum menghitung persentase komposisi. Untuk oksigen dalam H₂CO₃, perhitungannya langsung: karena ada 3 atom O dan setiap atomnya menyumbang 16,00 g/mol, maka massa total oksigen per mol H₂CO₃ adalah 48,00 gram.
Menghitung presentase massa oksigen dalam 3 mol H₂CO₃ adalah aplikasi langsung dari konsep stoikiometri, yang memerlukan ketelitian layaknya saat Menentukan Persamaan Bidang, Titik Tegak Lurus, dan Proyeksi Garis dalam geometri analitik. Keduanya sama-sama mengandalkan logika struktur dan hubungan antar komponen. Pada akhirnya, setelah memahami prinsip dasar itu, perhitungan persentase unsur O menjadi lebih sistematis dan akurat.
Data komposisi lengkap dari satu mol H₂CO₃ dapat disajikan secara jelas dalam sebuah tabel. Tabel ini memberikan gambaran holistik tentang distribusi massa di antara ketiga unsur penyusunnya.
| Unsur | Jumlah Atom | Ar (g/mol) | Massa per Mol H₂CO₃ (g) |
|---|---|---|---|
| Hidrogen (H) | 2 | 1.008 | 2.016 |
| Karbon (C) | 1 | 12.011 | 12.011 |
| Oksigen (O) | 3 | 16.000 | 48.000 |
| Total (Mr) | H₂CO₃ | 62.027 | |
Massa Oksigen dalam Sampel Tiga Mol
Dalam praktiknya, kita sering kali bekerja dengan sampel yang jumlah molnya lebih dari satu. Prinsipnya tetap sederhana: jika satu mol H₂CO₃ mengandung 48,00 gram oksigen, maka massa oksigen dalam sampel berapa pun molnya adalah kelipatannya. Untuk sampel sebanyak 3 mol H₂CO₃, massa oksigen yang terkandung di dalamnya dihitung dengan mengalikan massa oksigen per mol dengan jumlah mol sampel.
Jadi, massa O dalam 3 mol H₂CO₃ = 3 mol × 48,00 g/mol = 144,00 gram. Pendekatan ini efisien karena kita tidak perlu menghitung ulang massa molar total sampel terlebih dahulu untuk mencari massa oksigennya.
Penentuan Persentase Komposisi Unsur
Persentase komposisi adalah representasi proporsi massa suatu unsur terhadap total massa senyawa, dinyatakan dalam persen. Konsep ini sangat berguna untuk identifikasi senyawa, analisis kemurnian, dan perhitungan stoikiometri lebih lanjut. Rumus umumnya bersifat universal dan mudah diingat.
Persentase massa suatu unsur = (Jumlah atom unsur × Ar unsur / Mr senyawa) × 100%
Menerapkan rumus ini untuk unsur oksigen dalam H₂CO₃, kita masukkan data yang sudah diperoleh dari perhitungan sebelumnya. Langkah-langkah kuncinya dapat dirangkum dalam sebuah blok kutipan yang menunjukkan alur berpikir dari data mentah hingga hasil akhir.
Langkah Perhitungan % Massa O dalam H₂CO₃:
1. Tentukan massa kontribusi O
3 atom × 16,00 g/mol = 48,00 g/mol.
2. Tentukan Mr H₂CO₃
(2×1,008) + (1×12,011) + (3×16,00) = 62,027 g/mol.
3. Hitung persentase
Menghitung presentase massa unsur O dalam 3 mol H₂CO₃ memerlukan ketelitian numerik yang mirip dengan pendekatan sistematis dalam Matematika Wajib Kelas 11: Program Linier. Seperti menyelesaikan fungsi objektif, kita perlu mengolah data massa atom dan jumlah mol dengan presisi untuk mendapatkan hasil akhir yang akurat, yakni persentase oksigen dalam senyawa tersebut.
(48,00 g/mol / 62,027 g/mol) × 100%.
4. Hasil
≈ 77,38%.
Dengan demikian, sekitar 77,38% dari massa setiap sampel murni asam karbonat berasal dari unsur oksigen. Nilai ini adalah sifat tetap dari senyawa H₂CO₃.
Aplikasi pada Sampel Multi-Mol
Mari kita terapkan konsep pada sampel spesifik, yaitu 3 mol H₂CO₃. Perhitungan ini menggabungkan pemahaman tentang mol, massa molar, dan persentase komposisi. Pertama, kita hitung massa total sampel 3 mol tersebut. Selanjutnya, kita hitung massa oksigen yang terkandung di dalamnya, yang sebenarnya sudah kita lakukan di bagian sebelumnya. Terakhir, kita verifikasi bahwa persentase massa oksigen yang dihitung dari sampel 3 mol ini akan sama dengan persentase dalam 1 mol.
Massa total 3 mol H₂CO₃ = 3 mol × 62,027 g/mol = 186,081 gram. Massa oksigen di dalamnya, seperti telah dihitung, adalah 144,00 gram. Jika kita hitung ulang persentasenya: (144,00 g / 186,081 g) × 100% = 77,38%. Hasilnya identik.
Perbandingan Massa Oksigen pada Variasi Jumlah Mol, Presentase massa unsur O dalam 3 mol H₂CO₃
- Dalam 1 mol H₂CO₃: Massa O = 48,00 g. Persentase massa O = 77,38%.
- Dalam 3 mol H₂CO₃: Massa O = 144,00 g. Persentase massa O = 77,38%.
- Dalam n mol H₂CO₃: Massa O = n × 48,00 g. Persentase massa O tetap 77,38%.
Perbandingan ini dengan jelas menunjukkan bahwa sementara massa absolut unsur berubah seiring jumlah sampel, proporsi atau persentase massanya adalah konstan.
Visualisasi dan Interpretasi Data
Bayangkan tiga molekul H₂CO₃ yang terpisah. Setiap molekulnya seperti segitiga dengan atom karbon di pusat, dikelilingi oleh tiga atom oksigen dan dua atom hidrogen terikat pada dua dari atom oksigen tersebut. Dalam kumpulan tiga molekul ini, total terdapat sembilan atom oksigen (3 molekul × 3 atom O). Meskipun atom hidrogen dan karbon juga hadir, kumpulan sembilan bola yang mewakili atom oksigen ini akan terlihat jauh lebih dominan dalam hal ruang yang ditempati, mencerminkan kontribusi massanya yang besar yaitu sekitar 77% dari total massa ketiga molekul tersebut.
Perhitungan presentase massa unsur O dalam 3 mol H₂CO₃ mengungkap presisi numerik yang khas, serupa dengan dialektika dalam menilai suatu era. Refleksi kritis terhadap Kelebihan dan Kekurangan Penerapan Pancasila pada Orde Lama menunjukkan bahwa setiap konstruksi, layaknya rumus kimia, memiliki proporsi ideal dan deviasi dalam praktiknya. Analisis mendalam ini akhirnya mengantarkan kita kembali pada esensi kuantitatif: menentukan komposisi oksigen dalam senyawa tersebut memerlukan ketelitian metodologis yang sama.
Hubungan antara jumlah mol, massa total senyawa, dan massa oksigen dapat disajikan dalam tabel untuk memberikan gambaran yang lebih komprehensif dan memudahkan prediksi untuk jumlah mol lainnya.
| Jumlah Mol H₂CO₃ | Massa Total (g) | Massa Oksigen (g) | % Massa O (Tetap) |
|---|---|---|---|
| 1 | 62.03 | 48.00 | 77.38% |
| 3 | 186.09 | 144.00 | 77.38% |
| n | n × 62.03 | n × 48.00 | 77.38% |
Sifat Intensif Persentase Komposisi
Ketika kita mengatakan persentase massa oksigen dalam H₂CO₃ adalah 77,38%, nilai ini tidak peduli apakah kita memegang setetes larutan encer atau sebuah tangki penuh. Inilah yang disebut sifat intensif. Sifat intensif tidak bergantung pada ukuran atau jumlah sampel. Sebaliknya, massa total 144 gram adalah sifat ekstensif karena bergantung pada fakta bahwa kita mengambil 3 mol. Persentase komposisi adalah sidik jari kuantitatif suatu senyawa murni; nilainya yang tetap memungkinkan kita membedakan, misalnya, air (H₂O) yang mengandung ~89% oksigen dengan hidrogen peroksida (H₂O₂) yang mengandung ~94% oksigen, terlepas dari volume sampel yang dianalisis.
Ringkasan Penutup
Dari analisis mendalam ini, terlihat jelas bahwa persentase massa oksigen dalam H₂CO₃ adalah sifat intensif yang tetap, yakni sekitar 77.42%, terlepas dari apakah kita membahas 1 mol, 3 mol, atau bahkan sejumlah n mol. Nilai konstan ini menjadi penanda identitas senyawa, serupa sidik jari komposisinya. Dengan demikian, menguasai perhitungan stoikiometri seperti ini bukan hanya tentang menjawab soal, tetapi lebih tentang membekali diri dengan logika dasar yang menjelaskan komposisi segala materi di sekitar kita, membentuk pondasi kuat untuk eksplorasi kimia yang lebih luas.
FAQ Terkini
Apakah hasil persentase massa O akan sama jika dihitung untuk 5 mol H₂CO₃?
Ya, persis sama. Persentase komposisi adalah sifat intensif, sehingga tidak bergantung pada jumlah sampel. Baik untuk 1 mol, 3 mol, atau 5 mol, persentase massa unsur Oksigen akan tetap sekitar 77.42%.
Mengapa kita perlu menghitung massa molar senyawa terlebih dahulu?
Massa molar (gram/mol) adalah jembatan krusial antara dunia mikroskopis (jumlah partikel/mol) dan dunia makroskopis (massa yang dapat ditimbang). Tanpa nilai ini, kita tidak dapat mengkonversi jumlah mol sampel menjadi massa total, yang esensial untuk menghitung massa unsur spesifik di dalamnya.
Bagaimana jika yang ditanyakan adalah massa unsur Hidrogen dalam 3 mol H₂CO₃?
Langkahnya serupa. Pertama, hitung massa total Hidrogen per mol H₂CO₃ (2 atom H x Ar 1 = 2 g/mol). Kemudian, kalikan dengan 3 mol untuk mendapatkan massa total H (6 gram). Atau, hitung persentase massa H terlebih dahulu (sekitar 3.23%), lalu terapkan pada massa total 3 mol H₂CO₃ (186 gram).
Apakah metode ini hanya berlaku untuk H₂CO₃?
Tidak, prinsip dan metode perhitungan ini berlaku universal untuk semua senyawa kimia, dari yang sederhana seperti air (H₂O) hingga senyawa organik kompleks. Rumus dasarnya tetap: (jumlah atom unsur x Ar unsur) / massa molar senyawa x 100%.