Rumus Kimia H2O itu bukan sekadar deretan huruf dan angka di buku pelajaran, tapi kode rahasia di balik molekul paling krusial di alam semesta kita. Bayangkan, cuma dari dua atom hidrogen yang setia mengapit satu atom oksigen, terciptalah suatu zat yang jadi panggung utama bagi seluruh drama kehidupan. Dari embun pagi di daun sampai aliran darah dalam tubuh, semuanya berkat struktur sederhana nan jenius ini.
Rumus kimia H2O, yang kita kenal sebagai air, itu ibarat fondasi kehidupan. Nah, dari sumber kehidupan ini, banyak banget peluang ekonomi yang bisa kita gali, lho. Coba intip ide-ide segar tentang Contoh Kegiatan Ekonomi yang Berpotensi Dapat Dimajukan untuk melihat bagaimana air bisa menjadi modal utama. Jadi, jangan cuma hafal rumusnya, tapi lihatlah H2O sebagai titik awal untuk membangun sesuatu yang lebih bernilai dan berkelanjutan.
Ikatan yang terbentuk bukan cuma soal kimia biasa, melainkan sebuah kolaborasi sempurna yang menghasilkan sifat-sifat luar biasa.
Molekul air dengan bentuk bengkoknya itu ternyata menyimpan kekuatan besar. Polaritasnya membuatnya jadi pelarut ulung, sang “universal solvent” yang mampu melarutkan lebih banyak zat daripada pelarut lain. Anomali densitasnya, di mana es justru mengapung di air, adalah keajaiban yang melindungi ekosistem perairan. Setiap tetesnya membawa cerita tentang kohesi dan adhesi, tentang bagaimana mereka saling menarik sesama molekul air dan juga merangkul permukaan lain, memungkinkan fenomena menakjubkan seperti tegangan permukaan dan naiknya air di batang tanaman.
Pengertian Dasar dan Struktur Molekul
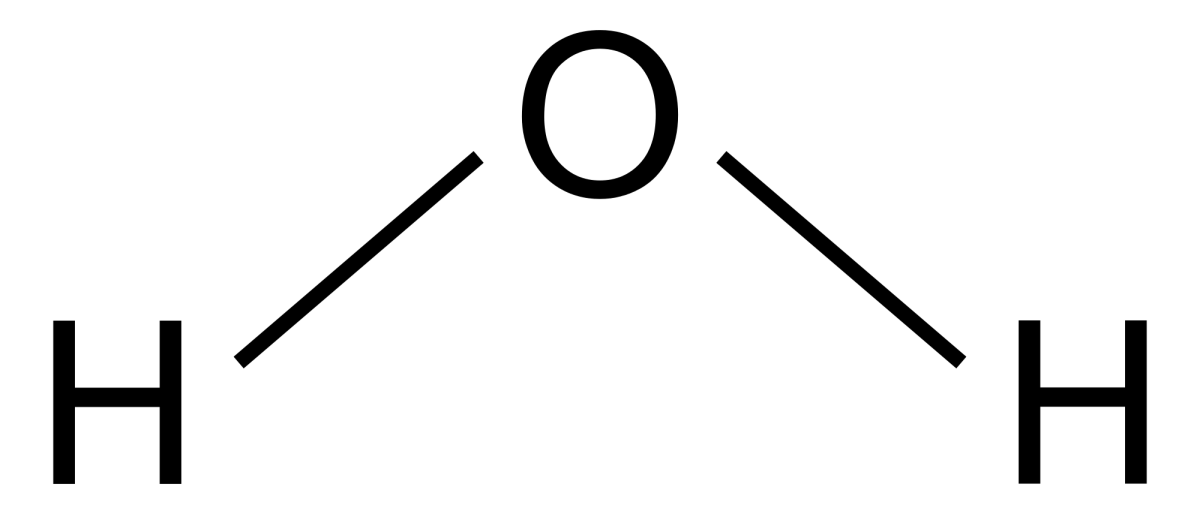
Mari kita mulai dari yang paling mendasar. Ketika mendengar “H2O”, hampir semua orang langsung teringat air. Tapi apa sebenarnya yang tersembunyi di balik susunan huruf dan angka yang sederhana itu? Rumus kimia H2O adalah sebuah cerita singkat yang sangat powerful. Ia memberitahu kita bahwa satu molekul air tersusun dari dua atom Hidrogen (H) dan satu atom Oksigen (O).
Simbol H mewakili unsur Hidrogen, unsur paling ringan dan paling melimpah di alam semesta. Sementara O adalah simbol untuk Oksigen, unsur yang sangat reaktif dan vital bagi kehidupan.
Cerita menjadi menarik ketika kedua jenis atom ini bertemu. Atom Oksigen dan Hidrogen tidak sekadar berdampingan; mereka berikatan. Ikatan yang terbentuk adalah ikatan kovalen, di mana mereka saling berbagi pasangan elektron. Namun, pembagiannya tidak adil. Oksigen lebih “rakus” menarik elektron, membuat molekul air menjadi polar.
Sisi atom oksigen sedikit bermuatan negatif, sementara sisi atom-atom hidrogen sedikit bermuatan positif. Ketimpangan inilah yang nantinya menjadi kunci dari segala keunikan air.
Perbandingan Atom dan Molekul Penyusun Air
Untuk memahami molekul air, kita perlu mengenal karakter individu dari para penyusunnya. Tabel berikut membandingkan sifat dasar atom Hidrogen, Oksigen, dan hasil pernikahan keduanya, yaitu molekul Air (H2O).
| Unsur/Molekul | Nomor Atom | Massa Atom (u) | Elektron Valensi | Keadaan Standar |
|---|---|---|---|---|
| Hidrogen (H) | 1 | ~1.008 | 1 | Gas (H₂) |
| Oksigen (O) | 8 | ~16.00 | 6 | Gas (O₂) |
| Air (H₂O) | – | ~18.015 | – | Cair |
Bentuk Geometri dan Pengaruhnya
Jika kita bisa melihat sebuah molekul air, bentuknya tidak lurus seperti H-O-H. Karena adanya pasangan elektron bebas pada atom oksigen, bentuk molekulnya menyerupai huruf “V” atau seperti Mickey Mouse, dengan sudut ikatan sekitar 104.5 derajat. Bentuk bengkok ini, ditambah dengan sifat kepolarannya, menciptakan sebuah molekul yang memiliki kutub positif dan negatif. Konsekuensinya luar biasa: molekul air saling tarik-menarik satu sama lain seperti magnet kecil.
Gaya tarik antar molekul air ini disebut ikatan hidrogen, yang menjadi dalang di balik titik didih air yang tinggi, tegangan permukaan, dan kemampuannya yang luar biasa sebagai pelarut.
Rumus H2O bersifat tetap karena menggambarkan perbandingan atom yang spesifik dan stabil dalam satu molekul air. Perubahan pada rumus ini, misalnya menjadi H2O2, akan menghasilkan senyawa yang sama sekali berbeda—hidrogen peroksida, yang bersifat racun dan digunakan sebagai pemutih. Kestabilan ikatan kovalen antara H dan O dalam konfigurasi 2:1 ini adalah hasil dari pencapaian konfigurasi elektron yang stabil (seperti gas mulia) oleh masing-masing atom, sehingga mereka “enggan” untuk berpisah atau mengubah komposisi tanpa adanya reaksi kimia yang kuat.
Sifat Fisik dan Kimia Air
Setelah mengenal struktur molekulnya, wajar jika kita bertanya: bagaimana bentuk mikroskopis itu memanifestasikan diri dalam sifat-sifat yang kita lihat dan rasakan sehari-hari? Jawabannya terletak pada kombinasi unik antara rumus H2O dan ikatan hidrogen yang dihasilkannya. Sifat-sifat air seringkali menjadi pengecualian dari aturan umum, membuatnya menjadi zat yang benar-benar spesial di antara sesama senyawa.
H2O, rumus kimia sederhana yang menjaga kehidupan kita, ternyata filosofinya bisa diterapkan di mana saja. Bayangkan, seperti air yang mengalir dan menghidupi, begitu pula dengan dinamika Kegiatan Ekonomi Potensial di Kawasan Pekan Senai, Johor Bahru yang membutuhkan aliran modal dan ide segar untuk tumbuh subur. Pada akhirnya, prinsip dasar H2O tentang keberlangsungan dan adaptasi itu sendiri adalah kunci untuk membaca potensi ekonomi di mana pun, termasuk di Senai.
Sifat fisik utama air, seperti titik didih 100°C dan titik leleh 0°C pada tekanan 1 atm, sebenarnya sangat tinggi untuk molekul dengan massa hanya 18 g/mol. Bandingkan dengan hidrogen sulfida (H2S) yang massanya lebih besar, tapi titik didihnya hanya -60°C. Penyimpangan ini murni berkat ikatan hidrogen yang kuat, yang membutuhkan energi lebih besar untuk diputuskan agar air bisa menguap. Demikian pula dengan densitasnya; kebanyakan zat memadat ketika didinginkan, tapi air mencapai densitas maksimum pada 4°C.
Di bawah suhu ini, air justru mengembang karena molekulnya mulai membentuk struktur kristal es yang lebih renggang.
Fenomena Anomali Densitas Air
Source: nowiknow.com
Anomali densitas air adalah salah satu keajaiban yang memiliki konsekuensi langsung bagi kehidupan di Bumi. Berikut adalah poin-poin kunci fenomena ini dan kaitannya dengan struktur H2O:
- Air dalam bentuk cair paling padat pada suhu 4°C, bukan pada titik bekunya (0°C).
- Saat mendingin dari 4°C ke 0°C, air justru mengembang. Hal ini disebabkan molekul H2O mulai mengatur diri dalam struktur heksagonal yang longgar, yang menjadi cikal bakal es.
- Struktur es yang renggang ini membuat es memiliki densitas yang lebih rendah daripada air cair, sehingga es mengapung.
- Fenomena mengapungnya es ini bersifat vital karena membentuk lapisan insulasi di permukaan danau atau laut, melindungi kehidupan di bawahnya dari pembekuan total.
Kohesi, Adhesi, dan Peran Polaritas
Sifat polar molekul H2O melahirkan dua konsep penting: kohesi dan adhesi. Kohesi adalah gaya tarik-menarik antar molekul air sendiri (disebabkan oleh ikatan hidrogen), yang memunculkan tegangan permukaan. Itulah sebabnya serangga tertentu bisa berjalan di atas air, atau tetesan air cenderung membentuk bulatan. Adhesi adalah gaya tarik antara molekul air dengan molekul zat lain. Kombinasi kohesi dan adhesi inilah yang mendorong fenomena kapilaritas, di mana air dapat naik melalui celah semisal pembuluh xilem pada tanaman atau kertas tisue.
Perbandingan Air dengan Senyawa Serupa
Untuk menempatkan keunikan air dalam konteks yang lebih luas, mari bandingkan dengan beberapa senyawa yang memiliki rumus atau struktur mirip. Perbandingan ini menunjukkan betapa istimewanya H2O.
| Senyawa | Berat Molekul (g/mol) | Titik Didih (°C) | Kepolaran | Kekuatan Ikatan Hidrogen |
|---|---|---|---|---|
| Air (H₂O) | 18.02 | 100.0 | Tinggi | Sangat Kuat |
| Hidrogen Sulfida (H₂S) | 34.08 | -60.3 | Rendah | Lemah (hampir tidak ada) |
| Amonia (NH₃) | 17.03 | -33.3 | Tinggi | Kuat |
Peran dan Fungsi dalam Sistem Biologi
Air bukan sekadar pelengkap dalam tubuh makhluk hidup; ia adalah panggung utama di mana seluruh drama kehidupan berlangsung. Dari sel yang paling sederhana hingga organ tubuh yang paling kompleks, molekul H2O terlibat dalam hampir setiap proses. Pemahaman tentang struktur dan sifat kimianya memberikan penjelasan mengapa air menjadi medium yang sempurna bagi kehidupan.
Dalam sel, air berfungsi sebagai pelarut utama yang melarutkan ion, gula, asam amino, dan berbagai molekul penting lainnya, menciptakan lingkungan ideal untuk reaksi biokimia terjadi. Sifat kapasitas kalornya yang tinggi menjadikan air sebagai penyangga suhu yang efektif, membantu organisme mempertahankan suhu tubuh yang stabil meski lingkungan berfluktuasi. Selain itu, sifat kohesi dan adhesi air memungkinkan transportasi nutrisi dan zat sisa melalui pembuluh darah pada hewan atau pembuluh xilem dan floem pada tanaman.
Proses Hidrolisis dan Kaitannya dengan Air
Hidrolisis adalah contoh klasik bagaimana molekul H2O aktif berpartisipasi dalam reaksi kimia tubuh, bukan hanya sebagai pelarut pasif. Dalam reaksi ini, sebuah molekul air (H-OH) digunakan untuk memutus suatu ikatan kimia yang lebih besar. Misalnya, saat tubuh mencerna pati atau protein, molekul air disisipkan ke dalam ikatan antara unit-unit penyusunnya (glukosa pada pati atau asam amino pada protein), sehingga memecahnya menjadi molekul yang lebih kecil dan dapat diserap. Secara harfiah, H2O menjadi bahan pemotongnya. Reaksi kebalikannya, yaitu dehidrasi sintesis, justru melepaskan molekul H2O saat menyusun molekul besar.
Peran Air dalam Reaksi Biokimia Kunci, Rumus Kimia H2O
Air adalah partisipan sekaligus produk dalam dua reaksi paling fundamental di Bumi:
- Fotosintesis: Di sini, air berperan sebagai reaktan. Molekul H2O dipecah untuk menyumbangkan elektron dan ion hidrogen dalam proses mengubah karbon dioksida dan air menjadi glukosa dan oksigen. Oksigen yang kita hirup berasal dari pemecahan molekul air ini.
- Respirasi Seluler: Dalam proses kebalikan fotosintesis, air justru muncul sebagai produk. Ketika glukosa dioksidasi untuk menghasilkan energi, salah satu hasil akhirnya adalah molekul air. Air yang dihasilkan ini disebut air metabolik.
Konsep Hidrasi Shell dan Interaksi dengan Ion
Ketika garam seperti natrium klorida (NaCl) larut dalam air, ion Na+ dan Cl- terpisah dan masing-masing dikelilingi oleh molekul air. Fenomena ini disebut pembentukan kulit hidrasi (hydration shell). Berikut bagaimana molekul H2O yang polar berinteraksi:
- Ujung negatif (atom O) dari molekul air akan mengarah dan mengelilingi ion positif (Na+).
- Ujung positif (atom H) dari molekul air akan mengarah dan mengelilingi ion negatif (Cl-).
- “Selimut” air ini menstabilkan ion-ion dalam larutan, mencegah mereka bergabung kembali, dan memungkinkan ion-ion tersebut bergerak bebas untuk menghantarkan listrik atau berpartisipasi dalam reaksi biokimia di dalam tubuh.
Keberadaan dan Siklus Air di Alam
Rumus H2O adalah paspor molekul air untuk berkelana di seluruh penjuru Bumi, dari kedalaman lautan hingga ke puncak atmosfer. Molekul yang sama yang ada di dalam gelas minuman kita mungkin pernah mengalir di sungai purba atau membentuk awan di atas benua lain. Keberadaannya dalam tiga wujud—cair, padat (es), dan gas (uap air)—serta kemampuannya untuk berubah dari satu fase ke fase lain, adalah inti dari siklus hidrologi yang menghidrasi planet kita.
Perubahan wujud ini sepenuhnya adalah kisah tentang energi dan gerakan molekul H2O. Ketika mendapat energi panas (misalnya dari matahari), gerakan molekul air meningkat. Jika energi cukup untuk melepaskan ikatan hidrogen antar molekul, air menguap menjadi gas. Sebaliknya, ketika kehilangan energi (misalnya di ketinggian atmosfer yang dingin), molekul uap air melambat dan ikatan hidrogen mulai menjebak mereka kembali menjadi cair (embun) atau langsung menjadi padat (kristal es pada awan).
Yang luar biasa, melalui semua transformasi dramatik ini, rumus kimianya, H2O, tetap tak berubah. Hanya jarak dan pengaturan antar molekulnya saja yang berubah.
Tahapan Siklus Hidrologi dan Peran Molekul H2O
Siklus air adalah perjalanan tanpa akhir molekul H2O. Tabel berikut merinci tahapan utamanya.
| Tahap Siklus | Deskripsi Proses | Peran Molekul H2O | Perubahan Energi |
|---|---|---|---|
| Evaporasi | Perubahan air dari wujud cair di permukaan (laut, danau, sungai) menjadi uap air di atmosfer. | Molekul H2O individu mendapatkan energi cukup untuk lepas dari massa air. | Menyerap energi panas (latent heat of vaporization). |
| Kondensasi | Uap air di atmosfer mendingin dan berubah kembali menjadi titik-titik air cair membentuk awan atau embun. | Molekul H2O kehilangan energi kinetik, mendekat, dan ikatan hidrogen kembali terbentuk. | Melepaskan energi panas ke lingkungan. |
| Presipitasi | Butiran air atau es di awan menjadi terlalu berat sehingga jatuh ke bumi sebagai hujan, salju, atau hujan es. | Molekul H2O berkumpul dalam jumlah besar (koalesensi) hingga gravitasi mengatasi gaya yang menahannya di awan. | Energi potensial di ketinggian diubah menjadi energi kinetik saat jatuh. |
| Infiltrasi | Air yang sampai ke permukaan tanah meresap ke dalam tanah, mengisi celah batuan dan akuifer. | Molekul H2O bergerak melalui pori-pori tanah karena gaya adhesi, kohesi, dan gravitasi. | Energi potensial berkurang saat bergerak ke daerah yang lebih rendah. |
Stabilitas Rumus H2O dalam Siklus Alam
Yang menakjubkan dari seluruh perjalanan ini adalah stabilitas molekul air itu sendiri. Proses evaporasi, kondensasi, pembekuan, dan pencairan semuanya adalah perubahan fisika. Ikatan kovalen antara atom Hidrogen dan Oksigen dalam satu molekul H2O tidak putus. Yang berubah hanyalah ikatan hidrogen antar molekul, yang jauh lebih lemah. Artinya, molekul air yang menguap dari laut memiliki identitas kimia yang persis sama ketika ia jatuh sebagai hujan ratusan kilometer jauhnya.
Stabilitas inilah yang membuat siklus air menjadi sistem daur ulang yang sempurna dan abadi untuk molekul yang paling penting bagi kehidupan.
Aplikasi dan Pemanfaatan dalam Kehidupan Sehari-hari
Pengetahuan tentang rumus H2O dan sifat-sifatnya bukan cuma teori di buku pelajaran. Ia adalah prinsip yang bekerja diam-diam di balik banyak teknologi dan aktivitas harian kita. Dari cara kita memasak, membersihkan, hingga merancang bangunan dan mesin, pemahaman tentang air memberi kita kendali untuk memanfaatkannya dengan lebih cerdas.
Prinsip pelarutan, misalnya, langsung terlihat saat kita membuat kopi atau garam larut dalam sup. Sifat polar molekul air membuatnya mampu menarik dan mengelilingi molekul atau ion dari zat lain yang juga polar atau bermuatan, memecahnya menjadi bagian-bagian kecil yang tersebar merata. Inilah mengapa air disebut pelarut universal. Sifat ini dimanfaatkan dalam pembersihan, farmasi (pembuatan sirup), dan industri kimia.
Aplikasi Sifat Kapilaritas
Sifat kapilaritas air, yang lahir dari kombinasi adhesi dan kohesi, memiliki aplikasi praktis yang luas. Dalam bidang pertanian, sistem irigasi tetes memanfaatkan prinsip kapilaritas tanah untuk mendistribusikan air secara perlahan dan efisien ke zona perakaran tanaman. Dalam teknik sipil, fenomena naiknya air tanah melalui pori-pori beton atau dinding bata (disebut rembesan kapiler) menjadi pertimbangan penting dalam desain fondasi dan sistem waterproofing untuk mencegah kelembaban yang merusak.
Pemanfaatan Kalor Jenis yang Tinggi
Kapasitas panas air yang sangat tinggi—artinya butuh banyak energi untuk menaikkan suhunya—menjadikannya fluida pendingin yang ideal. Berikut beberapa penerapannya:
- Sistem Pendingin Mesin Kendaraan: Air (biasanya dicampur antibeku) bersirkulasi di sekitar blok mesin yang panas, menyerap panas berlebih, dan membuangnya melalui radiator sebelum didinginkan dan dikirim kembali.
- Regulator Iklim Alami: Daerah dekat laut besar cenderung memiliki iklim lebih stabil karena air laut menyerap panas di siang hari dan melepaskannya perlahan di malam hari, memoderasi suhu ekstrem.
- Terapi Panas/Dingin: Botol air panas atau kompres es efektif karena air dapat menyimpan atau menyerap panas dalam jumlah besar sebelum suhunya berubah signifikan.
Peran Air dalam Reaksi Kimia Sehari-hari
Air seringkali menjadi aktor dalam reaksi kimia sederhana di sekitar kita. Dalam pemadaman api, air bekerja dengan tiga cara: mendinginkan bahan bakar di bawah titik nyalanya, membentuk lapisan uap yang menghalangi oksigen, dan untuk kebakaran tertentu, memisahkan atau mengencerkan bahan bakar. Saat kita membuat larutan oralit untuk mengatasi dehidrasi, air berperan sebagai pelarut untuk garam (NaCl) dan gula (glukosa), menciptakan larutan isotonik yang dapat diserap tubuh dengan cepat.
Pentingnya Pemahaman H2O dalam Pengolahan Air Bersih
Memahami bahwa air murni adalah H2O, tetapi air alam selalu mengandung zat terlarut dan tersuspensi, adalah dasar dari pengolahan air bersih. Proses seperti koagulasi-flokulasi, sedimentasi, filtrasi, dan desinfeksi (misal dengan klorin) dirancang untuk menghilangkan kontaminan fisik, kimia, dan biologis untuk mendekatkan air pada kemurnian H2O yang aman dikonsumsi. Standar kualitas air minum (seperti TDS/Merekah, pH, dan bebas patogen) pada dasarnya adalah parameter untuk memastikan bahwa apa yang kita minum mendekati sifat-sifat ideal dari molekul H2O tanpa membawa ancaman bagi kesehatan.
Pemungkas
Jadi, melihat lebih dalam pada Rumus Kimia H2O itu seperti membuka peti harta karun sains. Dari struktur molekulnya yang sederhana, kita menemukan penjelasan untuk hal-hal biasa yang luar biasa: kenapa keringat bisa mendinginkan tubuh, bagaimana nutrisi bisa tersebar dalam sel, dan mengapa planet kita biru dan basah. Pemahaman ini bukan cuma untuk dihafal, tapi untuk diapresiasi sebagai fondasi dari segala sesuatu yang hidup.
Air adalah bukti bahwa hal-hal paling mendasar seringkali adalah yang paling powerful. Maka, lain kali meneguk segelas air, ingatlah bahwa yang kita minum adalah sebuah formula ajaib, karya masterpiece alam yang tak tergantikan.
Panduan FAQ: Rumus Kimia H2O
Apakah rumus H2O bisa berubah menjadi HO atau H3O dalam kondisi tertentu?
Tidak, rumus H2O bersifat tetap sebagai representasi molekul air netral. H3O+ adalah ion hidronium yang terbentuk ketika air bertindak sebagai asam (menerima proton), tetapi ini adalah spesies kimia yang berbeda, bukan perubahan dari molekul H2O itu sendiri. HO biasanya merujuk pada radikal hidroksil yang sangat reaktif, bukan bentuk stabil air.
Mengapa air laut asin padahal rumus kimianya sama H2O?
Rasa asin berasal dari zat terlarut, terutama garam natrium klorida (NaCl), yang larut ke dalam air. Sifat air sebagai pelarut universal, akibat polaritas molekul H2O, memungkinkan garam-garam dari batuan di daratan terbawa oleh aliran sungai dan terakumulasi di lautan selama miliaran tahun. H2O-nya tetap murni, tetapi tercampur dengan berbagai ion.
Benarkah air memiliki memori seperti yang diklaim di terapi alternatif?
Tidak ada bukti ilmiah yang valid dan dapat direproduksi yang mendukung klaim bahwa air memiliki “memori” yang dapat menyimpan informasi dari zat terlarut yang sudah diencerkan hingga hilang. Sifat fisik dan kimia air ditentukan oleh struktur molekul H2O dan interaksinya dengan zat terlarut saat ini, bukan oleh sejarah kontaknya di masa lalu.
Apakah ada senyawa lain yang mirip dengan H2O di alam semesta?
Secara struktural, ada senyawa analog seperti hidrogen sulfida (H2S) dan amonia (NH3) yang juga terdiri dari atom pusat golongan VI atau V dengan atom hidrogen. Namun, karena perbedaan elektronegativitas dan ukuran atom, sifat mereka sangat berbeda. Air (H2O) unik karena memiliki ikatan hidrogen yang sangat kuat, menyebabkan titik didih dan kalor jenis yang jauh lebih tinggi dibandingkan senyawa serupa.
Bagaimana cara membedakan air murni (H2O) dengan air yang sudah tercampur zat lain hanya dari rumus kimianya?
Rumus kimia H2O hanya mendeskripsikan komposisi molekul air itu sendiri. Ia tidak memberikan informasi tentang kemurnian suatu sampel air. Untuk mengetahui kemurnian, diperlukan analisis fisikokimia seperti mengukur konduktivitas listrik, residu penguapan, atau uji kualitatif terhadap ion-ion pengotor. Air murni hanya mengandung molekul H2O, sedangkan air mineral atau air ledeng mengandung ion terlarut seperti kalsium, magnesium, dan bikarbonat.


