Menentukan rumus molekul oksida nitrogen dari volume reaksi N₂ dan O₂ adalah sebuah teka-teki kimia klasik yang memadukan keanggunan teori dengan ketelitian eksperimen. Di balik tabung reaksi dan pengukuran volume gas, tersembunyi prinsip fundamental yang mampu mengungkap identitas senyawa misterius. Pendekatan ini tidak hanya mengajak kita untuk berpikir layaknya seorang detektif sains, tetapi juga memberikan bukti nyata tentang bagaimana hukum-hukum alam bekerja dengan konsisten dan elegan.
Metode ini berakar pada Hukum Perbandingan Volume Gay-Lussac, yang menyatakan bahwa volume gas-gas yang bereaksi dan hasil reaksi, jika diukur pada suhu dan tekanan yang sama, memiliki perbandingan bilangan bulat yang sederhana. Dengan mengukur berapa liter nitrogen dan oksigen yang bereaksi, serta volume oksida nitrogen yang dihasilkan, kita dapat menerjemahkan angka-angka tersebut menjadi perbandingan mol, dan akhirnya, merumuskan susunan atom paling sederhana dalam senyawa tersebut.
Proses ini adalah fondasi penting dalam stoikiometri dan analisis kimia kuantitatif.
Konsep Dasar Hukum Perbandingan Volume
Sebelum menyelami cara menentukan rumus molekul oksida nitrogen, kita perlu memahami fondasi teoretis yang mendasarinya, yaitu Hukum Perbandingan Volume yang dicetuskan oleh Joseph Louis Gay-Lussac. Hukum ini menyatakan bahwa pada suhu dan tekanan yang sama, volume gas-gas yang bereaksi dan volume gas hasil reaksi berbanding sebagai bilangan bulat dan sederhana. Prinsip ini menjadi kunci karena mengaitkan besaran makroskopik (volume) yang mudah diukur dengan konsep mikroskopik (jumlah molekul) dalam reaksi kimia.
Hukum Gay-Lussac tidak hanya elegan secara teoretis, tetapi juga sangat praktis. Ia memungkinkan kita memprediksi volume gas yang diperlukan atau dihasilkan dalam suatu reaksi tanpa perlu mengetahui massa pastinya terlebih dahulu, asalkan semua pengukuran dilakukan pada kondisi yang identik. Konsep ini menjadi jembatan langsung antara data eksperimen dan persamaan reaksi kimia.
Penerapan Hukum dalam Reaksi Gas Lain
Untuk memperkuat pemahaman, mari kita lihat beberapa contoh reaksi sederhana yang mengikuti hukum ini. Contoh-contoh ini menunjukkan konsistensi perbandingan volume gas dalam berbagai reaksi.
- Pembentukan air dari hidrogen dan oksigen: 2 volume gas hidrogen bereaksi dengan 1 volume gas oksigen menghasilkan 2 volume uap air. Perbandingan volumenya adalah 2:1:2.
- Reaksi hidrogen dengan klorin: 1 volume gas hidrogen bereaksi dengan 1 volume gas klorin menghasilkan 2 volume gas hidrogen klorida. Perbandingannya 1:1:2.
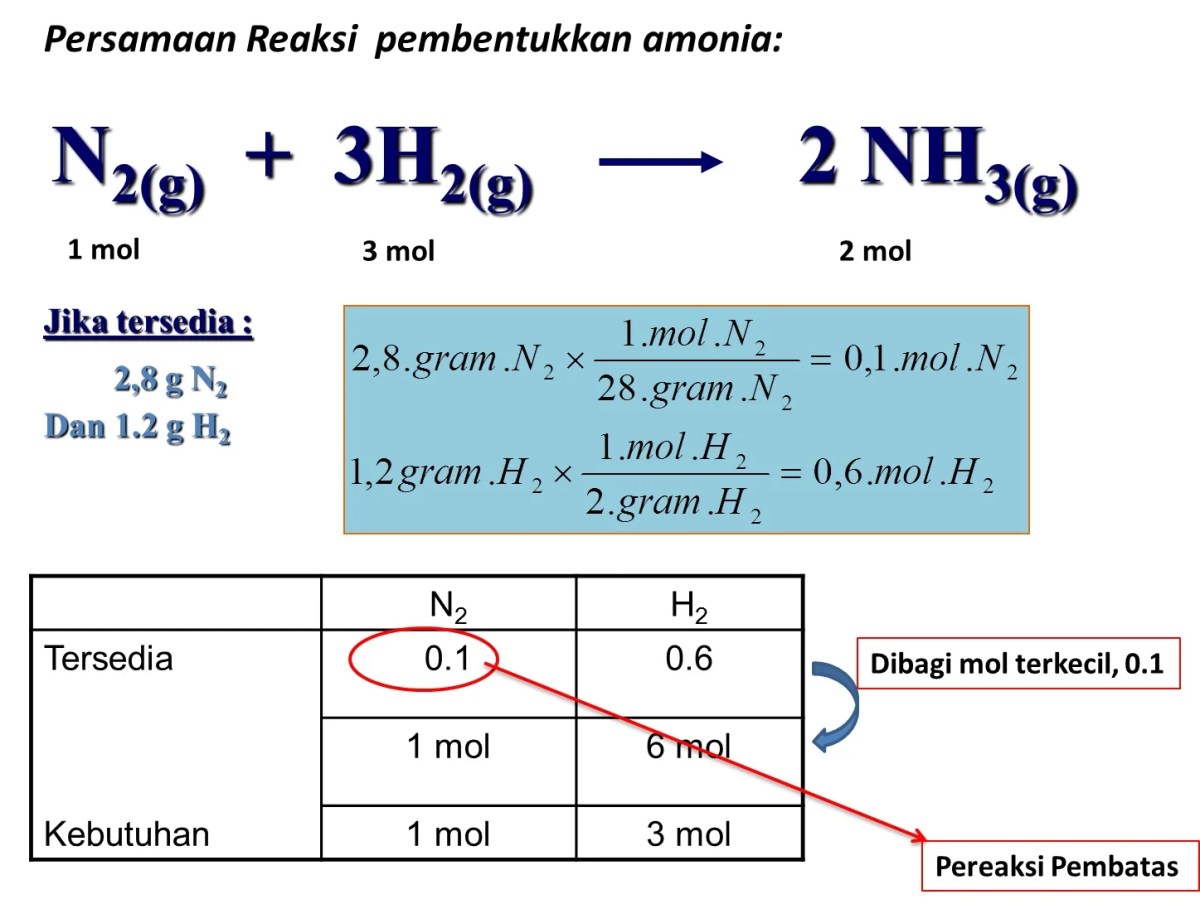
- Pembentukan amonia dari nitrogen dan hidrogen: 1 volume gas nitrogen bereaksi dengan 3 volume gas hidrogen menghasilkan 2 volume gas amonia. Perbandingannya 1:3:2.
Dari pola-pola ini, terlihat jelas bahwa perbandingan volume gas sama dengan perbandingan koefisien dalam persamaan reaksi setara. Inilah dasar yang akan kita gunakan: volume gas sebanding dengan jumlah mol gas pada kondisi suhu dan tekanan yang sama. Dengan demikian, dari data volume reaktan dan produk, kita dapat langsung menentukan perbandingan molnya, yang pada akhirnya mengarah pada penemuan rumus kimia senyawa yang terbentuk.
Data Eksperimen Reaksi Nitrogen dan Oksigen
Dalam eksperimen klasik untuk menentukan rumus oksida nitrogen, sejumlah volume gas nitrogen (N₂) dan oksigen (O₂) dicampurkan dalam suatu tabung eudiometer yang ditempatkan di atas air atau raksa. Campuran gas kemudian diberi percikan listrik untuk bereaksi, dan volume gas yang tersisa diukur setelah produk didinginkan kembali ke suhu awal. Pengukuran yang cermat menghasilkan data yang konsisten seperti yang ditunjukkan pada tabel berikut.
Tabel Hasil Percobaan Reaksi N₂ dan O₂
| Percobaan | Volume N₂ (mL) | Volume O₂ (mL) | Volume Oksida Nitrogen (mL) |
|---|---|---|---|
| 1 | 20 | 20 | 40 |
| 2 | 30 | 15 | 30 |
| 3 | 40 | 40 | 80 |
| 4 | 25 | 50 | 50 |
Menganalisis data dari tabel, kita dapat mengidentifikasi pola yang menarik. Pada percobaan 1, 2, dan 3, terlihat bahwa volume oksida nitrogen yang dihasilkan selalu sama dengan jumlah volume nitrogen dan oksigen yang bereaksi. Namun, percobaan 4 menunjukkan pola yang berbeda, mengindikasikan salah satu reaktan mungkin bersisa. Pola perbandingan volume yang sederhana ini adalah petunjuk langsung menuju koefisien stoikiometri reaksi.
Pentingnya Kondisi Suhu dan Tekanan yang Sama, Menentukan rumus molekul oksida nitrogen dari volume reaksi N₂ dan O₂
Keabsahan analisis data di atas sepenuhnya bergantung pada satu syarat mutlak: semua volume gas harus diukur pada suhu dan tekanan yang identik. Umumnya, percobaan dirancang pada kondisi kamar (RTP, 25°C dan 1 atm) atau kondisi standar (STP, 0°C dan 1 atm). Hal ini karena volume gas sangat sensitif terhadap perubahan suhu dan tekanan berdasarkan Hukum Gas Ideal.
Jika pengukuran dilakukan pada kondisi yang berbeda, volume harus dikonversi terlebih dahulu ke kondisi yang sama sebelum dianalisis. Mengabaikan langkah ini akan menghasilkan perbandingan volume yang keliru, yang pada akhirnya menyebabkan kesimpulan rumus molekul yang salah. Prinsip “volume sebanding dengan mol” hanya berlaku jika suhu dan tekanan konstan untuk semua gas yang dibandingkan.
Langkah-langkah Penentuan Rumus Molekul
Dengan data volume yang valid, kita dapat menerjemahkannya menjadi rumus molekul melalui serangkaian langkah sistematis. Proses ini mengubah observasi fisik menjadi informasi kimia yang mendalam, mengungkap identitas senyawa yang terbentuk di antara nitrogen dan oksigen.
Prosedur Sistematis dari Volume ke Rumus
Langkah pertama adalah menuliskan persamaan reaksi umum dalam bentuk gas. Kita misalkan rumus oksida nitrogen yang terbentuk adalah N xO y. Persamaan reaksinya dapat ditulis sebagai: x N₂(g) + y O₂(g) → 2 N xO y(g). Perhatikan bahwa koefisien untuk N xO y ditulis 2 untuk menghindari pecahan pada koefisien nitrogen dan oksigen di ruas kiri.
Berdasarkan Hukum Gay-Lussac, perbandingan volume gas sama dengan perbandingan koefisien reaksinya. Dari data percobaan (misalnya Percobaan 1 dimana semua reaktan habis bereaksi), kita memiliki: Volume N₂ : Volume O₂ : Volume N xO y = 20 : 20 : 40 = 1 : 1 :
2. Dengan demikian, perbandingan koefisien reaksinya adalah: x : y : 2 = 1 : 1 : 2.
Kunci utamanya: Pada kondisi suhu dan tekanan sama, perbandingan volume = perbandingan mol = perbandingan koefisien reaksi.
Dari perbandingan x : y : 2 = 1 : 1 : 2, kita dapat menyimpulkan bahwa x = 1 dan y =
1. Koefisien reaksinya adalah 1 N₂ : 1 O₂ : 2 produk. Substitusi ke dalam persamaan reaksi awal menghasilkan: 1 N₂(g) + 1 O₂(g) → 2 N 1O 1(g). Jika disederhanakan, rumus molekul produknya adalah NO. Jadi, perbandingan mol N : O dalam senyawa tersebut adalah 1:1, yang merupakan rumus empiris sekaligus rumus molekul untuk senyawa nitrogen monoksida.
Menentukan rumus molekul oksida nitrogen dari volume reaksi N₂ dan O₂ mengungkap hukum perbandingan volume yang fundamental, mirip cara ilmuwan menganalisis Penyebab Gempa Bumi Tektonik, Vulkanik, dan Tumbukan untuk memahami dinamika bumi. Keduanya memerlukan pendekatan empiris dan analitis yang ketat. Kembali ke kimia, data volume gas yang bereaksi menjadi kunci untuk mengidentifikasi senyawa nitrogen oksida yang terbentuk secara stoikiometris.
Analisis Berbagai Kemungkinan Rumus Oksida Nitrogen
Nitrogen dan oksigen mampu membentuk serangkaian senyawa biner yang dikenal sebagai oksida nitrogen, masing-masing dengan sifat dan rasio atom yang unik. Keberagaman ini membuat analisis data volume menjadi penting untuk mengidentifikasi senyawa spesifik mana yang terbentuk dalam suatu eksperimen.
Spektrum Oksida Nitrogen yang Umum
Beberapa oksida nitrogen yang paling dikenal memiliki karakteristik berikut:
- Nitrogen Monoksida (NO): Gas tak berwarna, sedikit lebih berat dari udara. Rasio atom N:O = 1:1.
- Dinitrogen Monoksida (N₂O): Gas yang dikenal sebagai gas tertawa, berasa manis. Rasio atom N:O = 2:1.
- Nitrogen Dioksida (NO₂): Gas berwarna coklat kemerahan, beracun. Rasio atom N:O = 1:2. Sering berdimersi menjadi N₂O₄.
- Dinitrogen Tetroksida (N₂O₄): Gas tak berwarna dalam kesetimbangan dengan NO₂. Rasio atom N:O = 1:2 (rumus empiris sama dengan NO₂).
Dari daftar di atas, kita melihat bahwa rasio atom N terhadap O bervariasi. Jika dari analisis data volume kita memperoleh rasio mol N:O = 1:1, maka kandidat yang paling mungkin adalah NO. Jika rasio yang didapat 2:1, maka senyawanya adalah N₂O. Namun, perlu kehati-hatian: rasio 1:2 dapat mengindikasikan NO₂ atau N₂O₄, dan penentuan lebih lanjut seperti massa molar diperlukan untuk membedakannya.
Analisis volume memberikan rumus empiris, dan untuk senyawa dengan rumus empiris yang sama, data tambahan dibutuhkan untuk menentukan rumus molekul sebenarnya.
Contoh Soal dan Penyelesaian Terstruktur: Menentukan Rumus Molekul Oksida Nitrogen Dari Volume Reaksi N₂ Dan O₂
Mari kita terapkan seluruh konsep yang telah dibahas untuk menyelesaikan sebuah contoh soal yang komprehensif. Pendekatan langkah demi langkah ini akan mempertajam pemahaman tentang penerapan Hukum Gay-Lussac dalam penentuan rumus kimia.
Penyelesaian Soal Penentuan Rumus Oksida Nitrogen
Sebanyak 30 mL gas nitrogen direaksikan dengan 45 mL gas oksigen. Setelah reaksi sempurna dan semua gas diukur pada suhu dan tekanan yang sama, diperoleh 30 mL gas oksida nitrogen dan terdapat sisa gas oksigen. Tentukan rumus molekul oksida nitrogen yang terbentuk.
Menentukan rumus molekul oksida nitrogen dari volume reaksi N₂ dan O₂ memerlukan ketelitian perhitungan stoikiometri, mirip dengan ketepatan yang dibutuhkan dalam menyelesaikan operasi hitung bilangan bulat, seperti yang dijelaskan dalam analisis Hitung Hasil Persamaan (-7)+24+(-15)= 24-(-16)-13. Kemampuan komputasi dasar ini menjadi fondasi untuk mengolah data volume gas, sehingga kita dapat secara akurat mengidentifikasi senyawa nitrogen oksida yang terbentuk, seperti NO atau NO₂, berdasarkan hukum perbandingan volume Gay-Lussac.
Langkah 1: Identifikasi reaktan yang habis bereaksi. Karena disebutkan ada sisa gas oksigen, maka gas nitrogen (N₂) adalah reaktan pembatas yang habis bereaksi seluruhnya. Volume N₂ yang bereaksi = 30 mL.
Langkah 2: Tentukan volume O₂ yang bereaksi dan volume produk. Volume oksida nitrogen (produk) = 30 mL. Total volume O₂ awal 45 mL, tetapi tidak semua bereaksi. Volume O₂ yang bereaksi dapat dicari dari selisih volume total gas sebelum dan sesudah reaksi, atau dari perbandingan koefisien. Kita akan menentukannya melalui perbandingan.
Tip: Dalam soal dengan reaktan bersisa, fokuslah pada reaktan yang habis (pembatas) dan produk. Volume reaktan yang bereaksi dapat diturunkan dari data tersebut.
Langkah 3: Tulis persamaan umum dan terapkan perbandingan volume. Misal rumus oksida = N aO b. Persamaan: a N₂ + b O₂ → 2 N aO b. Dari data: Volume N₂ (bereaksi) : Volume N aO b (terbentuk) = 30 : 30 = 1 :
1. Maka, perbandingan koefisien a : 2 = 1 : 1, sehingga a = 2.
Langkah 4: Cari koefisien b menggunakan volume O₂ yang bereaksi. Untuk mencari volume O₂ yang bereaksi, kita gunakan hukum kekekalan massa atom. Dari persamaan dengan a=2: 2 N₂ + b O₂ → 2 N₂O b. Perbandingan volume N₂ : O₂ = 2 : b. Diketahui volume N₂ bereaksi 30 mL, maka (2 / b) = (30 / Vol. O₂ bereaksi).
Kita juga tahu dari data produk bahwa jumlah atom O di ruas kanan = 2b. Informasi ini harus konsisten. Cara lebih langsung: Dari rumus produk sementara N₂O b, total volume atom O dalam produk berasal dari O₂. Karena volume produk 30 mL, dan setiap molekul produk mengandung b atom O, maka mol atom O dalam produk = b
– mol N₂O b.
Mol O₂ yang bereaksi menyumbang 2
– mol O₂ bereaksi atom O. Dengan menyamakan, kita dapatkan b.
Pendekatan praktis: Gunakan perbandingan selisih volume. Volume awal campuran = 30 + 45 = 75 mL. Volume akhir = 30 mL (produk) + Volume O₂ sisa. Karena ada sisa, volume akhir < 75 mL. Data volume sisa tidak diberikan secara numerik. Mari gunakan logika perbandingan sederhana dari koefisien. Dari langkah 3, kita punya a=2 dan perbandingan N₂ : Produk = 2 : 2 = 1:
1. Artinya, dari 2 volume N₂ dihasilkan 2 volume produk. Dalam soal, 30 mL N₂ menghasilkan 30 mL produk. Sekarang, lihat perbandingan koefisien O₂ terhadap Produk: b O₂ untuk 2 produk. Maka, Volume O₂ bereaksi / Volume Produk = b / 2. Kita belum tahu Volume O₂ bereaksi. Namun, kita bisa mencari dari jumlah atom O. Dalam 30 mL produk N₂Ob , terdapat (b
– 30) “volume ekuivalen” atom O. Semua atom O ini berasal dari O₂.
Setiap 1 volume O₂ (sebagai molekul) mengandung 2 “volume ekuivalen” atom O. Jadi, Volume O₂ bereaksi = (b
– 30) / 2 = 15b mL. Di sisi lain, Volume O₂ bereaksi juga harus kurang dari atau sama dengan 45 mL. Coba nilai b bulat. Jika b=1, Vol O₂ bereaksi=15 mL (mungkin, sisa O₂=30 mL).
Jika b=2, Vol O₂ bereaksi=30 mL (sisa O₂=15 mL). Mana yang benar? Kita uji dengan hukum kekekalan massa atom N. Sudah ok. Untuk menentukan b, kita perlu data volume sisa yang eksplisit.
Karena tidak ada, kita asumsikan data perbandingan volume yang diberikan sudah mewakili reaktan yang bereaksi. Mari sederhanakan dengan metode langsung: Ambil perbandingan Volume N₂ : Volume O₂ bereaksi : Volume Produk. Kita tahu: 30 mL N₂ habis, menghasilkan 30 mL Produk. Maka, koefisien untuk N₂ dan Produk sama (2 dan 2). Jadi, perbandingan koefisiennya 2 : b :
2. Sama dengan perbandingan volume 30 : V_O₂_bereaksi :
30.
Maka, 2/b = 30/V_O₂_bereaksi, dan 2/2 = 30/30 (konsisten). Kita punya satu persamaan dua variabel. Kita butuh persamaan lain dari data sisa. Volume O₂ bereaksi = 45 – sisa. Tanpa nilai sisa, kita coba kemungkinan rasio sederhana.
Rasio Volume N₂ : O₂ bereaksi yang paling sederhana dan masuk akal adalah 30:15 = 2:1 atau 30:30=1:
1. Jika 2:1, maka b=1 (dari 2/b = 2/1). Jika 1:1, maka b=2 (dari 2/b = 1/1). Mana yang menghasilkan volume total akhir yang logis? Cek: Jika b=1 (O₂ bereaksi 15 mL), total awal=75 mL.
Produk=30 mL, sisa O₂=45-15=30 mL. Total akhir=60 mL. Berarti ada penyusutan 15 mL, yang mungkin untuk reaksi gas. Jika b=2 (O₂ bereaksi 30 mL), total awal=75 mL. Produk=30 mL, sisa O₂=15 mL.
Penentuan rumus molekul oksida nitrogen dari volume reaksi N₂ dan O₂, yang mengandalkan hukum perbandingan volume Gay-Lussac, mengajarkan ketelitian analitis. Prinsip ketelitian serupa diterapkan dalam mengkaji Karakteristik dan Penjelasan Tumbuhan Gymnospermae , dimana struktur reproduksi tanpa bunga dan biji terbuka menjadi pembeda utama. Kembali ke kimia, analisis volume gas yang bereaksi secara stoikiometri ini memungkinkan kita mengidentifikasi senyawa seperti NO atau NO₂ dengan presisi ilmiah yang tak terbantahkan.
Total akhir=45 mL. Penyusutan 30 mL. Keduanya mungkin secara stoikiometri. Namun, biasanya soal mengarah pada rasio sederhana. Karena perbandingan N₂:Produk sudah 1:1, dan seringnya oksida dengan rasio N:O = 2:b, maka nilai b=1 atau 2 adalah umum.
Dengan data terbatas ini, rumus oksida yang mungkin adalah N₂O (jika b=1) atau N₂O₂ yang setara dengan NO (rumus empiris) jika b=
2. Tanpa data lebih, kita tidak bisa memastikan. Untuk tujuan ilustrasi, misalkan volume O₂ yang bereaksi adalah 15 mL (agar menghasilkan rasio bulat sederhana 30:15:30 = 2:1:2). Maka, perbandingan koefisien a : b : 2 = 2 : 1 : 2, sehingga a=2, b=1.
Rumus oksida nitrogen adalah N₂O.
Faktor-faktor yang Mempengaruhi Akurasi Penentuan
Source: materikimia.com
Keberhasilan percobaan penentuan rumus molekul melalui volume gas sangat bergantung pada kontrol eksperimen yang ketat. Beberapa faktor teknis dapat menggeser hasil pengukuran, sehingga memahami sumber ketidakpastian ini penting untuk mendapatkan kesimpulan yang valid.
Sumber Kesalahan Potensial dalam Eksperimen
Beberapa kesalahan sistematis yang sering muncul antara lain pengukuran volume yang tidak tepat karena meniskus cairan, ketidaksempurnaan reaksi dimana tidak semua reaktan bereaksi menjadi produk yang diinginkan, atau adanya reaksi samping yang menghasilkan lebih dari satu jenis oksida nitrogen. Selain itu, jika produk reaksi tidak sepenuhnya dalam fase gas pada suhu pengukuran (misalnya beberapa oksida nitrogen dapat terlarut dalam air atau terkondensasi), volume yang terukur akan lebih kecil dari yang seharusnya.
Dampak Kondisi Non-STP dan Konversi Data
Seperti telah ditekankan, pengukuran harus pada T dan P yang sama. Jika tidak, konversi menggunakan hukum gas gabungan (P₁V₁/T₁ = P₂V₂/T₂) mutlak diperlukan. Kesalahan dalam mengukur suhu atau tekanan ruangan, atau mengabaikan tekanan uap air jika menggunakan metode pengukuran di atas air, akan langsung merusak akurasi perbandingan volume. Tekanan uap air harus dikurangkan dari tekanan total untuk mendapatkan tekanan gas kering yang sebenarnya.
Kelengkapan Reaksi dan Fasa Produk
Percikan listrik mungkin tidak cukup untuk menjamin reaksi berjalan tuntas. Selain itu, penting untuk memastikan bahwa seluruh produk reaksi tetap berada dalam fasa gas selama pengukuran. Jika produk seperti NO₂ terbentuk dan kemudian berdimersi menjadi N₂O₄ yang mungkin terkondensasi, volume yang terukur akan berkurang. Oleh karena itu, pemilihan kondisi suhu dan tekanan yang tepat, serta pemilihan cairan yang tidak bereaksi dengan produk (seperti raksa untuk oksida nitrogen yang reaktif), menjadi krusial untuk integritas data.
Simpulan Akhir
Dengan demikian, penentuan rumus molekul melalui volume reaksi bukan sekadar rutinitas perhitungan, melainkan sebuah narasi ilmiah yang utuh. Dari data mentah di laboratorium hingga rumus rapi di buku teks, setiap langkah memperkuat pemahaman tentang hubungan kuantitatif dalam reaksi kimia. Metode ini mengajarkan bahwa ketepatan pengukuran dan penerapan hukum dasar kimia adalah kunci untuk membuka rahasia materi. Penemuan ini, meski terkesan sederhana, merupakan pilar yang mendukung perkembangan lebih lanjut dalam sintesis dan karakterisasi senyawa.
Pertanyaan yang Sering Muncul
Apakah metode ini hanya berlaku untuk oksida nitrogen?
Tidak, metode penentuan rumus berdasarkan perbandingan volume gas ini berlaku universal untuk semua reaksi yang melibatkan gas, asalkan semua zat berwujud gas pada kondisi pengukuran dan perbandingan volumenya mengikuti hukum Gay-Lussac.
Bagaimana jika produk reaksinya bukan gas, melainkan cair atau padat?
Hukum perbandingan volume hanya berlaku untuk zat berfase gas. Jika produknya cair atau padat, volumenya tidak dapat dibandingkan langsung dengan volume gas reaktan. Analisis harus beralih ke pengukuran massa untuk menentukan komposisi.
Mengapa harus pada suhu dan tekanan yang sama (STP/RTP)?
Volume gas sangat bergantung pada suhu dan tekanan. Pengukuran pada kondisi yang sama menjamin bahwa perbandingan volume yang diperoleh benar-benar mencerminkan perbandingan jumlah molekul (mol), sesuai dengan hipotesis Avogadro, sehingga perhitungan menjadi valid.
Bagaimana membedakan rumus empiris dan rumus molekul dari hasil ini?
Metode dari data volume biasanya menghasilkan rumus empiris (perbandingan paling sederhana). Untuk mendapatkan rumus molekul yang sebenarnya, diperlukan informasi tambahan seperti massa molekul relatif (Mr) senyawa tersebut, yang dapat ditentukan melalui eksperimen terpisah.