Rumus Senyawa: Kalium Sulfida, Karbon Tetraklorida, Magnesium Iodida, Kalsium Fluorida bukan sekadar kumpulan huruf dan angka di buku kimia. Di balik simbol-simbol itu tersembunyi cerita tentang ikatan yang menyatukan atom, sifat yang membedakannya, dan peran tak tergantikan dalam keseharian kita, mulai dari industri hingga kesehatan. Memahami keempat senyawa ini adalah kunci untuk membuka wawasan tentang bagaimana dunia material tersusun dan berperilaku.
Setiap senyawa mewakili karakter yang unik. Kalium sulfida dan kalsium fluorida adalah contoh klasik senyawa ionik yang kuat, sementara karbon tetraklorida menunjukkan karakter kovalen yang khas. Magnesium iodida berada di tengah-tengah, menampilkan sifat yang menarik. Perbedaan mendasar dalam ikatan kimia inilah yang kemudian menentukan segalanya, mulai dari titik leleh yang tinggi hingga reaktivitas dengan air, membentuk sebuah narasi ilmiah yang menarik untuk diikuti.
Pengertian dan Konsep Dasar Penamaan Senyawa
Memahami cara memberi nama dan menulis rumus senyawa kimia adalah keterampilan dasar dalam kimia. Sistem penamaan yang sistematis memungkinkan ilmuwan di seluruh dunia untuk mengidentifikasi senyawa yang sama tanpa kebingungan. Prinsip dasarnya bergantung pada jenis ikatan yang menyatukan atom-atom tersebut, apakah itu ikatan ionik atau kovalen.
Prinsip Penamaan Senyawa Ionik dan Kovalen Biner
Senyawa ionik biner terbentuk dari logam (biasanya kation) dan nonlogam (anion). Penamaannya cukup langsung: nama logam disebutkan pertama kali, diikuti nama nonlogam dengan akhiran “-ida”. Misalnya, natrium bergabung dengan klorin menjadi natrium klorida. Untuk logam yang memiliki lebih dari satu bilangan oksidasi, seperti besi, digunakan angka Romawi, misalnya besi(II) oksida.
Senyawa kovalen biner, yang terbentuk antara dua nonlogam, menggunakan awalan numerik Yunani (mono-, di-, tri-, tetra-, penta-, dan seterusnya) untuk menunjukkan jumlah atom setiap unsur. Awalan “mono-” biasanya dihilangkan untuk unsur pertama. Karbon yang berikatan dengan empat atom klorin, misalnya, dinamai karbon tetraklorida, bukan monocarbon tetraklorida.
Perbandingan Penulisan Rumus Kimia Ionik dan Kovalen
Penulisan rumus senyawa ionik didasarkan pada prinsip kenetralan muatan. Rumus kimia menyatakan perbandingan paling sederhana antara kation dan anion yang saling menetralkan. Sebagai contoh, kalium (K⁺) dan sulfida (S²⁻) bergabung dengan rasio 2:1 untuk menetralkan muatan, menghasilkan rumus K₂S. Begitu pula, magnesium (Mg²⁺) dan iodida (I⁻) bergabung dengan rasio 1:2, menjadi MgI₂.
Sebaliknya, rumus senyawa kovalen seperti karbon tetraklorida secara langsung mencerminkan jumlah atom penyusun molekulnya, karena tidak ada transfer elektron yang menghasilkan ion. Rumus CCl₄ secara harfiah berarti satu atom karbon terikat pada empat atom klorin, membentuk sebuah molekul diskrit.
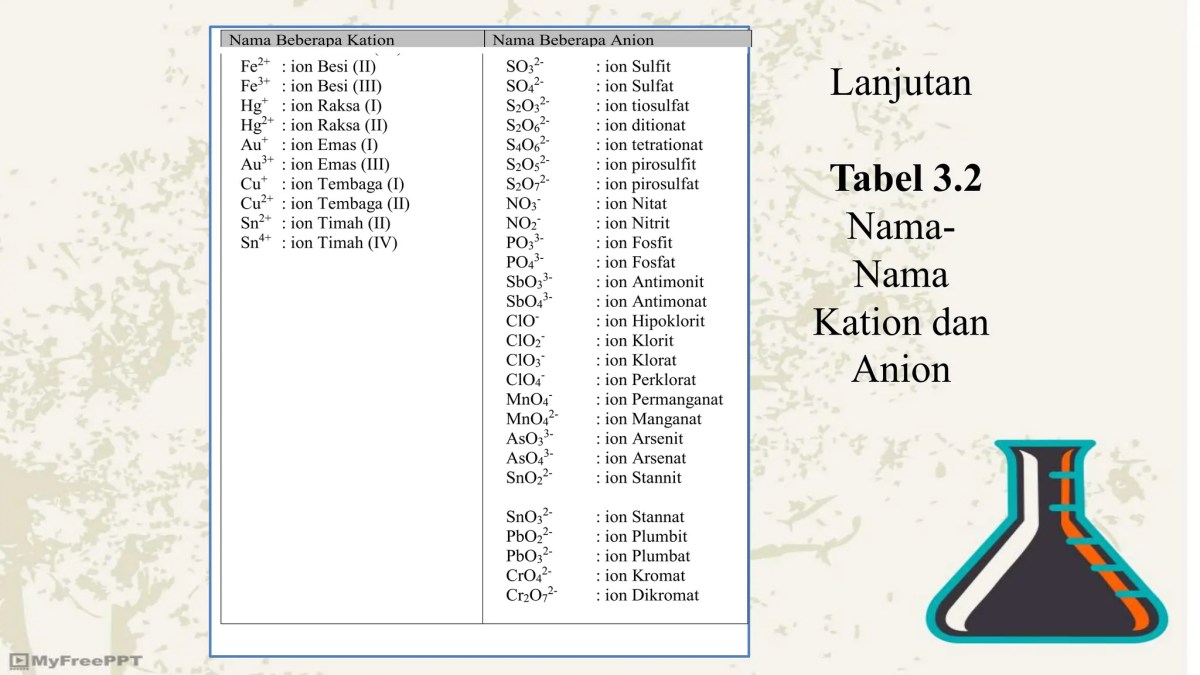
Identifikasi Kation dan Anion serta Peramalan Muatan
Pada senyawa kalsium fluorida (CaF₂), kationnya adalah kalsium (Ca²⁺) dan anionnya adalah fluorida (F⁻). Dalam kalium sulfida (K₂S), kationnya adalah kalium (K⁺) dan anionnya adalah sulfida (S²⁻). Muatan ion-ion ini dapat diramalkan dengan andal berdasarkan posisi unsur dalam tabel periodik. Unsur golongan utama (golongan 1, 2, 13, 14, 15, 16, 17) cenderung mencapai konfigurasi elektron gas mulia.
Logam golongan 1 (seperti Kalium) melepaskan satu elektron untuk membentuk kation +1. Logam golongan 2 (seperti Kalsium dan Magnesium) melepaskan dua elektron untuk membentuk kation +2. Nonlogam golongan 17 (seperti Fluor dan Iodin) menerima satu elektron untuk membentuk anion -1. Nonlogam golongan 16 (seperti Belerang) menerima dua elektron untuk membentuk anion -2. Prinsip ini menjadi panduan utama dalam meramalkan rumus senyawa ionik.
Analisis Struktur dan Ikatan Kimia
Jenis ikatan kimia yang terbentuk antara atom-atom menentukan hampir semua sifat fisik dan kimia suatu zat. Dari kekerasan kristal hingga titik didih cairan, semuanya berakar pada bagaimana elektron-elektron tersebut didistribusikan dan dibagikan di antara atom-atom penyusunnya.
Jenis Ikatan pada Keempat Senyawa
Kalium sulfida (K₂S), magnesium iodida (MgI₂), dan kalsium fluorida (CaF₂) adalah senyawa ionik khas. Ikatan ini terbentuk melalui transfer elektron dari atom logam (yang menjadi kation bermuatan positif) ke atom nonlogam (yang menjadi anion bermuatan negatif). Gaya elektrostatik yang kuat antara ion-ion bermuatan berlawanan inilah yang mengikat kristal. Sebaliknya, karbon tetraklorida (CCl₄) adalah senyawa kovalen murni. Ikatan kovalen terjadi karena pemakaian bersama pasangan elektron antara atom karbon dan atom klorin, tanpa transfer penuh elektron.
Pembentukan Ikatan Kovalen pada Karbon Tetraklorida
Atom karbon (nomor atom 6) memiliki empat elektron valensi. Untuk mencapai kestabilan oktet, ia membutuhkan empat elektron tambahan. Setiap atom klorin (nomor atom 17) memiliki tujuh elektron valensi dan membutuhkan satu elektron untuk mencapai oktet. Solusinya adalah pemakaian bersama: atom karbon menyumbangkan satu elektron untuk dipakai bersama dengan setiap atom klorin, dan setiap klorin menyumbangkan satu elektron untuk dipakai bersama dengan karbon.
Terbentuklah empat pasangan elektron ikatan yang identik, membentuk sebuah molekul tetrahedral dengan atom karbon di pusatnya.
Tabel Perbandingan Sifat Berdasarkan Jenis Ikatan
| Senyawa | Jenis Ikatan | Titik Leleh (Perkiraan) | Kelarutan dalam Air | Daya Hantar Listrik (Lelehan) |
|---|---|---|---|---|
| Kalium Sulfida (K₂S) | Ionik | Tinggi (>840°C) | Tinggi (mudah larut) | Menghantarkan |
| Karbon Tetraklorida (CCl₄) | Kovalen | Rendah (-23°C) | Sangat rendah (tidak larut) | Tidak menghantarkan |
| Magnesium Iodida (MgI₂) | Ionik | Tinggi (~637°C) | Tinggi (mudah larut) | Menghantarkan |
| Kalsium Fluorida (CaF₂) | Ionik | Sangat Tinggi (~1418°C) | Sangat rendah (praktis tidak larut) | Menghantarkan |
Tabel ini mengilustrasikan pola yang jelas: senyawa ionik umumnya memiliki titik leleh tinggi dan menghantarkan listrik dalam keadaan lelehan karena ion-ionnya dapat bergerak bebas. Kelarutannya dalam air bervariasi, bergantung pada kekuatan kisi kristal dan energi hidrasi. Senyawa kovalen seperti CCl₄ memiliki titik leleh rendah, tidak larut dalam air, dan tidak menghantarkan listrik karena tidak mengandung partikel bermuatan yang bebas bergerak.
Tata Nama IUPAC dan Rumus Kimia
Sistem tata nama IUPAC dirancang untuk memberikan kejelasan dan ketidakambiguan. Dengan mengikuti aturan yang telah distandardisasi, kita dapat secara akurat menurunkan rumus kimia dari sebuah nama, atau sebaliknya, memberi nama yang tepat dari sebuah rumus molekul.
Langkah Menurunkan Rumus Kimia dari Nama Ionik
Mari kita ambil contoh kalium sulfida dan kalsium fluorida. Pertama, identifikasi kation dan anion. “Kalium” merujuk pada ion K⁺, dan “sulfida” merujuk pada ion S²⁻. Untuk menetralkan muatan +1 dari satu ion K⁺ dan muatan -2 dari satu ion S²⁻, kita membutuhkan dua ion K⁺. Oleh karena itu, rumus kimianya adalah K₂S.
Untuk kalsium fluorida, “kalsium” adalah Ca²⁺ dan “fluorida” adalah F⁻. Satu ion Ca²⁺ (muatan +2) dapat dinetralkan oleh dua ion F⁻ (masing-masing muatan -1), sehingga rumusnya adalah CaF₂.
Prinsip dasarnya: hasil kali muatan kation dengan jumlah atomnya harus sama dengan hasil kali muatan anion dengan jumlah atomnya. Untuk CaF₂: (2+) x 1 = (1-) x 2.
Aturan Pemberian Nama Senyawa Kovalen Biner
Penamaan senyawa kovalen seperti karbon tetraklorida mengikuti konvensi penggunaan awalan numerik. Aturan-aturan ini penting untuk menghindari kebingungan.
- Awalan Yunani (mono-, di-, tri-, tetra-, penta-, heksa-, hepta-, okta-, dst.) digunakan untuk menunjukkan jumlah atom setiap unsur dalam molekul.
- Awalan “mono-” biasanya dihilangkan untuk unsur pertama dalam nama senyawa. Misalnya, CO disebut karbon monoksida (mono- untuk oksigen dipertahankan), tetapi untuk unsur pertama seperti pada CCl₄, tidak disebut “monocarbon”.
- Nama unsur pertama ditulis utuh, diikuti nama unsur kedua dengan akhiran “-ida”.
- Jika vokal akhir pada awalan (seperti ‘a’ atau ‘o’) bertemu dengan vokal awal nama unsur, salah satunya sering dihilangkan untuk kemudahan pelafalan (misalnya, mono-oksida menjadi monoksida).
Contoh Senyawa dengan Pola Serupa Magnesium Iodida
Magnesium iodida (MgI₂) mewakili pola senyawa ionik biner dari logam golongan 2 (alkali tanah) dan halogen. Banyak senyawa lain mengikuti pola rumus MX₂ yang persis sama, di mana M adalah logam alkali tanah dan X adalah halogen.
- Kalsium klorida (CaCl₂), senyawa yang banyak digunakan untuk mencairkan es di jalan.
- Stronsium bromida (SrBr₂), yang memiliki aplikasi dalam kaca optik.
- Barium iodida (BaI₂), digunakan dalam sintesis kimia dan pembuatan fosfor.
- Berilium klorida (BeCl₂), meskipun menunjukkan karakter kovalen yang lebih besar dibanding anggota golongan lainnya.
Sifat-sifat Fisik dan Kimia Senyawa
Ikatan kimia bukanlah konsep abstrak; ia memanifestasikan dirinya dalam sifat-sifat yang dapat kita amati dan ukur. Perbedaan mendasar antara ikatan ionik dan kovalen menghasilkan perbedaan yang dramatis dalam perilaku zat-zat tersebut.
Pengaruh Jenis Ikatan terhadap Sifat Fisik
Senyawa ionik seperti K₂S, MgI₂, dan CaF₂ umumnya berbentuk padatan kristalin pada suhu ruang dengan titik leleh dan titik didih yang sangat tinggi. Hal ini disebabkan oleh gaya tarik elektrostatik yang sangat kuat antara ion-ion dalam kisi kristal yang rapat. Untuk melelehkan atau mendidihkannya, diperlukan energi yang sangat besar untuk mengatasi gaya-gaya ini. Sebaliknya, senyawa kovalen seperti CCl₄ memiliki gaya antarmolekul (dalam hal ini gaya van der Waals) yang jauh lebih lemah.
Akibatnya, ia memiliki titik leleh dan titik didih yang rendah, dan pada suhu ruang berwujud cair.
Reaktivitas dengan Air: Kalium Sulfida vs Karbon Tetraklorida
Kalium sulfida menunjukkan reaktivitas tinggi dengan air. Senyawa ini tidak hanya larut, tetapi juga mengalami hidrolisis. Ion sulfida (S²⁻) adalah basa kuat yang dapat menerima proton dari air, menghasilkan ion hidrosulfida (HS⁻) dan ion hidroksida (OH⁻). Larutannya akan bersifat basa. Bahkan, senyawa ini dapat bereaksi dengan kelembapan udara.
Sementara itu, karbon tetraklorida praktis tidak bereaksi dengan air. Ia tidak larut (membentuk lapisan terpisah) dan secara kimiawi inert terhadap air dalam kondisi normal karena ikatan C-Cl yang kuat dan sifat nonpolar molekulnya yang ekstrem.
Titik Leleh Tinggi Kalsium Fluorida, Rumus Senyawa: Kalium Sulfida, Karbon Tetraklorida, Magnesium Iodida, Kalsium Fluorida
Kalsium fluorida (CaF₂) memiliki titik leleh yang sangat tinggi, sekitar 1418°C, karena kekuatan luar biasa dari kisi kristal ioniknya. Beberapa faktor penyebabnya adalah: muatan ion yang tinggi (Ca²⁺ dan F⁻), ukuran ion yang relatif kecil, dan rasio stoikiometri yang optimal untuk pengepakan rapat dalam struktur kristal kubus. Ion F⁻ yang kecil dapat mengelilingi setiap ion Ca²⁺ dengan koordinasi yang efisien, dan sebaliknya, memaksimalkan interaksi elektrostatik menarik. Energi kisi yang dihasilkan—energi yang diperlukan untuk memisahkan ion-ion dalam kristal menjadi gas ion—sangat besar. Energi inilah yang harus dilawan untuk melelehkan kristal, sehingga menjelaskan titik lelehnya yang ekstrem dibandingkan senyawa kovalen, yang hanya mengandalkan gaya antarmolekul yang lemah.
Aplikasi dan Kegunaan dalam Kehidupan
Source: slidesharecdn.com
Senyawa-senyawa kimia ini bukan hanya ada di laboratorium; mereka memainkan peran penting dalam berbagai aspek industri, teknologi, dan bahkan kesehatan kita. Memahami sifatnya membantu kita memanfaatkannya dengan tepat dan aman.
Peran Kalsium Fluorida dalam Industri dan Kesehatan
Kalsium fluorida, yang terjadi secara alami sebagai mineral fluorit, memiliki kegunaan yang beragam. Dalam industri, fluorit murni digunakan sebagai fluks dalam produksi baja dan aluminium untuk menurunkan titik leleh dan menghilangkan pengotor. Ia juga merupakan sumber utama fluorin untuk produksi asam fluorida (HF). Dalam bidang optik, kristal CaF₂ yang sangat jernih digunakan untuk membuat lensa dan prisma pada peralatan spektroskopi karena transparansinya yang luas terhadap cahaya inframerah dan ultraviolet.
Dalam kesehatan gigi, ion fluorida (F⁻) yang dilepaskan dari senyawa seperti natrium fluorida atau timah(II) fluorida dalam pasta gigi dan perawatan fluor, membantu remineralisasi email gigi dan mengubah hidroksiapatit menjadi fluorapatit yang lebih tahan terhadap asam dari bakteri plak.
Tabel Kegunaan Utama Keempat Senyawa
| Senyawa | Bidang | Kegunaan Utama | Catatan |
|---|---|---|---|
| Kalium Sulfida (K₂S) | Industri & Laboratorium | Depilatori (pencabut bulu) pada penyamakan kulit, reagen dalam sintesis organik dan analisis anorganik. | Harus ditangani dengan hati-hati karena bereaksi dengan asam menghasilkan gas H₂S yang beracun. |
| Karbon Tetraklorida (CCl₄) | Laboratorium & Industri (Terbatas) | Pelarut nonpolar (historisdalam pemadam kebakaran, pendingin, dry cleaning. Kini terutama sebagai reagen laboratorium dan bahan baku produksi CFC. | Penggunaan komersial luas telah dihentikan karena toksisitas dan dampak lingkungan. |
| Magnesium Iodida (MgI₂) | Laboratorium & Sintesis | Sumber iodida dalam sintesis organik, katalis dalam beberapa reaksi kimia, elektrolit dalam baterai tertentu. | Sering digunakan dalam bentuk larutan atau kompleks eter karena sifat higroskopisnya. |
| Kalsium Fluorida (CaF₂) | Industri, Optik, Metalurgi | Fluks dalam peleburan logam, bahan baku asam fluorida, lensa dan jendela optik (IR/UV), sumber fluorin. | Mineral fluorit memiliki nilai ekonomi yang signifikan dan berwarna-warni karena pengotor. |
Pembatasan Penggunaan Karbon Tetraklorida
Karbon tetraklorida dahulu populer sebagai cairan pemadam kebakaran dan pelarut dry cleaning karena tidak mudah terbakar. Namun, penggunaannya sekarang sangat dibatasi atau dilarang di banyak negara. Alasan utamanya adalah toksisitasnya yang tinggi. Jika terhirup atau tertelan, CCl₄ dapat menyebabkan kerusakan hati dan ginjal yang serius, bahkan kematian. Selain itu, ketika digunakan pada api, ia dapat terdekomposisi menjadi fosgen (COCl₂), gas beracun yang digunakan dalam perang kimia.
Memahami rumus senyawa seperti K₂S, CCl₄, MgI₂, dan CaF₂ memerlukan pendekatan yang komprehensif, layaknya seorang fotografer yang menguasai berbagai teknik untuk menangkap esensi subjeknya. Salah satu teknik fundamental yang patut dipelajari adalah Pengertian Long Shot dalam Fotografi , yang mengajarkan cara melihat gambaran besar secara utuh. Prinsip ini paralel dengan kimia, di mana pemahaman menyeluruh terhadap struktur dan ikatan justru membantu kita mengingat detail rumus-rumus tersebut dengan lebih presisi dan mendalam.
Dari segi lingkungan, CCl₄ adalah zat perusak ozon yang kuat dan sangat persisten. Kombinasi risiko kesehatan yang akut dan dampak lingkungan jangka panjang inilah yang menyebabkan penarikan besar-besaran dari penggunaan konsumen dan industri umum.
Visualisasi Molekul dan Deskripsi Struktur
Membayangkan bagaimana atom dan ion tersusun dalam ruang tiga dimensi memberikan pemahaman intuitif tentang sifat senyawa. Dari molekul tunggal yang simetris hingga kisi kristal yang masif, setiap struktur memiliki ceritanya sendiri.
Geometri Molekul dan Susunan Kristal
Molekul karbon tetraklorida (CCl₄) memiliki geometri tetrahedral yang sempurna. Atom karbon berada di pusat, dan keempat atom klorin menempati sudut-sudut tetrahedron. Sudut ikatan Cl-C-Cl adalah 109,5 derajat, yang meminimalkan tolakan antar pasangan elektron ikatan. Molekul ini nonpolar secara keseluruhan karena simetrinya, meskipun setiap ikatan C-Cl bersifat polar. Sebaliknya, kalsium fluorida (CaF₂) membentuk kristal ionik raksasa dengan struktur kristal kubus yang disebut struktur fluorit.
Dalam dunia kimia, rumus senyawa seperti K₂S, CCl₄, MgI₂, dan CaF₂ merepresentasikan ikatan ionik yang stabil, layaknya komitmen kuat dalam keyakinan. Namun, sejarah Islam mencatat kisah unik tentang Sahabat Nabi Muhammad yang tidak dapat mengucapkan La ilaha illallah , yang justru diakui keimanannya. Analogi ini mengingatkan kita bahwa substansi, baik dalam spiritualitas maupun senyawa kimia, tidak selalu terlihat dari formulasi yang paling gamblang sekalipun.
Dalam struktur ini, setiap ion kalsium (Ca²⁺) dikelilingi oleh delapan ion fluorida (F⁻) yang terletak di sudut-sudut kubus, sementara setiap ion fluorida dikelilingi oleh empat ion kalsium yang tersusun dalam tetrahedron. Pola tiga dimensi yang teratur dan berulang ini sangat kuat dan padat.
Perbandingan Ukuran Ion dan Pengaruhnya
Dalam Kalium Sulfida (K₂S), kita memiliki kation K⁺ yang relatif besar dan anion S²⁻ yang juga besar dengan muatan -2. Dalam Magnesium Iodida (MgI₂), kation Mg²⁺ jauh lebih kecil dan bermuatan lebih tinggi (+2), sedangkan anion I⁻ sangat besar dengan muatan -1. Perbedaan ukuran dan kerapatan muatan ini mempengaruhi sifat. Kisi MgI₂, dengan kation kecil dan anion besar, mungkin memiliki energi kisi yang sedikit lebih rendah dibandingkan jika ion-ionnya berukuran seimbang, dan senyawa ini lebih mudah terhidrasi karena anion I⁻ yang besar dan mudah terpolarisasi.
K₂S, dengan ion-ion yang lebih seimbang dalam hal ukuran, membentuk kisi yang stabil, tetapi anion S²⁻ sangat reaktif terhadap air dan asam.
Proses Pelarutan Senyawa Ionik
Proses pelarutan magnesium iodida (MgI₂) dalam air adalah pertunjukan interaksi yang menarik. Molekul air, yang bersifat polar dengan ujung oksigen bermuatan parsial negatif dan ujung hidrogen bermuatan parsial positif, akan menyerang permukaan kristal. Ujung negatif (oksigen) dari molekul air mengarah dan mengelilingi ion Mg²⁺ yang bermuatan positif, sementara ujung positif (hidrogen) dari molekul air mengelilingi ion I⁻ yang bermuatan negatif.
Interaksi ion-dipol ini mengalahkan gaya tarik elektrostatik antar ion dalam kisi kristal. Satu per satu, ion-ion tersebut terlepas dari kisi dan menjadi terhidrasi—terbungkus oleh selubung molekul air—sehingga tersebar merata di seluruh larutan. Proses ini melepaskan energi (energi hidrasi) dan membutuhkan energi (energi kisi), dan kelarutan terjadi jika energi yang dilepaskan lebih besar daripada yang dibutuhkan.
Penutupan Akhir: Rumus Senyawa: Kalium Sulfida, Karbon Tetraklorida, Magnesium Iodida, Kalsium Fluorida
Dari analisis mendalam terhadap keempat senyawa tersebut, dapat disimpulkan bahwa identitas suatu zat sangat ditentukan oleh jenis ikatan yang menyusunnya. Ikatan ionik yang kuat pada kalsium fluorida memberikannya stabilitas tinggi untuk aplikasi industri, sementara sifat kovalen nonpolar karbon tetraklorida justru menjadi alasan pembatasan penggunaannya. Pemahaman tentang rumus dan struktur ini bukan akhir, melainkan pintu masuk untuk mengapresiasi kompleksitas dan keteraturan alam semesta material.
Pengetahuan ini menjadi fondasi kokoh dalam meramalkan sifat, mengembangkan aplikasi baru, dan tentu saja, membuat kimia menjadi ilmu yang hidup dan relevan.
FAQ Terpadu
Apakah Magnesium Iodida bersifat higroskopis?
Ya, magnesium iodida sangat higroskopis. Senyawa ini mudah menyerap uap air dari udara dan dapat terurai, sehingga sering disimpan dalam wadah kedap udara.
Mengapa Karbon Tetraklorida (CCl4) tidak larut dalam air padahal klorin biasa larut?
Memahami rumus senyawa seperti Kalium Sulfida (K₂S) atau Karbon Tetraklorida (CCl₄) melibatkan logika penulisan yang sistematis, mirip dengan prinsip dalam optik. Dalam fisika, ketepatan rumus juga krusial, contohnya saat Menghitung Panjang Teropong Bumi untuk Mata Tak Akomodasi yang memerlukan formula spesifik. Demikian halnya, penentuan rumus Magnesium Iodida (MgI₂) dan Kalsium Fluorida (CaF₂) bergantung pada valensi unsur, menegaskan bahwa dasar ilmiah yang kuat vital bagi segala disiplin.
Kelarutan ditentukan oleh molekulnya, bukan atom penyusunnya. CCl4 bersifat nonpolar karena simetris, sedangkan air polar. “Like dissolves like,” sehingga CCl4 tidak bercampur dengan air, berbeda dengan ion klorida (Cl-) yang berasal dari senyawa ionik seperti NaCl.
Bagaimana cara membedakan senyawa ionik dan kovalen hanya dari namanya dalam bahasa Indonesia?
Umumnya, nama senyawa ionik langsung menyebutkan nama logam (kation) dan nonlogam dengan akhiran “-ida” (anion), seperti kalium sulfida. Senyawa kovalen biner sering menggunakan awalan numerik Yunani (mono-, di-, tri-, tetra-) untuk menunjukkan jumlah atom, seperti pada karbon
-tetraklorida*.
Apa yang terjadi jika Kalium Sulfida (K2S) bereaksi dengan asam?
Kalium sulfida akan bereaksi dengan asam kuat (seperti HCl) menghasilkan gas hidrogen sulfida (H2S) yang berbau seperti telur busuk dan sangat beracun, serta larutan garam kalium. Reaksi ini berbahaya dan harus dilakukan di lemari asam.
Adakah alternatif yang lebih aman pengganti Karbon Tetraklorida di laboratorium?
Ya, untuk berbagai keperluan seperti pelarut nonpolar atau pembersih, senyawa seperti heksana, diklorometana, atau etil asetat sering digunakan sebagai alternatif yang relatif lebih aman dengan mempertimbangkan sifat racun dan lingkungan.