Tekanan Parsial CO2 dan Uap Air pada Kesetimbangan NaHCO₃ (125 °C, Kp = 0.25) bukan sekadar angka dalam buku teks kimia. Di balik rumus dan suhu tersebut, tersembunyi tarian dinamis molekul yang menentukan nasib soda kue saat dipanaskan, sebuah proses fundamental yang beresonansi dari dapur hingga skala industri. Fenomena ini mengungkap bagaimana padatan putih tak bersalah itu terurai, melepaskan gelembung gas yang kita kenal, di bawah hukum kesetimbangan yang ketat.
Pada suhu 125 derajat Celsius dengan konstanta Kp sebesar 0.25, sistem mencapai titik di mana laju penguraian natrium bikarbonat menjadi natrium karbonat, karbon dioksida, dan uap air setara dengan laju sebaliknya. Yang menarik, hanya tekanan dari dua gas itulah yang ‘bersuara’ dalam rumus Kp, sementara fase padat diam di tempat. Kondisi ini menciptakan hubungan unik di mana total tekanan dalam wadah tertutup menjadi cerminan langsung dari ‘perjanjian damai’ antara CO₂ dan H₂O.
Kesetimbangan Heterogen dan Dekomposisi NaHCO₃
Bayangkan kita memanaskan serbuk soda kue, atau natrium bikarbonat (NaHCO₃), dalam sebuah wadah tertutup. Pada suhu tertentu, kita akan mengamati sebuah tarian molekuler yang rumit: padatan putih itu mulai terurai, melepaskan gas karbon dioksida dan uap air, sementara meninggalkan residu padat yang berbeda, natrium karbonat (Na₂CO₃). Proses ini tidak berjalan satu arah selamanya. Pada kondisi tertentu, laju penguraian NaHCO₃ menjadi produk akan sama persis dengan laju reaksi balik dimana CO₂ dan H₂O bergabung kembali membentuk NaHCO₃.
Saat itulah sistem mencapai keadaan yang kita sebut kesetimbangan kimia.
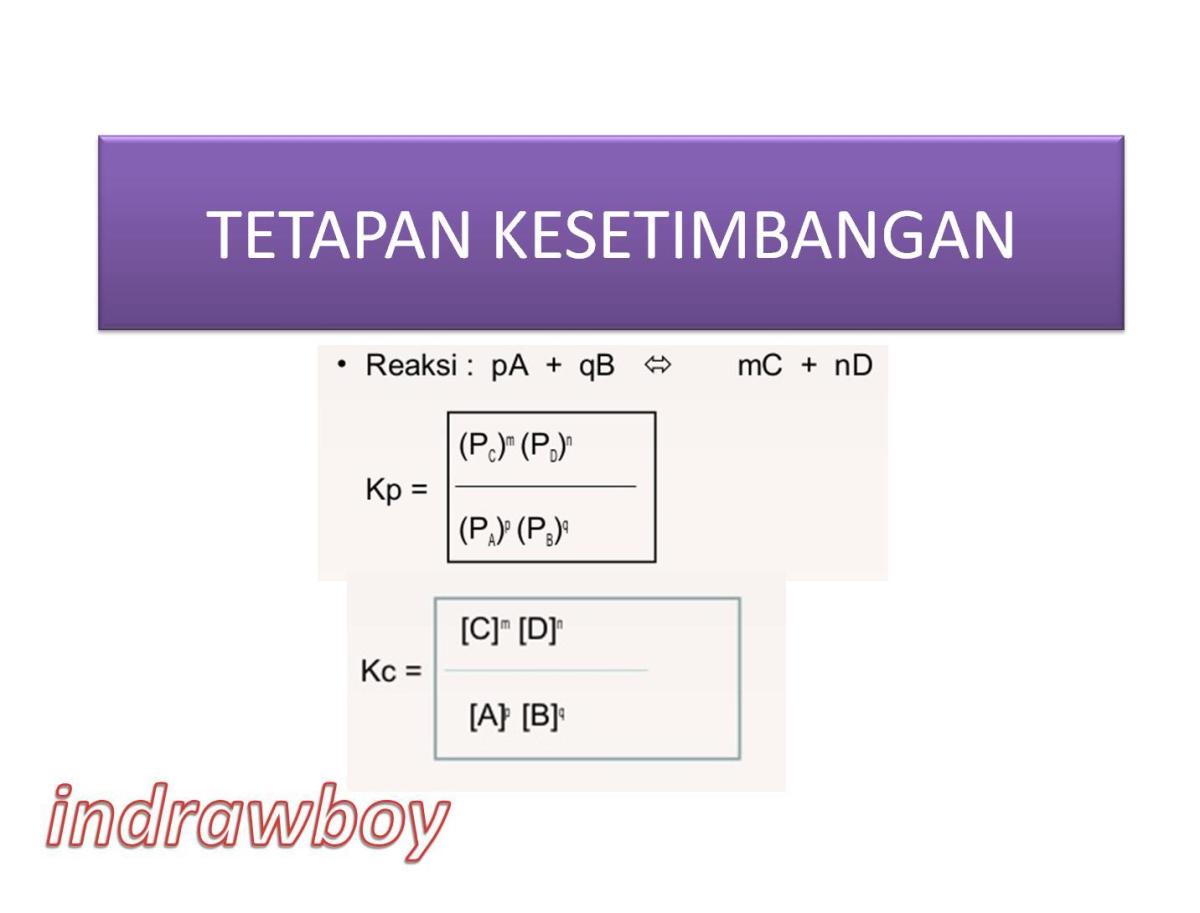
Reaksi dekomposisi termal NaHCO₃ adalah contoh klasik kesetimbangan heterogen, karena melibatkan zat dalam fase yang berbeda—padat dan gas. Persamaan reaksinya dapat ditulis sebagai berikut:
2 NaHCO₃(s) ⇌ Na₂CO₃(s) + CO₂(g) + H₂O(g)
Dalam menuliskan konstanta kesetimbangan berdasarkan tekanan (Kp) untuk reaksi seperti ini, kita mengikuti konvensi penting: konsentrasi fase murni padat dan cair dianggap konstan dan dimasukkan ke dalam nilai K itu sendiri. Oleh karena itu, hanya tekanan parsial gas yang berubah-ubah yang ditulis dalam persamaan Kp. Untuk reaksi di atas, persamaan Kp-nya menjadi sangat sederhana:
Kp = (P_CO₂) × (P_H₂O)
NaHCO₃(s) dan Na₂CO₃(s) tidak muncul dalam persamaan. Ini bukan berarti mereka tidak penting; keberadaan mereka justru esensial untuk reaksi terjadi. Namun, selama padatan tersebut ada, “aktivitas”-nya tetap, sehingga pengaruhnya terhadap Kp sudah termasuk dalam nilai numerik Kp yang diukur secara eksperimen.
Persamaan Kp dan Penghilangan Fase Padat
Konsep mengabaikan fase padat dalam persamaan Kp seringkali membingungkan pada awalnya. Pikirkan sebuah balok kayu yang mengapung di air. Untuk mendeskripsikan kesetimbangan mengapung, kita fokus pada gaya apung dan berat fluida yang dipindahkan, bukan pada setiap molekul kayu. Analoginya, dalam kesetimbangan kimia heterogen, Kp mendeskripsikan “kondisi atmosfer” gas yang berada dalam kesetimbangan dengan padatan. Selama padatan tersebut hadir, komposisi dan sifatnya tidak berubah dalam artian termodinamika; yang berfluktuasi dan mencapai nilai setimbang adalah tekanan parsial gas di atasnya.
Itulah mengapa Kp untuk dekomposisi NaHCO₃ hanya bergantung pada hasil kali tekanan parsial CO₂ dan H₂O.
Analisis Sistem pada 125°C dengan Kp = 0.25
Mari kita masuki kondisi spesifik: suhu 125°C (398 K) dan nilai Kp sebesar 0.25. Angka Kp ini memberitahu kita tentang “kekuatan” dorongan reaksi ke arah produk pada suhu tersebut. Nilai 0.25 yang kurang dari 1 menunjukkan bahwa pada suhu ini, reaktan (NaHCO₃) lebih disukai secara termodinamika, tetapi produk gas dalam jumlah signifikan tetap ada. Karena dari stoikiometri reaksi, setiap molekul NaHCO₃ yang terurai menghasilkan satu molekul CO₂ dan satu molekul H₂O, maka dalam sistem tertutup, jumlah mol keduanya selalu sama.
Implikasi stoikiometri ini sangat elegan: pada kesetimbangan, tekanan parsial CO₂ (P_CO₂) harus sama dengan tekanan parsial H₂O (P_H₂O). Mengapa? Karena gas-gas tersebut dihasilkan dalam rasio 1:1, menempati volume yang sama, dan suhu yang sama, sehingga menurut hukum gas ideal, tekanan parsialnya identik. Jika kita misalkan P_CO₂ = P_H₂O = x, maka persamaan Kp menjadi:
Kp = x
x = x² = 0.25
Dari sini kita dapatkan x = √0.25 = 0.5 atm. Jadi, pada kesetimbangan, P_CO₂ = P_H₂O = 0.5 atm. Tekanan total sistem (P_total) adalah jumlah semua tekanan parsial gas, sehingga P_total = 0.5 + 0.5 = 1.0 atm.
Namun, bagaimana jika sistem tidak murni? Misalnya, ada gas inert atau salah satu produk gas sudah ada sejak awal. Maka perbandingan tekanan parsialnya bisa berbeda, asalkan hasil kalinya tetap 0.25. Tabel berikut menunjukkan beberapa variasi pasangan tekanan yang memenuhi Kp = 0.25, dan tekanan total yang dihasilkan.
| P_CO₂ (atm) | P_H₂O (atm) | Kp (P_CO₂ × P_H₂O) | P_Total (atm) |
|---|---|---|---|
| 0.10 | 2.50 | 0.25 | 2.60 |
| 0.25 | 1.00 | 0.25 | 1.25 |
| 0.50 | 0.50 | 0.25 | 1.00 |
| 1.00 | 0.25 | 0.25 | 1.25 |
| 2.50 | 0.10 | 0.25 | 2.60 |
Baris ketiga adalah kondisi stoikiometris murni yang kita hitung. Tabel ini mengungkap bahwa tekanan total minimum sistem (1.0 atm) terjadi justru ketika perbandingan tekanan parsialnya stoikiometris (1:1). Setiap penyimpangan dari rasio ini, misalnya dengan menambahkan CO₂ eksternal, akan meningkatkan tekanan total sistem untuk mempertahankan nilai Kp yang konstan pada suhu tetap.
Hubungan Stoikiometri dan Tekanan Parsial, Tekanan Parsial CO2 dan Uap Air pada Kesetimbangan NaHCO₃ (125 °C, Kp = 0.25)
Hubungan 1:1 antara CO₂ dan H₂O yang dihasilkan adalah kunci untuk menyederhanakan perhitungan dalam sistem tertutup murni dari dekomposisi NaHCO₃. Dalam wadah tertutup dengan awal hanya NaHCO₃ padat, setiap molekul CO₂ yang muncul harus diiringi oleh satu molekul H₂O. Karena itu, fraksi mol masing-masing gas dalam fase gas adalah 0.5, dan tekanan parsialnya selalu sama. Kondisi ini memungkinkan penentuan Kp yang mudah hanya dengan mengukur tekanan total sistem (P_total), karena P_CO₂ = P_H₂O = P_total / 2, sehingga Kp = (P_total/2)².
Dinamika Kesetimbangan: Pengaruh Suhu dan Konsentrasi
Kesetimbangan bukanlah keadaan statis, melainkan dinamis. Ia akan merespons jika kita mengganggu kondisinya, sesuai dengan Prinsip Le Chatelier. Mari kita lihat faktor-faktor apa saja yang dapat menggeser posisi kesetimbangan dekomposisi NaHCO₃.
Pertama, suhu. Dekomposisi NaHCO₃ adalah proses endoterm; dibutuhkan panas untuk memecah ikatan dalam NaHCO₃. Menurut Le Chatelier, jika kita menaikkan suhu sistem, kesetimbangan akan bergeser ke arah yang menyerap kalor, yaitu ke arah produk. Akibatnya, nilai Kp akan meningkat pada suhu yang lebih tinggi. Sebaliknya, penurunan suhu akan menggeser kesetimbangan ke arah NaHCO₃ dan menurunkan nilai Kp.
Inilah mengapa soda kue baru mulai mengurai signifikan saat dipanaskan.
Kedua, perubahan tekanan parsial gas. Jika kita menyedot keluar CO₂ dari wadah kesetimbangan, sistem akan berusaha mengembalikan tekanan parsial CO₂ dengan menggeser kesetimbangan ke kanan, menghasilkan lebih banyak CO₂ dan H₂O, sehingga lebih banyak Na₂CO₃ terbentuk. Sebaliknya, jika kita menyuntikkan CO₂ ekstra, sistem akan bergeser ke kiri, mengonsumsi CO₂ dan H₂O untuk membentuk kembali NaHCO₃.
Efek Perubahan Volume
Bagaimana dengan perubahan volume wadah? Untuk reaksi dekomposisi ini, di mana jumlah mol gas produk (2 mol) lebih besar daripada reaktan gas (0 mol), perubahan volume memiliki efek yang signifikan. Memperbesar volume wadah pada suhu konstan akan mengurangi tekanan total. Sistem merespons dengan bergeser ke arah yang menghasilkan lebih banyak mol gas (ke kanan) untuk mencoba meningkatkan tekanan kembali. Meskipun pada akhirnya tekanan setimbang baru akan lebih rendah, komposisi gas akan berubah: fraksi mol CO₂ dan H₂O tetap sama, tetapi jumlah mol absolutnya lebih besar.
Perhitungannya menjadi lebih kompleks karena harus melibatkan jumlah awal dan derajat disosiasi, namun prinsip Le Chatelier memberikan prediksi kualitatif yang jelas.
Aplikasi dan Simulasi Penentuan Kp
Source: z-dn.net
Konsep kesetimbangan ini bukan hanya teori, tetapi dapat diverifikasi melalui eksperimen yang relatif sederhana. Bayangkan sebuah prosedur laboratorium untuk menentukan nilai Kp dekomposisi NaHCO₃.
Prosedur kuncinya melibatkan pemanasan sejumlah murni NaHCO₃ dalam sebuah tabung reaksi yang disambung ke manometer (pengukur tekanan) dalam sistem tertutup dan divakum awal. Sistem ini kemudian direndam dalam penangas oli yang dijaga konstan pada 125°C. Kita amati tekanan pada manometer hingga tidak berubah lagi, yang menandakan tercapainya kesetimbangan. Tekanan yang terbaca adalah tekanan total dari CO₂ dan H₂O. Dengan asumsi sistem murni dan stoikiometris, kita dapat menghitung Kp.
Bagaimana jika kita ingin tahu tekanan parsial CO₂ saja, misalnya dalam campuran dimana uap air mungkin juga berasal dari sumber lain? Langkah-langkah perhitungannya adalah:
- Ukur tekanan total sistem (P_total) pada suhu kesetimbangan.
- Ketahui atau ukur tekanan uap air jenuh (P*_H₂O) pada suhu tersebut dari data referensi. Untuk 125°C, nilai ini sekitar 2.32 atm (karena air mendidih pada 100°C).
- Dalam campuran gas, tekanan parsial H₂O (P_H₂O) tidak akan melebihi P*_H₂O. Jika sistem jenuh, maka P_H₂O = P*_H₂O.
- Tekanan parsial CO₂ dapat dihitung dari selisih: P_CO₂ = P_total – P_H₂O. Nilai Kp kemudian dapat dicek dengan mengalikan P_CO₂ dan P_H₂O.
Mari kita lihat contoh numerik untuk menghitung derajat disosiasi (α), yaitu fraksi NaHCO₃ awal yang terurai. Misalkan kita memulai dengan ‘n’ mol NaHCO₃ dalam wadah bervolume ‘V’ liter pada 125°C. Pada kesetimbangan, tekanan total terukur adalah 1.0 atm (sesuai kondisi stoikiometris).
2 NaHCO₃(s) ⇌ Na₂CO₃(s) + CO₂(g) + H₂O(g)
Awal: n mol ––
Bereaksi: -2αn mol +αn mol +αn mol +αn mol
Setimbang: (n-2αn) mol αn mol αn mol (dalam mol gas)
Jumlah total mol gas = αn + αn = 2αn. Dengan hukum gas ideal, P_total V = (2αn) R T. Dari sini kita bisa cari α jika kita tahu ‘n’ dan ‘V’. Misal, n=1 mol dan V=32.8 L (dipilih agar angka mudah), R=0.0821 L.atm/mol.K, T=398 K, P_total=1 atm. Maka:
1
– 32.8 = (2α
– 1)
– 0.0821
– 398.
32.8 = 2α
– 32.68.
2α ≈ 1.0037, sehingga α ≈ 0.502.
Artinya, sekitar 50.2% NaHCO₃ awal telah terurai pada kondisi ini.
Hubungan penting antara Kp dan α dalam sistem tertutup murni ini adalah: Kp = (P_total/2)², dan P_total sendiri bergantung linier pada α. Jadi, mengukur P_total secara langsung memberi informasi tentang sejauh mana reaksi dekomposisi berjalan.
Representasi Visual dan Gambaran Mikroskopis
Memahami kesetimbangan seringkali dibantu dengan visualisasi. Mari kita bayangkan beberapa representasi.
Pertama, diagram fasa skematik yang menampilkan wilayah kestabilan NaHCO₃ dan Na₂CO₃ sebagai fungsi suhu dan tekanan parsial CO₂. Pada diagram ini, sumbu Y adalah tekanan parsial CO₂ (biasanya dalam skala logaritmik) dan sumbu X adalah suhu. Akan ada sebuah garis kurva yang membagi diagram menjadi dua area. Area di atas garis, dimana P_CO₂ tinggi, adalah wilayah stabil Na₂CO₃. Area di bawah garis, dimana P_CO₂ rendah, adalah wilayah stabil NaHCO₃.
Garis itu sendiri merepresentasikan kondisi kesetimbangan dimana kedua padatan koeksis. Pada suhu 125°C, garis tersebut akan berada pada P_CO₂ = 0.5 atm, asumsi P_H₂O juga 0.5 atm. Jika kita meningkatkan suhu, garis akan naik, artinya diperlukan P_CO₂ yang lebih tinggi untuk menstabilkan Na₂CO₃ pada suhu yang lebih panas.
Kedua, grafik hubungan antara tekanan total sistem dengan komposisi gas. Untuk sistem stoikiometris murni pada 125°C, grafik ini sederhana: karena P_CO₂ selalu sama dengan P_H₂O, maka fraksi mol masing-masing selalu 0.5, terlepas dari tekanan total. Namun, jika kita memplot variasi dari tabel sebelumnya (dimana rasio berubah), grafik akan menunjukkan dua garis yang simetris: saat P_CO₂ rendah, P_H₂O tinggi, dan sebaliknya, dengan hasil kali konstan 0.25.
Tekanan total minimum terjadi pada titik pertemuan kedua garis, yaitu saat fraksi mol keduanya 0.5.
Proses Dinamis di Permukaan Padatan
Di tingkat mikroskopis, permukaan kristal NaHCO₃ adalah panggung yang sibuk. Pada suhu 125°C, molekul-molekul NaHCO₃ di permukaan mendapatkan energi thermal yang cukup untuk melepaskan diri dari kisi kristal, terurai menjadi ion-ion yang kemudian segera membentuk molekul CO₂ dan H₂O yang terdesorpsi ke fase gas. Peristiwa ini terjadi di banyak tempat secara acak. Secara bersamaan, molekul CO₂ dan H₂O dari fase gas bergerak acak dan dapat bertumbukan dengan permukaan padatan Na₂CO₃ yang terbentuk.
Dalam tumbukan yang efektif, dengan orientasi dan energi yang tepat, molekul-molekul gas tersebut dapat teradsorpsi dan bereaksi di permukaan Na₂CO₃ untuk membentuk kembali NaHCO₃. Pada keadaan kesetimbangan, laju kedua proses yang berlawanan arah ini persis sama. Apa yang kita ukur sebagai tekanan parsial gas yang konstan adalah manifestasi makroskopik dari kesetimbangan dinamis mikroskopis ini, di mana jumlah molekul yang meninggalkan fase gas untuk membentuk padatan sama persis dengan jumlah molekul yang masuk ke fase gas dari penguraian padatan.
Ringkasan Akhir: Tekanan Parsial CO2 Dan Uap Air Pada Kesetimbangan NaHCO₃ (125 °C, Kp = 0.25)
Dari perhitungan tekanan parsial hingga visualisasi diagram fasa, analisis kesetimbangan dekomposisi NaHCO₃ ini lebih dari sekadar memecahkan soal. Ia adalah jendela untuk memahami prinsip universal yang mengendalikan reaksi heterogen, di mana permukaan padat menjadi panggung bagi pertukaran molekul gas. Pemahaman ini bukan akhir, melainkan kunci untuk mengoptimalkan proses industri, dari pembuatan serbuk pemadam api hingga produksi soda ash, membuktikan bahwa kesetimbangan yang tampak statis sesungguhnya penuh dengan dinamika yang bermanfaat.
Kumpulan FAQ
Apakah reaksi dekomposisi NaHCO₃ selalu menghasilkan tekanan parsial CO₂ dan H₂O yang sama?
Tidak selalu. Berdasarkan stoikiometri reaksi 2NaHCO₃(s) ⇌ Na₂CO₃(s) + CO₂(g) + H₂O(g), perbandingan mol gas yang dihasilkan adalah 1:1. Namun, tekanan parsialnya bisa berbeda jika ada gangguan dari luar, seperti penambahan salah satu gas ke dalam sistem, yang akan menggeser kesetimbangan menurut Prinsip Le Chatelier.
Bagaimana cara mengukur Kp untuk reaksi ini secara eksperimen di lab?
Dengan memanaskan sejumlah NaHCO₃ murni dalam wadah tertutup bervolume tetap pada suhu konstan 125°C. Setelah sistem stabil, ukur tekanan total di dalam wadah. Karena pada kondisi stoikiometri murni P_CO₂ = P_H₂O, maka tekanan total (P_total) adalah dua kali tekanan parsial salah satunya. Nilai Kp kemudian dihitung sebagai hasil kali kedua tekanan parsial tersebut, yaitu (P_total/2)².
Apa yang terjadi jika suhu dinaikkan di atas 125°C?
Kenaikan suhu akan menggeser kesetimbangan ke arah reaksi endoterm, yaitu dekomposisi NaHCO₃. Akibatnya, nilai Kp baru akan lebih besar dari 0.25, menghasilkan tekanan parsial CO₂ dan H₂O yang lebih tinggi pada kesetimbangan baru. Hal ini sesuai dengan Prinsip Le Chatelier yang merespons penambahan panas.
Apakah volume wadah mempengaruhi tekanan parsial saat kesetimbangan tercapai?
Untuk reaksi heterogen ini, perubahan volume wadah tidak mempengaruhi posisi kesetimbangan atau nilai tekanan parsial gas saat kesetimbangan, asalkan suhu tetap. Volume hanya mempengaruhi waktu yang dibutuhkan untuk mencapai kesetimbangan, bukan nilai akhir Kp atau tekanan parsialnya, karena Kp hanya bergantung pada suhu.
Apa hubungan antara derajat disosiasi (α) dan nilai Kp 0.25?
Derajat disosiasi (α) menunjukkan fraksi NaHCO₃ yang terurai. Pada Kp=0.25 dan dengan asumsi awal hanya ada NaHCO₃, nilai α dapat dihitung melalui hubungan Kp dengan tekanan total yang bergantung pada α. Nilai Kp yang tetap ini membatasi seberapa banyak NaHCO₃ dapat terurai pada suhu tertentu, sehingga α pada 125°C akan bernilai spesifik.