Hitung jumlah partikel, massa, dan volume 2 mol Cu, MgO, O₂ terdengar seperti tugas kimia yang standar, ya? Tapi tunggu dulu, di balik angka-angka itu ada cerita menarik tentang bagaimana dunia mikroskopis atom dan molekul terhubung dengan sesuatu yang bisa kita timbang dan ukur dalam kehidupan sehari-hari. Bayangkan, kita akan membongkar rahasia di balik sepotong tembaga, segenggam magnesium oksida, dan sejumlah gas oksigen dengan jumlah ‘paket’ partikel yang sama.
Seru, kan?
Mari kita telusuri bersama. Perjalanan ini akan membawa kita memahami konsep mol yang sering jadi misteri, lalu menerjemahkannya menjadi bilangan partikel yang nyaris tak terbayangkan, massa yang bisa dirasakan di tangan, dan volume gas yang mengisi ruang. Semua ini bukan sekadar hitung-hitungan kering, melainkan kunci untuk membuka pemahaman tentang sifat dasar materi di sekitar kita, dari logam mengilap di kabel listrik hingga udara yang kita hirup.
Konsep Dasar Mol dan Bilangan Avogadro
Bayangkan kamu punya toko kelontong. Untuk menghitung telur, kamu pakai satuan lusin. Untuk menghitung kertas, mungkin pakai rim. Nah, di dunia yang super kecil seperti atom dan molekul, para ilmuwan butuh satuan jumlah yang jauh lebih besar. Di sinilah mol berperan.
Mol adalah satuan jumlah dalam ilmu kimia, seperti lusin, tapi skalanya luar biasa besar. Satu mol zat mengandung tepat 6.022 x 10²³ partikel elementer (atom, molekul, ion, atau elektron). Angka ajaib ini dikenal sebagai Bilangan Avogadro.
Untuk membayangkan besarnya angka ini, coba pikirkan tentang butiran pasir di seluruh pantai di Bumi. Jumlah butiran pasir itu masih kalah banyak dibandingkan jumlah atom dalam beberapa gram besi saja. Itulah mengapa mol menjadi jembatan yang brilian. Dia menghubungkan dunia mikroskopis yang tak terlihat oleh mata dengan dunia makroskopis yang bisa kita timbang dan ukur di laboratorium.
Mol dalam Analogi Sehari-hari
Memahami 6.022 x 10²³ memang sulit. Mari kita buat analogi sederhana. Jika satu butir beras mewakili satu atom, maka satu mol beras akan memenuhi seluruh permukaan Bumi dengan tumpukan beras setinggi gedung pencakar langit. Atau, jika kamu menghabiskan satu miliar rupiah per detik, kamu akan butuh waktu lebih dari 19 juta tahun untuk menghabiskan uang sebanyak bilangan Avogadro dalam rupiah.
Intinya, mol adalah cara kita ‘membundel’ partikel sangat kecil menjadi jumlah yang bermakna dan bisa dikelola dalam perhitungan kimia.
| Satuan | Mewakili | Jumlah | Digunakan Untuk |
|---|---|---|---|
| Lusin | Objuk sehari-hari | 12 buah | Telur, donat, pensil |
| Rim | Lembaran kertas | 500 lembar | Kertas A4, HVS |
| Mol | Partikel elementer | 6.022 x 10²³ | Atom, molekul, ion |
Konsep mol ini menjadi fondasi. Dia memberitahu kita bahwa jika kita mengambil 1 mol besi dan 1 mol emas, jumlah atomnya pasti sama persis, yaitu 6.022 x 10²³. Namun, karena setiap atom punya massa berbeda, maka massa satu mol besi dan satu mol emas pasti berbeda. Inilah hubungan intim antara jumlah partikel (mol) dengan massa yang bisa kita pegang (gram).
Menghitung Jumlah Partikel dari Mol
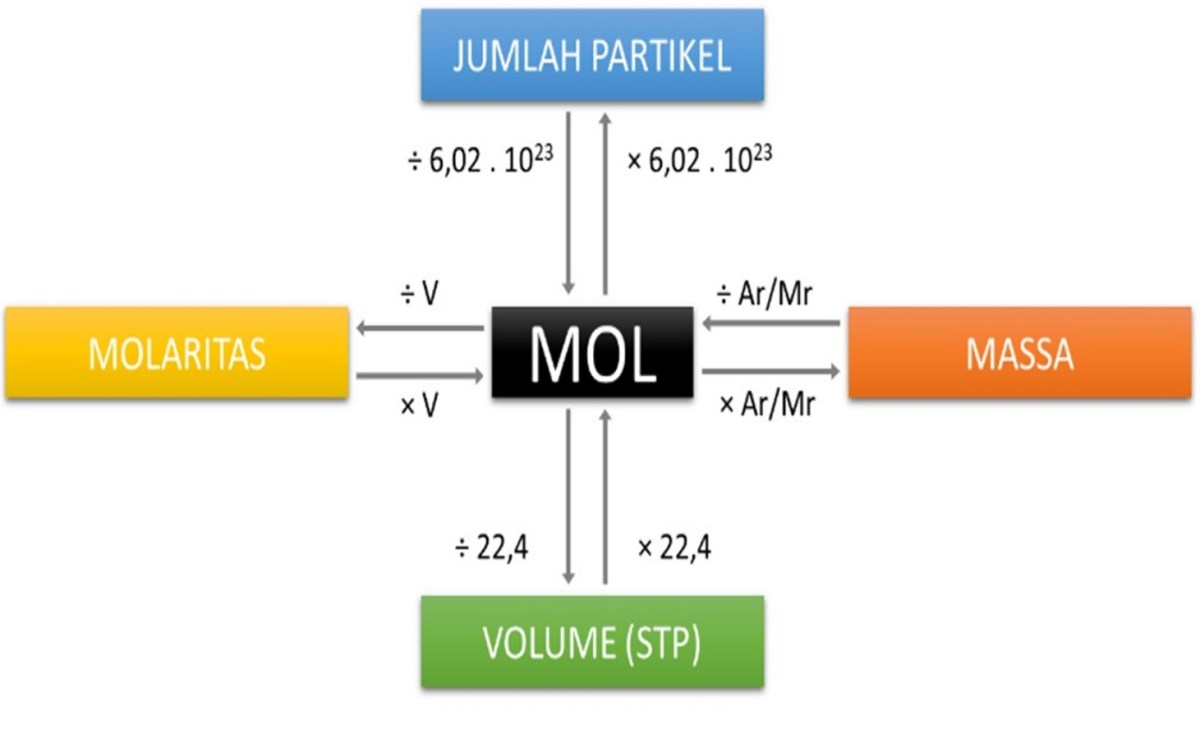
Sekarang kita masuk ke hal yang lebih teknis tapi seru. Jika kita sudah tahu jumlah mol suatu zat, menghitung berapa banyak partikel di dalamnya jadi sangat mudah. Rumus dasarnya sederhana: Jumlah Partikel = Jumlah Mol x Bilangan Avogadro. Dengan kata lain, kalikan saja mol yang kamu punya dengan 6.022 x 10²³.
Namun, ada satu hal krusial yang harus selalu kamu tanyakan sebelum menghitung: “Partikel apa yang sedang kita hitung?” Apakah atom tunggal seperti pada tembaga (Cu)? Atau unit formula seperti pada senyawa ionik magnesium oksida (MgO)? Atau molekul seperti pada gas oksigen (O₂)? Jenis partikel ini menentukan interpretasi hasil akhirmu.
Perhitungan untuk 2 Mol Cu, MgO, dan O₂
Source: ac.id
Mari kita praktikkan langsung untuk 2 mol dari ketiga zat kita.
Hitung jumlah partikel, massa, dan volume dari 2 mol Cu, MgO, dan O₂ itu seperti main tebak-tebakan yang seru tapi butuh ketelitian. Nah, logika berhitung yang sama juga bisa kamu terapkan di kehidupan sehari-hari, misalnya pas lagi hunting diskon. Biar nggak salah hitung, coba cek Rumus Harga Diskon: Hitung Harga Setelah Diskon (HD) dari H dan d supaya kamu bisa hemat dengan tepat.
Setelah itu, balik lagi fokus ke soal kimia tadi, karena menghitung dengan akurat itu kunci utama di mana pun, baik di lab maupun di kasir.
- 2 mol Tembaga (Cu): Tembaga adalah unsur logam. Partikel terkecilnya adalah atom Cu. Jadi, perhitungannya langsung: 2 mol x 6.022 x 10²³ atom/mol = 1.2044 x 10²⁴ atom Cu.
- 2 mol Magnesium Oksida (MgO): MgO adalah senyawa ionik yang tersusun atas ion Mg²⁺ dan O²⁻. Partikel terkecil yang mewakili susunan stoikiometrinya disebut unit formula (MgO). Jadi, 2 mol x 6.022 x 10²³ unit formula/mol = 1.2044 x 10²⁴ unit formula MgO. Dalam setiap unit formula ini, terkandung 1 ion Mg²⁺ dan 1 ion O²⁻.
- 2 mol Gas Oksigen (O₂): Oksigen di alam berada sebagai molekul diatomik (O₂). Partikel yang kita hitung adalah molekulnya. Jadi, 2 mol x 6.022 x 10²³ molekul/mol = 1.2044 x 10²⁴ molekul O₂. Setiap molekul ini terdiri dari 2 atom oksigen.
Kunci dari perhitungan jumlah partikel bukan hanya pada angkanya, yang untuk mol sama selalu identik, tetapi pada pemahaman tentang apa yang diwakili oleh angka tersebut—apakah itu atom tunggal, pasangan ion dalam suatu kisi, atau sekelompok atom yang terikat dalam satu molekul.
Perbedaan mendasar terletak pada wujud partikelnya. Untuk unsur logam seperti Cu, kita menghitung atom individu. Untuk senyawa ionik seperti MgO, kita menghitung ‘pasangan’ ion terkecil yang netral. Sedangkan untuk senyawa molekuler seperti O₂, kita menghitung molekulnya. Meski angka akhirnya sama untuk mol yang sama, makna di balik angka itu berbeda.
Menentukan Massa dari Jumlah Mol
Inilah salah satu kegunaan terhebat konsep mol: memprediksi massa suatu sampel tanpa harus menimbang satu per satu atomnya. Caranya adalah dengan menggunakan massa molar. Massa molar adalah massa satu mol zat, satuannya gram per mol (g/mol). Nilainya secara numerik sama dengan massa atom relatif (Ar) atau massa molekul relatif (Mr) yang bisa kamu lihat di tabel periodik.
Jadi, untuk menghitung massa dari sejumlah mol, rumusnya adalah: Massa (g) = Jumlah Mol (mol) x Massa Molar (g/mol). Sederhana, bukan? Kamu hanya perlu tahu berapa mol dan berapa massa molar zatnya.
Massa Molar dan Perhitungannya
Berikut adalah data massa atom yang kita butuhkan: Cu = 63.55 g/mol, Mg = 24.31 g/mol, O = 16.00 g/mol. Dari data ini, kita bisa tentukan massa molar senyawanya.
| Zat/Unsur | Rumus/Kode | Massa Molar (g/mol) | Cara Menentukan |
|---|---|---|---|
| Tembaga | Cu | 63.55 | Langsung dari Ar Cu |
| Magnesium | Mg | 24.31 | Langsung dari Ar Mg |
| Oksigen (atom) | O | 16.00 | Langsung dari Ar O |
| Magnesium Oksida | MgO | 40.31 | Ar Mg + Ar O = 24.31 + 16.00 |
| Gas Oksigen | O₂ | 32.00 | 2 x Ar O = 2 x 16.00 |
Sekarang, mari hitung massa untuk 2 mol masing-masing zat:
- 2 mol Cu: Massa = 2 mol x 63.55 g/mol = 127.10 gram. Bayangkan sepotong batang tembaga seberat itu.
- 2 mol MgO: Massa = 2 mol x 40.31 g/mol = 80.62 gram. Kira-kira seperti massa sebuah smartphone yang kecil.
- 2 mol O₂: Massa = 2 mol x 32.00 g/mol = 64.00 gram. Sangat ringan untuk jumlah partikel yang sangat banyak karena oksigen adalah unsur yang ringan.
Mengapa massanya berbeda padahal jumlah molnya sama? Jawabannya kembali ke individu partikelnya. Satu atom tembaga (63.55 sma) lebih berat dari satu unit formula MgO (40.31 sma), dan jauh lebih berat dari satu molekul O₂ (32.00 sma). Jadi, ketika kamu mengambil jumlah partikel yang sama banyaknya (2 x 6.022×10²³), wajar jika kumpulan atom tembaga akan memiliki massa total terbesar, diikuti oleh kumpulan MgO, dan terakhir O₂.
Bayangkan membandingkan 100 butir merica, 100 butir beras, dan 100 butir kelereng. Jumlahnya sama, tetapi total massanya jelas berbeda.
Mengestimasi Volume Gas pada Keadaan Standar (STP): Hitung Jumlah Partikel, Massa, Dan Volume 2 mol Cu, MgO, O₂
Untuk zat berwujud padat dan cair, volume sangat bergantung pada kerapatan masing-masing zat. Namun, untuk gas, ada keunikan yang memudahkan kita. Pada kondisi yang sama (suhu dan tekanan), gas-gas ideal memiliki volume molar yang sama. Kondisi standar yang disepakati dalam kimia disebut STP (Standard Temperature and Pressure), yaitu 0°C (273 K) dan tekanan 1 atm. Pada kondisi ini, 1 mol gas ideal menempati volume sebesar 22.4 liter.
Dari ketiga zat kita, hanya O₂ yang berwujud gas pada kondisi STP. Tembaga (Cu) adalah padatan logam, sedangkan Magnesium Oksida (MgO) adalah padatan kristal ionik yang sangat tinggi titik leburnya. Mereka tidak bisa diestimasi volumenya sebagai gas pada STP karena memang bukan gas pada suhu tersebut.
Perhitungan Volume 2 Mol O₂ pada STP, Hitung jumlah partikel, massa, dan volume 2 mol Cu, MgO, O₂
Perhitungannya menjadi sangat lugas. Jika 1 mol gas apa saja (ideal) pada STP volumenya 22.4 L, maka untuk 2 mol gas oksigen (O₂): Volume = 2 mol x 22.4 L/mol = 44.8 liter.
Coba bayangkan volume sebuah bola pantai besar atau tabung gas kecil. Itulah kira-kira volume yang ditempati oleh 2 mol gas oksigen pada suhu 0°C dan tekanan 1 atm. Angka 22.4 L/mol ini adalah pendekatan yang sangat berguna untuk estimasi cepat.
Hitung jumlah partikel, massa, dan volume dari 2 mol Cu, MgO, dan O₂ itu seperti memahami aturan main yang fundamental. Nah, dalam konteks yang lebih luas, prinsip dasar ini punya semangat yang mirip dengan Dasar Berlakunya Hukum Adad di Indonesia —keduanya berakar pada realitas yang konkret dan terus hidup dalam dinamikanya. Jadi, setelah melihat bagaimana adat bertahan, kamu pasti lebih paham bahwa perhitungan stoikiometri ini bukan sekadar angka, tapi cerita tentang hubungan yang terukur dalam setiap partikelnya.
- Perbandingan dengan Keadaan Lain: Volume gas sangat peka terhadap perubahan suhu dan tekanan. Pada suhu ruang (25°C/298 K) dan tekanan 1 atm, volume molar gas membesar menjadi sekitar 24.5 L/mol. Di dataran tinggi dengan tekanan lebih rendah, volume gas akan lebih besar lagi untuk jumlah mol yang sama. Inilah sifat gas yang mudah dimampatkan dan mengembang.
Penyajian Data dan Perbandingan Hasil Perhitungan
Setelah melalui semua perhitungan, mari kita rangkum semua hasil untuk 2 mol dari ketiga zat tersebut dalam satu tabel yang komprehensif. Tabel ini akan dengan jelas menunjukkan bagaimana konsep mol menghubungkan ketiga aspek: jumlah partikel, massa, dan volume (untuk gas).
| Zat (2 mol) | Jenis Partikel | Jumlah Partikel | Massa (gram) | Volume pada STP (Liter) |
|---|---|---|---|---|
| Tembaga (Cu) | Atom | 1.204 x 10²⁴ atom | 127.10 | Tidak berlaku (padat) |
| Magnesium Oksida (MgO) | Unit Formula | 1.204 x 10²⁴ unit formula | 80.62 | Tidak berlaku (padat) |
| Gas Oksigen (O₂) | Molekul | 1.204 x 10²⁴ molekul | 64.00 | 44.8 |
Interpretasi dari tabel ini sangat menarik. Pertama, lihat kolom Jumlah Partikel. Ketiganya memiliki angka yang sama persis. Ini membuktikan bahwa mol benar-benar satuan jumlah, terlepas dari jenis zatnya. Kedua, lihat kolom Massa.
Angkanya berbeda-beda, mencerminkan perbedaan massa masing-masing partikel penyusunnya. Ketiga, kolom Volume hanya terisi untuk O₂, karena volume padatan dan cairan tidak memiliki hubungan langsung dan sederhana dengan mol seperti pada gas ideal.
Tips sistematis untuk menghitung ini semua untuk zat lain adalah dengan mengikuti alur logika ini: (1) Identifikasi zat: unsur, senyawa ionik, atau molekuler? (2) Tentukan partikel apa yang dihitung (atom, ion, molekul). (3) Cari atau hitung massa molar dari tabel periodik. (4) Gunakan rumus yang tepat: Jumlah Partikel = mol x N_A; Massa = mol x Massa Molar; Volume Gas (STP) = mol x 22.4 L/mol.
Ilustrasi perbedaan wujud zat ini bisa dibayangkan seperti ini: Untuk padatan seperti Cu dan MgO, partikel-partikelnya rapat dan terikat kuat. Massa mereka mudah dihitung dari mol, tetapi volumenya bergantung pada bagaimana atom-atom itu dikemas dalam ruang (struktur kristal). Sementara untuk gas seperti O₂, partikelnya bergerak bebas dan sangat berjauhan. Mereka memenuhi seluruh wadah, sehingga hubungan antara jumlah partikel (mol) dengan volume yang ditempati menjadi sangat teratur dan dapat diprediksi dengan hukum gas ideal.
Dua dunia yang berbeda, disatukan oleh konsep mol yang elegan.
Penutup
Jadi, begitulah ceritanya. Dari 2 mol yang sama, kita dapatkan tiga narasi yang berbeda: tembaga dengan partikel atom tunggalnya, magnesium oksida dengan ikatan ioniknya, dan oksigen dengan molekul diatomiknya. Perhitungan ini bukan akhir, melainkan pintu gerbang. Sekarang, coba bayangkan jika zatnya diganti dengan gula, garam, atau air. Prinsipnya tetap, langkah-langkahnya pun sama.
Pemahaman ini adalah superpower dasar dalam kimia yang memampukan kita untuk memprediksi, merancang, dan menjelaskan begitu banyak hal di lab maupun di dapur. Selamat, sekarang kita sudah punya alat untuk ‘berbicara’ dengan bahasa atom.
FAQ Lengkap
Apakah volume 2 mol Cu dan MgO bisa dihitung seperti gas O₂?
Tidak bisa. Volume gas pada kondisi tertentu (seperti STP) bisa diestimasi karena partikel gas bergerak bebas dan memenuhi ruang. Cu dan MgO adalah zat padat, volumenya bergantung pada kerapatan (massa jenis) masing-masing, bukan pada jumlah molnya secara langsung. Untuk menghitung volume padatan, kita butuh data massa jenisnya.
Mengapa massa 2 mol O₂ lebih ringan dari 2 mol MgO padahal sama-sama mengandung oksigen?
Karena massa molar zat ditentukan oleh massa atom penyusunnya. MgO tersusun dari atom magnesium (Ar ~24) dan oksigen (Ar ~16), total ~40 g/mol. O₂ tersusun dari dua atom oksigen, total ~32 g/mol. Jadi, meski jumlah ‘paket’ (mol) sama, ‘berat’ setiap paketnya berbeda.
Bagaimana jika perhitungan dilakukan bukan pada kondisi STP (0°C, 1 atm)?
Volume gas akan berubah. Hubungan 1 mol = 22.4 L hanya berlaku di STP. Pada suhu dan tekanan lain, kita harus menggunakan Hukum Gas Ideal (PV = nRT) atau hukum gas lain (Boyle, Charles) untuk menghitung volume gas.
Apakah bilangan Avogadro (6.022 x 10²³) selalu tetap untuk setiap zat?
Ya, bilangan Avogadro adalah konstanta universal. Itu adalah jumlah partikel (atom, molekul, ion, dll.) dalam satu mol zat apa pun, mirip seperti satu lusin selalu berarti 12 buah, baik untuk telur, pensil, atau buku.