Kalor yang Diperlukan untuk Menaikkan Suhu Benda itu seperti rahasia di balik kenapa panci cepat panas sementara air di dalamnya masih sabar menunggu. Topik yang terdengar teknis ini sebenarnya adalah cerita sehari-hari, tentang bagaimana energi panas bersahabat atau berantem dengan material di sekitar kita, mulai dari secangkir kopi pagi hingga mesin mobil yang overheat. Memahaminya bukan cuma urusan lab fisika, tapi juga kunci untuk membuat hidup lebih efisien dan nyaman.
Pada dasarnya, setiap benda punya ‘selera’ dan ‘kapasitas’ yang berbeda-beda dalam menerima panas. Jumlah energi panas alias kalor yang harus kita berikan untuk menaikkan suhu suatu benda tidaklah sembarangan; ia diatur oleh massa benda, jenis bahannya, dan seberapa besar kenaikan suhu yang kita inginkan. Prinsip inilah yang kemudian dirumuskan secara elegan dalam persamaan Q = m.c.ΔT, sebuah rumus sederhana yang menjelaskan begitu banyak fenomena di dunia.
Konsep Dasar Kalor dan Suhu
Pernahkah kamu memegang sendok logam yang baru saja dicelupkan ke dalam secangkir kopi panas? Sendok itu terasa hangat, bukan? Atau, saat kamu memanaskan air untuk mi instan, butuh waktu beberapa menit sebelum air itu benar-benar mendidih. Fenomena sehari-hari ini adalah pintu masuk terbaik untuk memahami hubungan antara kalor dan suhu, dua konsep yang sering tertukar tetapi memiliki makna yang sangat berbeda.
Secara fundamental, suhu adalah ukuran rata-rata energi kinetik partikel dalam suatu benda. Semakin tinggi suhu, semakin cepat dan aktif gerakan partikel-partikelnya. Sementara itu, kalor adalah bentuk energi yang berpindah dari benda bersuhu tinggi ke benda bersuhu rendah. Jadi, kalor adalah “utusan” yang membawa energi, sedangkan suhu adalah “laporan” tentang kondisi energi dalam benda tersebut. Penambahan kalor akan meningkatkan energi partikel, yang kemudian terukur sebagai kenaikan suhu.
Perbandingan Mendalam Kalor dan Suhu
Untuk memperjelas perbedaan keduanya, tabel berikut merangkum poin-poin kunci dari segi definisi, satuan, sifat, dan alat ukurnya.
| Aspek | Kalor | Suhu |
|---|---|---|
| Definisi | Energi yang berpindah akibat perbedaan suhu. | Ukuran rata-rata energi kinetik partikel dalam suatu zat. |
| Satuan | Joule (J) atau kalori (kal). 1 kal = 4.184 J. | Kelvin (K), Celcius (°C), atau Fahrenheit (°F). |
| Sifat | Bergantung pada massa, jenis zat, dan perubahan suhu. Merupakan besaran ekstensif. | Tidak bergantung pada massa atau jumlah zat. Merupakan besaran intensif. |
| Alat Ukur | Kalorimeter. | Termometer. |
Contoh sederhana dalam kehidupan adalah saat kamu menjemur pakaian basah di bawah terik matahari. Energi kalor dari sinar matahari diserap oleh air pada pakaian. Penyerapan energi ini menyebabkan molekul air bergerak lebih cepat hingga akhirnya terlepas dari kain sebagai uap air. Proses ini jelas menunjukkan penambahan kalor yang menyebabkan kenaikan suhu dan perubahan wujud.
Faktor Penentu Besarnya Kalor
Mengapa memanaskan sepanci penuh air membutuhkan waktu lebih lama dan energi listrik lebih besar daripada memanaskan secangkir air? Jawabannya terletak pada faktor-faktor yang menentukan besarnya kalor yang diperlukan. Jumlah kalor (Q) untuk menaikkan suhu suatu benda tidak sembarangan; ia diatur oleh beberapa variabel yang bisa kita prediksi dan hitung.
Secara umum, ada tiga faktor utama: massa benda (m), jenis bahan atau zat penyusun benda tersebut (yang direpresentasikan oleh kalor jenis, c), dan besarnya kenaikan suhu yang ingin dicapai (ΔT). Hubungan ini dirumuskan dalam persamaan yang elegan: Q = m × c × ΔT. Selain itu, terdapat konsep kapasitas kalor (C) yang merupakan gabungan dari massa dan kalor jenis (C = m × c), mewakili jumlah kalor yang dibutuhkan untuk menaikkan suhu seluruh benda sebesar 1°C.
Analisis Pengaruh Setiap Faktor
Mari kita uraikan pengaruh masing-masing faktor melalui tabel berikut, dilengkapi dengan ilustrasi bagaimana perubahan pada setiap variabel mempengaruhi kebutuhan kalor.
| Faktor | Deskripsi Pengaruh | Analog Sederhana | Contoh Numerik |
|---|---|---|---|
| Massa (m) | Semakin besar massa benda, semakin banyak partikel yang perlu dinaikkan energinya, sehingga kalor yang diperlukan lebih besar (hubungan linear). | Mengisi bak mandi membutuhkan air lebih banyak daripada mengisi gelas. | Memanaikan 2 kg air (dari 30°C ke 90°C) butuh kalor 2x lipat dari memanaskan 1 kg air dengan kenaikan suhu yang sama. |
| Jenis Zat/Kalor Jenis (c) | Setiap zat memiliki kemampuan menyerap kalor yang berbeda. Kalor jenis tinggi berarti zat butuh kalor lebih banyak untuk kenaikan suhu yang sama. | Memanaskan pasir di pantai lebih cepat panas daripada memanaskan air laut dengan massa yang sama. | Memanaskan 1 kg besi (c=450 J/kg°C) hingga naik 50°C butuh kalor lebih sedikit daripada 1 kg air (c=4200 J/kg°C) dengan kenaikan suhu sama. |
| Kenaikan Suhu (ΔT) | Semakin tinggi kenaikan suhu yang diinginkan, semakin besar kalor yang harus disuplai (hubungan linear). | Mendorong mobil dari diam sampai 10 km/jam butuh usaha, sampai 50 km/jah butuh usaha lebih besar. | Memanaskan air dari 20°C ke 100°C (ΔT=80°C) butuh kalor 4x lipat dari memanaskannya dari 20°C ke 40°C (ΔT=20°C). |
| Kapasitas Kalor (C) | Merupakan produk m × c. Menyatakan “ketahanan” suatu benda spesifik terhadap perubahan suhu. C besar berarti benda sulit dipanaskan. | Sebuah batu besar (C besar) butuh waktu lama untuk menghangat di siang hari dan lama pula untuk mendingin di malam hari. | Sebuah teko berisi 2 kg air (C=8400 J/°C) butuh kalor 8400 J untuk suhunya naik 1°C, jauh lebih besar dari sebuah paku besi 0.01 kg (C=4.5 J/°C). |
Rumus dan Perhitungan Kalor
Setelah memahami faktor-faktor penentunya, kini saatnya kita masuk ke dapur utama: rumus perhitungan. Rumus ini bukan sekadar huruf dan angka di buku, tapi alat praktis yang bisa menjelaskan banyak hal di sekitar kita, dari desain radiator mobil hingga takaran memasak.
Rumus utama untuk menghitung kalor yang terlibat dalam perubahan suhu (tanpa perubahan wujud) adalah:
Q = m × c × ΔT
Dimana:
- Q adalah jumlah kalor (dalam Joule, J).
- m adalah massa benda (dalam kilogram, kg).
- c adalah kalor jenis zat (dalam J/kg°C).
- ΔT adalah perubahan suhu (dalam °C atau K), dihitung dari suhu akhir (T akhir) dikurangi suhu awal (T awal).
Prosedur Penyelesaian Soal Perhitungan
Menyelesaikan soal tentang kalor akan lebih terstruktur jika mengikuti langkah-langkah sistematis berikut:
- Identifikasi Besaran yang Diketahui dan Ditanyakan. Tuliskan semua nilai massa, kalor jenis, suhu awal, suhu akhir, dan kalor yang sudah diberikan dalam soal. Tandai apa yang ditanyakan (Q, m, c, atau ΔT).
- Pastikan Satuan Konsisten. Konversi semua satuan ke dalam sistem yang sama (biasanya SI: kg, J, °C). Massa dalam gram harus diubah ke kilogram (dibagi 1000).
- Tuliskan Rumus yang Relevan. Gunakan Q = m.c.ΔT atau variasinya jika yang dicari adalah m, c, atau ΔT.
- Substitusi Nilai. Masukkan angka-angka yang diketahui ke dalam rumus.
- Hitung dan Analisis Hasil. Lakukan perhitungan matematis. Periksa apakah hasilnya masuk akal secara logika (misalnya, kalor yang dibutuhkan seharusnya positif untuk pemanasan).
Contoh Soal dengan Berbagai Tingkat Kesulitan
Berikut adalah tiga contoh penerapan rumus, dari yang paling dasar hingga membutuhkan analisis lebih lanjut.
Contoh 1: Tingkat Dasar
Berapakah kalor yang diperlukan untuk memanaskan 0.5 kg air dari suhu 25°C menjadi 85°C? (c air = 4200 J/kg°C).
Konsep kunci: Soal ini langsung menerapkan rumus Q = m.c.ΔT dengan semua variabel diketahui. Perubahan suhu (ΔT) dihitung sebagai 85°C – 25°C = 60°C.
Contoh 2: Tingkat Menengah
Sebongkah logam bermassa 200 gram dengan kalor jenis 500 J/kg°C menyerap kalor sebesar 10.000 Joule. Jika suhu awalnya 30°C, berapakah suhu akhir logam tersebut?
Konsep kunci: Soal ini meminta kita mencari suhu akhir (Takhir), yang berarti kita harus memanipulasi rumus. Dari Q = m.c.(T akhirT awal), kita cari T akhir = (Q / (m.c)) + T awal. Perhatikan konversi massa dari gram ke kilogram (0.2 kg).
Contoh 3: Tingkat Lanjut (Percampuran)
Sebanyak 100 gram air panas bersuhu 90°C dicampur dengan 200 gram air dingin bersuhu 20°C di dalam sebuah wadah terisolasi. Dengan mengabaikan pertukaran kalor dengan lingkungan, tentukan suhu akhir campuran. (c air = 4200 J/kg°C).
Dalam fisika, kalor yang diperlukan untuk menaikkan suhu benda bergantung pada massa, jenis bahan, dan kenaikan suhunya. Prinsip ini, mirip dengan proses adaptasi sosial, membutuhkan ‘energi’ interaksi yang tepat agar perubahan terjadi. Seperti halnya upaya Bentuk Sosialisasi Khanza pada Kegiatan Orientasi Siswa SMA yang dirancang untuk ‘memanaskan’ suasana dan mempercepat integrasi. Pada akhirnya, baik dalam termodinamika maupun sosialisasi, kuantitas dan kualitas ‘panas’ yang diberikan menentukan seberapa efektif target suhu—atau keakraban—tercapai.
Konsep kunci: Soal ini menerapkan Asas Black, yaitu kalor yang dilepas oleh zat bersuhu tinggi sama dengan kalor yang diserap oleh zat bersuhu rendah (Qlepas = Q terima). Rumusnya menjadi m panas.c.(90 – T c) = m dingin.c.(T c20). Kalor jenis (c) dapat dicoret karena sama, menyederhanakan perhitungan.
Kapasitas Kalor dan Kalor Jenis: Kalor Yang Diperlukan Untuk Menaikkan Suhu Benda
Dalam pembahasan sebelumnya, kita sering menyebut kalor jenis (c) dan kapasitas kalor (C). Keduanya terdengar mirip, tetapi menyasar objek yang berbeda. Memahami perbedaannya ibarat membedakan “harga per kilogram” dengan “total belanjaan”.
Kalor jenis (c) adalah sifat intrinsik suatu material. Ia menyatakan berapa Joule energi yang dibutuhkan untuk menaikkan suhu satu kilogram zat tersebut sebesar satu derajat Celcius. Sementara itu, Kapasitas Kalor (C) adalah sifat dari sebuah benda spesifik (dengan massa tertentu). Ia menyatakan berapa Joule energi yang dibutuhkan untuk menaikkan suhu seluruh benda itu sebesar satu derajat Celcius. Hubungannya sederhana: C = m × c.
Nah, konsep kalor yang diperlukan untuk menaikkan suhu benda itu sebenarnya punya rumus pasti, Q = m.c.ΔT. Tapi, kalau kamu masih bingung dengan penerapan rumusnya dalam soal, coba deh lihat pembahasan detail yang ada di Mohon dijawab dengan cara, terima kasih. Dengan memahami langkah-langkahnya, perhitungan kalor jenis atau massa benda jadi lebih mudah dikuasai, dan kamu bisa mengaplikasikannya ke berbagai kasus fisika sehari-hari.
Jadi, kalor jenis adalah “harga per kilo”, sedangkan kapasitas kalor adalah “total harga untuk sekarung beras yang kamu beli”.
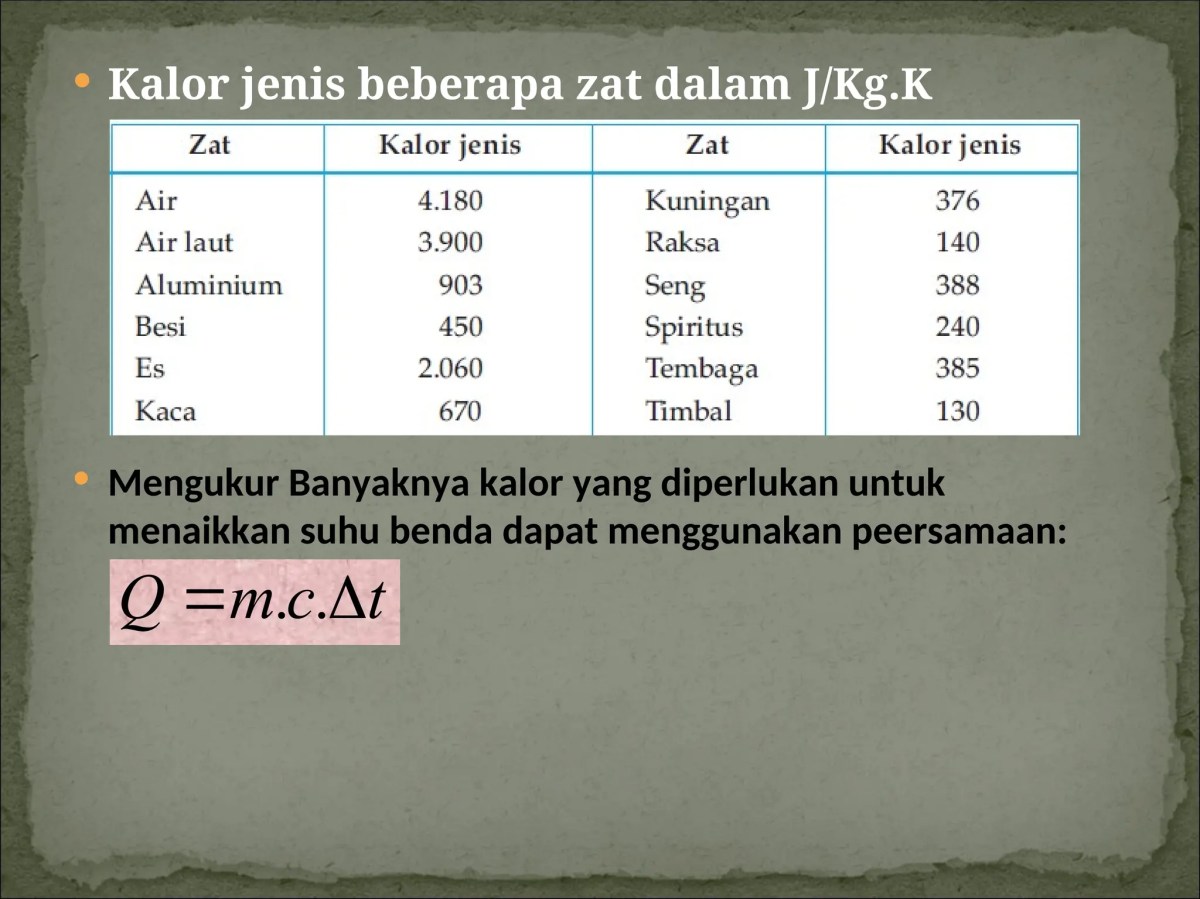
Kalor Jenis Berbagai Zat Umum
Nilai kalor jenis berbagai zat telah ditentukan melalui eksperimen. Tabel berikut menunjukkan betapa beragamnya kemampuan zat menyerap kalor.
| Zat | Kalor Jenis (c) dalam J/kg°C | Karakteristik | Aplikasi Terkait |
|---|---|---|---|
| Air | ≈ 4200 | Sangat tinggi | Pendingin mesin, media penyimpan panas. |
| Aluminium | ≈ 900 | Tinggi untuk logam | Panci masak, sirip radiator (melepas panas cepat). |
| Besi/Baja | ≈ 450 | Menengah | Setrika, kompor, struktur bangunan. |
| Tembaga | ≈ 390 | Rendah untuk logam | Bagian dasar panci, kabel listrik (konduktor panas baik). |
| Kayu (sekitar) | ≈ 1700 | Cukup tinggi | Pegangan panci, perabot (terasa tidak cepat panas). |
Nilai kalor jenis air yang sangat tinggi (4200 J/kg°C) adalah anomali yang sangat beruntung bagi kehidupan di Bumi. Artinya, air membutuhkan energi yang sangat besar untuk dinaikkan suhunya, dan juga melepaskan energi sangat besar saat mendingin. Implikasinya sangat luas: air laut bertindak sebagai “bank panas” raksasa yang memoderasi iklim pantai, membuat daerah pesisir tidak terlalu ekstrem suhunya dibanding daratan. Dalam teknologi, air digunakan sebagai cairan pendingin yang efektif di radiator mobil atau sistem pembangkit listrik karena kemampuannya yang besar dalam mengangkut panas tanpa kenaikan suhu yang drastis.
Aplikasi dalam Kehidupan dan Teknologi
Prinsip bahwa kalor menaikkan suhu bukan hanya teori di laboratorium. Ia adalah bintang tamu di dapur kita, pengatur suhu di rumah, dan bahkan aktor utama dalam pola cuaca bumi. Dari yang sederhana hingga kompleks, pemahaman ini dimanfaatkan untuk menciptakan kenyamanan dan efisiensi.
Peralatan rumah tangga seperti setrika listrik, ketel listrik, dan pemanas air adalah contoh paling gamblang. Setrika mengubah energi listrik menjadi kalor pada elemen pemanasnya (biasanya dari paduan nikel-krom). Kalor ini kemudian dihantarkan ke plat besi setrika yang memiliki kapasitas kalor cukup besar untuk menyimpan panas, sehingga dapat meratakan kain. Ketel listrik bekerja lebih langsung: elemen pemanasnya dicelupkan ke dalam air, memindahkan kalor secara konduksi dan konveksi hingga air mencapai titik didih.
Efisiensi peralatan ini sangat bergantung pada bagaimana materialnya dirancang untuk mengelola kalor.
Desain Material pada Peralatan Masak
Ambil contoh sebuah panci masak modern. Desainnya sering kali merupakan rekayasa material yang cerdas. Bagian dasarnya biasanya terbuat dari bahan berkonduktivitas termal tinggi seperti aluminium atau tembaga. Logam-logam ini memiliki kalor jenis yang relatif rendah, sehingga cepat merespons panas dari kompor dan mendistribusikannya secara merata ke seluruh dasar panci, menghindari titik panas (hot spot) yang bisa membakar makanan.
Namun, aluminium atau tembaga murni terlalu lunak dan bisa bereaksi dengan makanan. Maka, bagian dalam panci dan bagian luarnya dilapisi dengan stainless steel yang lebih inert dan kuat. Untuk mengoptimalkan lagi, banyak panci premium menggunakan konstruksi berlapis (sandwich) dimana lapisan aluminium ditempelkan di antara dua lapisan stainless steel. Hasilnya adalah panci dengan distribusi panas yang sangat merata (berkat aluminium) namun permukaan yang awet dan aman (berkat stainless steel).
Pegangan panci, di sisi lain, sengaja dibuat dari material dengan konduktivitas termal rendah seperti kayu atau plastik, yang memiliki kalor jenis cukup tinggi sehingga butuh waktu lama untuk menjadi panas, melindungi tangan pengguna.
Fenomena Alam Skala Besar, Kalor yang Diperlukan untuk Menaikkan Suhu Benda
Source: slidesharecdn.com
Prinsip yang sama bekerja dalam skala yang monumental. Fenomena alam yang disebut thermal inertia atau inersia termal dari air laut adalah pengatur iklim pesisir. Dibandingkan daratan (tanah, pasir, batu), air laut memiliki kalor jenis yang jauh lebih tinggi. Artinya, di siang hari atau musim panas, daratan memanas dengan cepat sementara lautan menyerap kalor dalam jumlah sangat besar dengan kenaikan suhu yang perlahan.
Di malam hari atau musim dingin, daratan cepat mendingin, sedangkan lautan melepaskan kalor yang disimpannya secara perlahan.
Inilah sebabnya daerah pantai memiliki iklim yang lebih moderat: lebih sejuk di siang hari yang terik dan lebih hangat di malam hari yang dingin dibandingkan daerah pedalaman. Proses penyerapan dan pelepasan kalor secara masif oleh lautan ini juga menjadi penggerak utama sirkulasi atmosfer dan arus laut global, yang pada akhirnya mendistribusikan panas dari daerah khatulistiwa ke kutub, membentuk pola cuaca dan iklim planet kita.
Terakhir
Jadi, begitulah ceritanya. Konsep kalor untuk menaikkan suhu ternyata adalah bahasa universal yang menjelaskan interaksi energi dengan materi di sekeliling kita. Dari rumus yang terlihat sederhana itu, kita bisa merancang teknologi yang lebih hemat energi, memahami pola cuaca, hingga sekadar memasak telor mata sapi dengan tingkat kematangan yang pas. Pengetahuan ini mengajarkan bahwa di balik setiap perubahan suhu, ada dialog yang kompleks antara kalor, massa, dan sifat zat—dialog yang, ketika kita pahami, membuat kita sedikit lebih cerdas dalam menjalani hari.
FAQ Terperinci
Apakah kalor sama dengan suhu?
Tidak. Suhu adalah ukuran panas dinginnya suatu benda, sementara kalor adalah jumlah energi panas yang dipindahkan. Analoginya, suhu seperti level air dalam ember, sedangkan kalor adalah jumlah air yang dituangkan ke dalamnya.
Mengapa rumus Q = m.c.ΔT tidak berlaku saat terjadi perubahan wujud?
Karena rumus tersebut khusus untuk menaikkan suhu tanpa mengubah wujud zat. Saat perubahan wujud (misalnya es mencair), kalor yang diserap digunakan untuk memutus ikatan molekul, bukan menaikkan suhu, sehingga dihitung dengan rumus kalor laten (Q = m.L).
Bagaimana cara cepat menentukan zat mana yang lebih cepat panas berdasarkan kalor jenisnya?
Semakin rendah nilai kalor jenis (c) suatu zat, semakin cepat zat tersebut panas dengan jumlah kalor yang sama. Itulah sebabnya logam seperti aluminium (c tinggi) untuk panci lebih lambat panas dibanding wajan besi (c lebih rendah), meski faktornya juga melibatkan konduktivitas termal.
Apakah mungkin kalor ditambahkan tetapi suhu tidak naik?
Ya, sangat mungkin. Fenomena ini terjadi tepat saat zat sedang mengalami perubahan wujud, misalnya air mendidih menjadi uap. Selama proses mendidih, kalor terus ditambahkan tetapi suhu air tetap stabil di 100°C (pada tekanan normal).