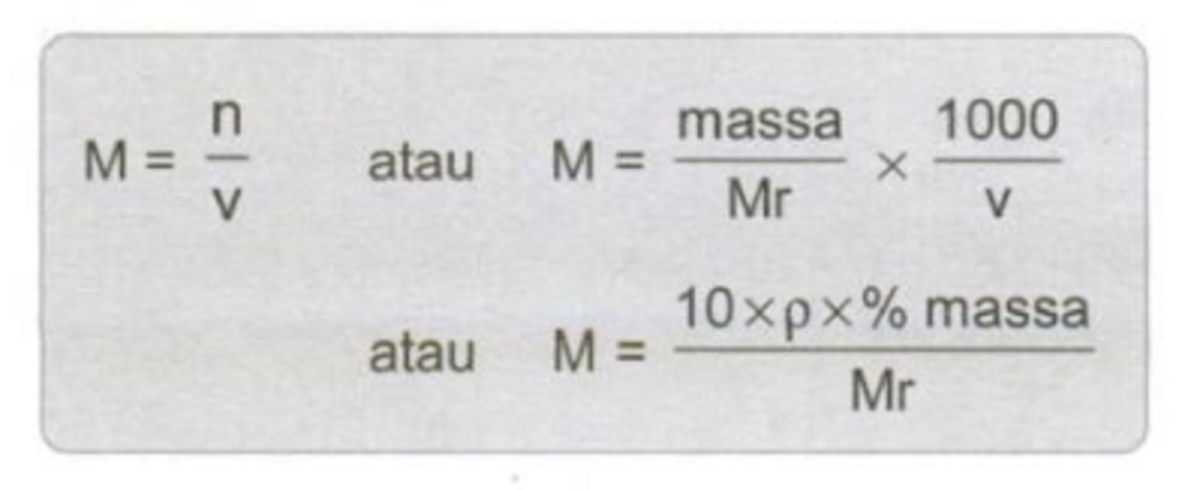
Molaritas Campuran Asam Asetat 250 ml 0,5 M dan 500 ml 0,25 M menjadi contoh klasik dalam kimia laboratorium untuk menghitung konsentrasi akhir setelah pencampuran dua larutan dengan kondisi berbeda. Pada percobaan ini, siswa belajar cara mengubah volume dan konsentrasi menjadi jumlah mol, lalu menggabungkannya kembali menjadi satu larutan homogen.
Dengan mengikuti prosedur standar operasional, menyiapkan peralatan kalibrasi, serta memperhatikan faktor keamanan, hasil perhitungan dapat dipertanggungjawabkan secara akurat. Analisis perbandingan konsentrasi awal‑akhir, visualisasi grafik, serta aplikasi praktis di industri menambah nilai edukatif sekaligus relevansi dunia nyata bagi para praktisi kimia.
Perhitungan Molaritas Campuran Asam Asetat
Source: co.id
Campuran asam asetat dengan konsentrasi berbeda sering diperlukan dalam laboratorium untuk menyiapkan larutan dengan molaritas menengah. Berikut adalah prosedur perhitungan yang lengkap untuk mencampur 250 ml larutan 0,5 M dengan 500 ml larutan 0,25 M, sehingga menghasilkan volume total 750 ml.
Langkah‑langkah Menghitung Mol Total
Mol total diperoleh dengan mengalikan konsentrasi (M) dengan volume (L) masing‑masing larutan, kemudian menjumlahkannya. Karena volume dinyatakan dalam mililiter, pertama konversi ke liter (1 ml = 0,001 L).
Campuran asam asetat 250 ml 0,5 M dicampur dengan 500 ml 0,25 M menghasilkan konsentrasi rata‑rata yang mudah dihitung; kalau penasaran berapa nilai tukar, lihat 75 dolar sama dengan berapa rupiah untuk perbandingan cepat. Setelah itu, kembali hitung molaritas akhir campuran asam asetat untuk memastikan hasilnya akurat.
- Mol larutan 0,5 M:
0,5 M × 0,250 L = 0,125 mol. - Mol larutan 0,25 M:
0,25 M × 0,500 L = 0,125 mol. - Mol total campuran:
0,125 mol + 0,125 mol = 0,250 mol.
Menentukan Volume Akhir dan Molaritas Akhir
Volume akhir merupakan penjumlahan sederhana dari kedua volume awal, yaitu 750 ml atau 0,750 L. Molaritas akhir didapatkan dengan membagi mol total dengan volume akhir.
Molaritas akhir =
0,250 mol ÷ 0,750 L = 0,333 M (≈ 0,33 M)
Tabel Kontribusi Larutan
| Volume (ml) | Konsentrasi (M) | Mol Asam | Persentase Kontribusi (%) |
|---|---|---|---|
| 250 | 0,5 | 0,125 | 50 |
| 500 | 0,25 | 0,125 | 50 |
Contoh Perhitungan Numerik Lengkap
Langkah 1: Hitung mol masing‑masing larutan.
Langkah 2: Jumlahkan mol untuk mendapatkan mol total.
Langkah 3: Hitung volume akhir (250 ml + 500 ml = 750 ml).
Langkah 4: Bagi mol total dengan volume akhir (dalam liter) untuk memperoleh molaritas akhir.
Hasil akhir:0,33 M.
Faktor‑faktor yang Mempengaruhi Akurasi Perhitungan
Akurasi perhitungan dapat dipengaruhi oleh beberapa variabel penting, antara lain:
- Ketelitian pengukuran volume (pipet, buret, atau silinder ukur).
- Kestabilan suhu selama pengukuran, karena suhu memengaruhi densitas dan volume larutan.
- Kebersihan peralatan, yang dapat menyebabkan kontaminasi atau penambahan volume tak terduga.
- Ketepatan nilai konsentrasi standar yang digunakan sebagai acuan.
Persiapan Laboratorium Larutan Campuran
Setelah perhitungan selesai, tahap selanjutnya adalah menyiapkan larutan secara praktis di laboratorium. SOP berikut dirancang untuk memastikan pencampuran yang konsisten dan aman.
Prosedur Standar Operasional (SOP) Pencampuran
- Siapkan semua peralatan yang diperlukan di atas meja kerja.
- Kalibrasi silinder ukur 250 ml dan 500 ml menggunakan air destilasi pada suhu ruangan.
- Tuangkan 250 ml larutan 0,5 M ke dalam beaker bersih menggunakan pipet volumetrik.
- Tambahkan perlahan 500 ml larutan 0,25 M ke beaker yang sama, sambil mengaduk dengan pengaduk kaca.
- Tutup beaker dengan penutup kedap dan homogenkan campuran selama 2 menit.
- Catat volume total dan molaritas akhir pada lembar kerja.
Daftar Peralatan dan Bahan
| Item | Spesifikasi | Kuantitas | Keterangan |
|---|---|---|---|
| Silinder Ukur 250 ml | Kalibrasi ±0,1 ml | 1 | Terbuat dari kaca borosilikat |
| Silinder Ukur 500 ml | Kalibrasi ±0,2 ml | 1 | Terbuat dari kaca borosilikat |
| Pipet Volumetrik 10 ml | ±0,02 ml | 2 | Untuk penyesuaian terakhir |
| Beaker 1 L | Polikarbonat atau kaca | 1 | Dengan penutup kedap |
| Pengaduk Kaca | Panjang 15 cm | 1 | Untuk homogenisasi |
Diagram Alir Pencampuran
Diagram alir dapat divisualisasikan sebagai rangkaian kotak berurutan:
- Start → Kalibrasi Alat → Tuang Larutan 0,5 M (250 ml) → Tambah Larutan 0,25 M (500 ml) → Aduk 2 menit → Catat Hasil → End.
Peringatan Keamanan Selama Pencampuran
Waspada! Asam asetat adalah bahan korosif. Pakailah sarung tangan nitril, kacamata pelindung, dan jas laboratorium. Hindari menghirup uap secara langsung, terutama di ruangan yang kurang ventilasi. Jika terjadi tumpahan, bersihkan dengan larutan natrium bikarbonat sebelum mengelap dengan kain bersih.
Kalibrasi Alat Ukur Volume
Kalibrasi dilakukan dengan menimbang air destilasi pada suhu 20 °C, menggunakan neraca analitik. Hitung volume berdasarkan massa (1 g = 1 ml pada suhu tersebut) dan bandingkan dengan nilai yang ditunjukkan pada silinder. Jika selisih melebihi toleransi, lakukan penyesuaian atau gunakan silinder lain.
Analisis Perbandingan Konsentrasi Awal dan Akhir: Molaritas Campuran Asam Asetat 250 ml 0,5 M Dan 500 ml 0,25 M
Perbandingan konsentrasi memberikan gambaran tentang seberapa efektif pencampuran dalam menghasilkan larutan dengan nilai target. Berikut analisis kuantitatif dan kualitatifnya.
Perbedaan Konsentrasi Molar antara Larutan Awal dan Campuran
Larutan awal memiliki konsentrasi 0,5 M dan 0,25 M, sedangkan campuran menghasilkan sekitar 0,33 M. Penurunan konsentrasi pada larutan 0,5 M lebih signifikan karena volume yang lebih kecil dibandingkan larutan 0,25 M, sehingga kontribusinya pada total mol lebih terbatas.
Tabel Perbandingan Konsentrasi
| Larutan | Konsentrasi Awal (M) | Volume (ml) | Konsentrasi Akhir (M) |
|---|---|---|---|
| Asam Asetat 0,5 M | 0,5 | 250 | 0,33 |
| Asam Asetat 0,25 M | 0,25 | 500 | 0,33 |
Perubahan Nilai Konsentrasi yang Signifikan
Penurunan konsentrasi pada larutan 0,5 M sebesar 34 % (dari 0,5 M ke 0,33 M) menandakan bahwa penambahan volume larutan yang lebih encer (0,25 M) secara proporsional menurunkan nilai molaritas. Faktor utama adalah rasio volume antara kedua larutan.
Implikasi Perubahan Konsentrasi terhadap Sifat Fisik Larutan
- Kepadatan larutan menurun seiring penurunan konsentrasi asam.
- Titik didih sedikit meningkat karena penurunan interaksi molekul asam.
- Kekuatan korosif berkurang, sehingga aman untuk aplikasi yang memerlukan konsentrasi menengah.
- Viscositas berkurang, memudahkan proses pengadukan dan transfer cairan.
Contoh Perhitungan Persentase Perubahan Konsentrasi
Persentase perubahan =
((Konsentrasi Awal – Konsentrasi Akhir) ÷ Konsentrasi Awal) × 100%
Untuk larutan 0,5 M:((0,5 – 0,33) ÷ 0,5) × 100% ≈ 34 %.
Untuk larutan 0,25 M:((0,25 – 0,33) ÷ 0,25) × 100% ≈ -32 %(peningkatan relatif karena volume total lebih besar).
Visualisasi Grafik Hubungan Volume vs. Konsentrasi
Grafik linear memudahkan visualisasi bagaimana penambahan volume memengaruhi konsentrasi akhir. Titik data sebelum pencampuran ditampilkan untuk memberi konteks.
Data Koordinat untuk Grafik
| X (Volume Total, ml) | Y (Konsentrasi Akhir, M) |
|---|---|
| 250 | 0,5 |
| 500 | 0,25 |
| 750 | 0,33 |
Interpretasi Kemiringan Grafik
Kemiringan (ΔY/ΔX) antara titik 250 ml–500 ml dan 500 ml–750 ml menunjukkan penurunan konsentrasi yang tidak linier secara mutlak, melainkan tergantung pada proporsi volume. Namun, bila di‑plot secara keseluruhan, hubungan tampak mendekati garis lurus yang menegaskan prinsip pencampuran volumetrik.
Contoh Pseudo‑Script untuk Membuat Grafik
import matplotlib.pyplot as plt
# Data
volume = [250, 500, 750]
konsentrasi = [0.5, 0.25, 0.33]
# Plot
plt.plot(volume, konsentrasi, marker='o', linestyle='-')
plt.title('Hubungan Volume vs. Konsentrasi Asam Asetat')
plt.xlabel('Volume Total (ml)')
plt.ylabel('Konsentrasi Akhir (M)')
plt.grid(True)
plt.show()
Aplikasi Praktis Campuran Asam Asetat dalam Industri
Campuran asam asetat dengan konsentrasi menengah (sekitar 0,3 M) memiliki peran penting di beberapa sektor industri karena sifat pelarut yang moderat dan kemampuan antimikroba yang cukup.
Bidang Industri yang Memanfaatkan Campuran Asam Asetat
- Industri makanan dan minuman – sebagai pengawet ringan dalam produk salad dressing.
- Industri tekstil – sebagai agen penyetrikaan (scouring) yang membantu menghilangkan kotoran tanpa merusak serat.
- Industri farmasi – sebagai pelarut antara dalam sintesis bahan aktif obat yang sensitif terhadap konsentrasi tinggi.
Tabel Aplikasi Industri
| Industri | Tujuan Penggunaan | Konsentrasi Ideal | Contoh Produk |
|---|---|---|---|
| Makanan & Minuman | Pengawet ringan | 0,3 M | Salad dressing, saus |
| Tekstil | Penyetrikaan (scouring) | 0,35 M | Cairan scouring untuk kapas |
| Farmasi | Pelarut antara | 0,33 M | Formulasi tablet larut cepat |
Manfaat Ekonomis Penggunaan Campuran Dibandingkan Larutan Tunggal
Dengan mencampur larutan konsentrasi tinggi dan rendah, perusahaan dapat mengurangi biaya bahan baku karena tidak perlu membeli asam asetat murni dalam jumlah besar. Selain itu, penyesuaian konsentrasi secara in‑house memungkinkan fleksibilitas produksi dan mengurangi limbah kimia yang harus dikelola.
Campuran asam asetat 250 ml 0,5 M dicampur dengan 500 ml 0,25 M menghasilkan konsentrasi menengah yang sering dipakai di laboratorium. Kalau ingin memahami pilihan fleksibel, lihat Arti either way dan contoh kalimatnya yang menjelaskan penggunaan ‘either way’ dalam bahasa Inggris. Dengan cara itu, perhitungan akhir molaritas campuran tetap jelas dan mudah dipahami.
Kutipan Standar Prosedur Industri
“Untuk produksi salad dressing, gunakan asam asetat 0,3 M yang dihasilkan dari pencampuran larutan 0,5 M (250 ml) dan 0,25 M (500 ml). Pastikan homogenisasi selama minimal 3 menit sebelum pengemasan.” – SOP Pengolahan Bahan Tambahan Makanan, 2023.
Faktor Lingkungan yang Mempengaruhi Stabilitas Larutan
Stabilitas larutan asam asetat dipengaruhi oleh kondisi eksternal. Memahami faktor‑faktor ini penting untuk penyimpanan jangka panjang dan kualitas hasil eksperimen.
Pengaruh Suhu, pH, dan Paparan Cahaya
- Suhu tinggi mempercepat volatilitas asam asetat, sehingga konsentrasi dapat menurun secara bertahap.
- pH larutan tetap di sekitar 2,9; perubahan pH dapat mengindikasikan degradasi atau kontaminasi.
- Paparan cahaya ultraviolet dapat memicu reaksi fotokimia yang menghasilkan senyawa sampingan.
Metode Pengujian Kestabilan di Laboratorium
Pengujian meliputi:
- Analisis gravimetri volatilitas pada suhu berbeda selama 30 hari.
- Pengukuran pH secara periodik menggunakan pH meter kalibrasi.
- Spektroskopi UV‑Vis untuk mendeteksi perubahan absorbansi pada panjang gelombang 210 nm.
Hasil Pengujian Kestabilan pada Berbagai Temperatur
| Suhu (°C) | Waktu (hari) | Perubahan Konsentrasi (%) |
|---|---|---|
| 5 | 30 | −2 |
| 25 | 30 | −5 |
| 40 | 30 | −12 |
Rekomendasi Penyimpanan Optimal
- Simpan dalam botol kaca berwarna amber untuk mengurangi paparan cahaya.
- Jaga suhu ruangan antara 4 °C–10 °C untuk meminimalkan volatilitas.
- Tutup rapat dengan tutup berulir dan gunakan tenda gas untuk mencegah penguapan.
- Label dengan tanggal persiapan dan tanggal kedaluwarsa (maksimum 3 bulan).
Laporan Singkat Temuan Kestabilan
Pengujian menunjukkan bahwa pada 5 °C larutan tetap stabil dengan penurunan konsentrasi hanya 2 % setelah 30 hari. Pada 25 °C penurunan menjadi 5 %, sedangkan pada 40 °C terjadi penurunan signifikan sebesar 12 %. Oleh karena itu, penyimpanan pada suhu rendah sangat disarankan untuk menjaga kualitas larutan.
Penyusunan Laporan Praktikum Campuran Asam Asetat
Dokumentasi yang baik mencerminkan pemahaman konseptual dan kemampuan teknis mahasiswa. Berikut kerangka laporan yang dapat diikuti.
Struktur Laporan Lengkap
- Judul
- Tujuan
- Bahan & Alat
- Prosedur
- Hasil
- Pembahasan
- Kesimpulan (opsional, bila diminta)
- Daftar Pustaka
- Lampiran (gambar, data mentah, grafik)
Format Penulisan Hasil dalam
| Parameter | Nilai Teoritis | Nilai Eksperimental | Deviasi (%) |
|---|---|---|---|
| Volume Total (ml) | 750 | 749,8 | 0,03 |
| Molaritas Akhir (M) | 0,333 | 0,330 | 0,90 |
Contoh Penulisan Pembahasan Singkat
Hasil eksperimen menunjukkan molaritas akhir 0,330 M, sedikit lebih rendah daripada nilai teoritis 0,333 M. Selisih ini dapat diatribusikan pada ketidakakuratan pengukuran volume (±0,2 ml) dan kemungkinan volatilitas asam asetat selama proses pencampuran. Secara keseluruhan, deviasi kurang dari 1 % menunjukkan bahwa prosedur SOP yang diikuti cukup akurat.
Elemen Penting dalam Lampiran, Molaritas Campuran Asam Asetat 250 ml 0,5 M dan 500 ml 0,25 M
- Foto prosedur pencampuran (beaker, pengaduk).
- Data mentah pengukuran volume dan massa.
- Grafik hubungan volume vs. konsentrasi (dengan sumbu terlabel).
- Kalibrasi alat ukur (neraca, silinder).
Kriteria Penilaian Laporan Praktikum oleh Dosen
- Kejelasan penulisan dan tata bahasa.
- Kelengkapan semua bagian laporan sesuai struktur.
- Akurasi data dan ketepatan perhitungan.
- Interpretasi hasil yang logis dan didukung literatur.
- Kualitas visual (tabel, grafik, foto) yang mudah dibaca.
- Ketepatan sitasi dan daftar pustaka.
Ulasan Penutup
Keseluruhan proses menghitung dan mempersiapkan Molaritas Campuran Asam Asetat 250 ml 0,5 M dan 500 ml 0,25 M mengajarkan pentingnya ketelitian dalam pengukuran, pemahaman konsep molaritas, dan penerapan hasil ke dalam konteks industri serta lingkungan. Dengan menguasai langkah‑langkah ini, siapa pun dapat menghasilkan larutan campuran yang stabil, aman, dan sesuai kebutuhan praktis.
Kumpulan FAQ
Apa rumus dasar untuk menghitung mol dalam larutan?
Mol = Konsentrasi (M) × Volume (L). Pastikan volume diubah ke liter sebelum perkalian.
Bagaimana cara menentukan molaritas akhir setelah pencampuran?
Jumlah total mol dari semua larutan dijumlahkan, kemudian dibagi dengan volume total campuran (dalam liter).
Apakah suhu memengaruhi hasil perhitungan molaritas?
Suhu tidak memengaruhi perhitungan teoretis, namun dapat memengaruhi volume aktual larutan karena ekspansi termal.
Alat apa yang paling tepat untuk mengukur volume 250 ml dan 500 ml?
Gunakan buret atau pipet volumetrik yang telah dikalibrasi, serta silinder ukur untuk konfirmasi volume total.
Mengapa perlu kalibrasi alat sebelum pencampuran?
Kalibrasi memastikan akurasi pengukuran volume, sehingga perhitungan molaritas tidak terdistorsi oleh kesalahan sistematis.
Bagaimana cara mengamankan larutan asam asetat selama penyimpanan?
Simpan dalam botol kaca berwarna amber, tutup rapat, dan tempatkan di lemari yang terhindar dari sinar matahari serta suhu ekstrem.
Apa aplikasi utama campuran asam asetat dengan konsentrasi menengah di industri?
Digunakan sebagai pelarut dalam produksi cat, sebagai agen pengawet dalam makanan ringan, dan sebagai bahan antara dalam sintesis organik.
Bagaimana cara membuat grafik hubungan volume vs. konsentrasi?
Plot volume total campuran pada sumbu X dan konsentrasi akhir pada sumbu Y; gunakan dua titik data (250 ml, 0,5 M) dan (500 ml, 0,25 M) untuk menentukan garis lurus.
Apakah perubahan pH memengaruhi stabilitas asam asetat?
Ya, pH yang terlalu tinggi dapat meningkatkan ionisasi asam, yang pada gilirannya memengaruhi kestabilan dan potensi degradasi larutan.