Peran Mitosis dalam Proses Kloning Sel Somatik tuh kayak dalangnya di balik layar teknologi kloning yang keren itu, guys. Bayangin, sel kulit biasa mau diajak main jadi embrio, nah si mitosis ini yang bikin semuanya bisa jalan dengan ngopy-paste informasi genetik secara pas banget sebelum selnya dipindahin. Kalo nggak ada proses pembelahan sel yang satu ini, ya gagal total, nggak bakal ada ceritanya kloning.
Intinya, kloning sel somatik tuh ambil inti sel dari tubuh, misalnya sel kulit, terus dimasukin ke sel telur yang intinya udah dikeluarin. Nah, biar sel kulit donor tadi siap dan sehat, dia harus dibikin aktif dan membelah dulu pake mitosis. Proses inilah yang jadi fondasi biar sel hasil kloning nanti bisa berkembang jadi individu baru atau buat terapi, karena mitosis menjamin materi genetiknya tersalin dengan lengkap dan identik.
Dasar-Dasar Mitosis dan Kloning Sel Somatik
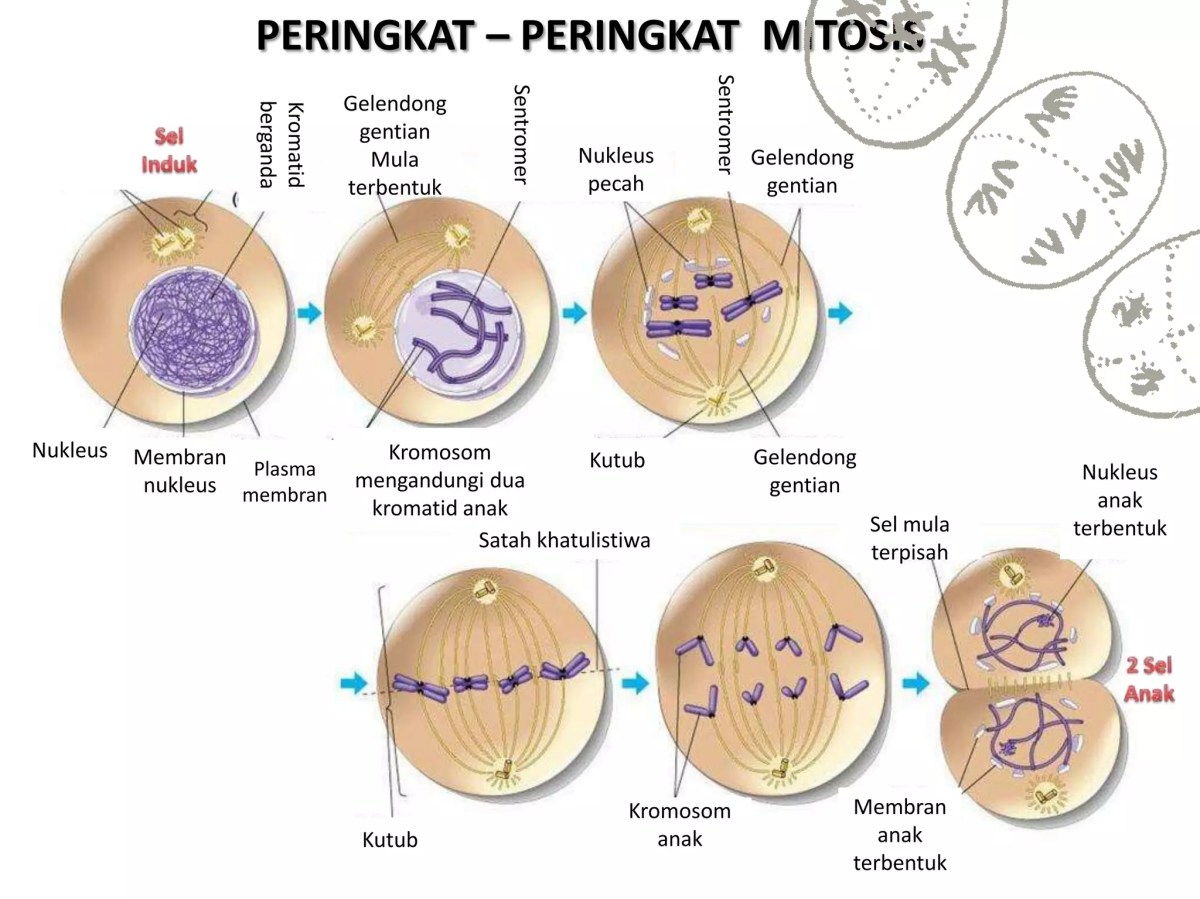
Untuk benar-benar memahami bagaimana kloning sel somatik bekerja, kita perlu masuk ke dalam dunia mikroskopis sel dan menyelami salah satu proses paling mendasar dalam kehidupan: mitosis. Bayangkan mitosis sebagai mesin fotokopi yang sangat setia di dalam sel, bertugas menduplikasi seluruh materi genetik dan kemudian membaginya secara merata ke dua sel anak yang identik. Inilah fondasi yang memungkinkan sebuah sel tunggal—yang diambil dari, katakanlah, kulit telinga seekor domba—akhirnya bisa berkembang menjadi suatu organisme utuh, seperti pada Dolly si domba.
Proses mitosis berlangsung dalam beberapa fase yang teratur. Dimulai dari profase, di mana kromosom yang berisi DNA mulai memadat dan menjadi terlihat, dan membran inti sel mulai menghilang. Fase ini krusial dalam kloning karena memastikan materi genetik donor siap untuk diduplikasi. Kemudian metafase, di mana kromosom berbaris rapi di tengah sel. Dalam konteks laboratorium, ini adalah momen pemeriksaan untuk memastikan tidak ada kesalahan penyalinan genetik.
Anafase menyusul, di saat kromatid saudara (salinan kromosom) ditarik terpisah ke kutub sel yang berlawanan. Ketepatan fase ini menentukan apakah sel anak nantinya akan menerima set kromosom yang lengkap dan identik. Terakhir, telofase, di mana dua inti sel baru terbentuk dan sitokinesis (pembelahan sitoplasma) terjadi, menghasilkan dua sel anak yang secara genetik sama persis dengan sel induk somatik donor. Setiap fase ini harus berjalan sempurna dalam kultur kloning agar sel yang dikloning dapat berkembang dengan sehat.
Perbandingan Kloning Sel Somatik dengan Jenis Kloning Lainnya
Kloning sering disalahartikan sebagai satu konsep tunggal, padahal ada beberapa jenis dengan tujuan dan metode yang sangat berbeda. Memahami perbedaan ini membantu kita melihat posisi unik kloning sel somatik, khususnya teknik SCNT.
| Aspect | Kloning Sel Somatik (SCNT) | Kloning Reproduktif | Kloning Terapeutik |
|---|---|---|---|
| Tujuan Utama | Menghasilkan embrio untuk penelitian, sel punca, atau reproduksi. | Menghasilkan individu hidup yang identik secara genetik. | Menghasilkan sel punca embrionik untuk penelitian penyakit dan terapi regeneratif. |
| Sumber Sel (Donor Inti) | Sel somatik dewasa yang terdiferensiasi (kulit, sel kumparan mamalia, dll.). | Sama dengan kloning sel somatik, biasanya untuk tujuan reproduksi. | Sel somatik pasien (untuk autolog) atau donor. |
| Sel Resipien | Sel telur yang telah di-enukleasi (intinya dikeluarkan). | Sama dengan kloning sel somatik. | Sama dengan kloning sel somatik. |
| Hasil Akhir | Blastosis (embrio awal) yang secara genetik identik dengan donor sel somatik. | Individu hidup yang lahir, identik dengan donor inti. | Garis sel punca embrionik (tidak dibiarkan berkembang menjadi janin), digunakan untuk studi atau transplantasi. |
Kesesuaian Sel Somatik sebagai Bahan Awal
Mengapa justru sel somatik, sel tubuh biasa yang sudah terspesialisasi, yang dipilih sebagai bahan awal kloning? Jawabannya terletak pada karakteristik khususnya. Pertama, sel somatik mudah diperoleh dengan risiko minimal terhadap donor, misalnya melalui biopsi kulit kecil. Kedua, setiap sel somatik mengandung cetak biru genetik lengkap (genom) dari individu donor, meskipun hanya sebagian gen yang aktif sesuai fungsinya. Ketiga, melalui teknik SCNT, inti sel somatik ini dapat “diprogram ulang” oleh sitoplasma sel telur untuk mengaktifkan kembali seluruh potensi genetiknya, mengembalikannya ke keadaan seperti zigot.
Karakteristik stabilitas genetiknya—dibandingkan dengan sel germinal—juga menjadi pertimbangan penting.
Mekanisme Inti: Transfer Inti Sel Somatik (SCNT)
Jika mitosis adalah mesin fotokopinya, maka Transfer Inti Sel Somatik (SCNT) adalah proses merakit dan menyalakan mesin itu dari nol menggunakan komponen dari dua sumber berbeda. Teknik ini adalah jantung dari kloning sel somatik, sebuah prosedur bedah mikro yang elegan dan penuh presisi.
Bagan Alur Prosedur SCNT, Peran Mitosis dalam Proses Kloning Sel Somatik
Prosedur SCNT dapat diuraikan dalam serangkaian langkah berurutan yang ketat. Bayangkan ini sebagai resep tingkat tinggi untuk menciptakan kehidupan baru dari sel yang sudah dewasa.
- Pengambilan Sel Donor: Sebuah sel somatik (misalnya, sel fibroblas dari kulit) diambil dari organisme donor yang ingin dikloning.
- Persiapan Sel Donor: Sel donor ini kemudian dikultur dalam laboratorium. Seringkali, sel ini dibuat memasuki fase diam (G0) dari siklus sel dengan membatasi nutrisinya, sebuah kondisi yang dianggap membuat materi genetiknya lebih mudah diprogram ulang.
- Pengambilan Sel Telur Resipien: Sel telur (oosit) diambil dari individu donor lain (biasanya dari spesies yang sama).
- Enukleasi: Inti sel telur yang mengandung materi genetiknya sendiri dikeluarkan secara hati-hati menggunakan mikropipet, menyisakan sel telur “kosong” yang kaya akan sitoplasma dan faktor pendukung kehidupan.
- Transfer Inti: Inti dari sel somatik donor disuntikkan atau difusikan ke dalam sel telur yang telah di-enukleasi tadi.
- Aktivasi: Sel hibrida ini distimulasi, biasanya dengan kejutan listrik atau kimia, untuk memulai pembelahan sel dan perkembangan embrio, meniru proses fertilisasi.
- Kultur Embrio: Embrio yang terbentuk kemudian dikultur dalam medium khusus hingga mencapai tahap blastosis, siap untuk ditransfer ke rahim ibu pengganti (untuk kloning reproduktif) atau digunakan untuk mengambil sel punca inner cell mass (untuk kloning terapeutik).
Peran Mitosis dalam Persiapan Sel Donor
Sebelum inti sel somatik donor diambil, sel tersebut sering kali dibiarkan membelah melalui mitosis dalam kultur. Tujuannya bukan hanya untuk memperbanyak jumlah sel, tetapi lebih penting, untuk memastikan sel donor berada dalam kondisi metabolik dan genetik yang optimal. Dengan mengontrol kondisi kultur, ilmuwan dapat mengarahkan sebagian besar sel untuk berada pada fase spesifik siklus sel (seperti G0 atau G1), di mana kromosom belum direplikasi.
Keselarasan fase ini dengan kondisi sel telur resipien sangat mempengaruhi keberhasilan penggabungan dan perkembangan selanjutnya.
Fungsi Sel Telur yang Dienukleasi
Mengapa harus sel telur yang intinya dibuang? Sel telur bukan sekadar wadah kosong. Sitoplasmanya adalah “soup ajaib” yang penuh dengan protein, RNA, dan organel seperti mitokondria, yang semuanya dirancang untuk mendukung pembelahan sel cepat dan pemrograman ulang epigenetik. Dengan mengeluarkan intinya, kita menghapus materi genetik asli sel telur, sehingga genom yang akan mengendalikan perkembangan embrio sepenuhnya berasal dari inti sel somatik donor.
Sel telur yang di-enukleasi ini memberikan lingkungan yang ideal bagi inti donor yang sudah dewasa untuk “melupakan” spesialisasinya dan kembali ke keadaan totipoten, berkat faktor reprogramming yang ada dalam sitoplasmanya.
Tantangan dan Faktor Penentu Keberhasilan: Peran Mitosis Dalam Proses Kloning Sel Somatik
Meski terdengar lugas dalam teori, proses SCNT di laboratorium penuh dengan rintangan teknis yang halus. Tingkat keberhasilan yang menghasilkan embrio kloning yang viabel seringkali masih rendah, dan ini disebabkan oleh beberapa faktor kritis yang harus diatasi.
Hambatan Teknis dalam Menjaga Viabilitas Inti
Proses mengambil, memanipulasi, dan mentransfer inti sel adalah intervensi fisik yang kasar pada skala mikro. Beberapa hambatan utama termasuk:
- Kerusakan Fisik: Inti sel dan kromosom di dalamnya sangat rentan terhadap kerusakan mekanis selama proses enukleasi dan transfer.
- Kontaminasi: Kontaminasi dari media kultur atau peralatan dapat membahayakan sel donor, sel telur, atau embrio yang sedang berkembang.
- Waktu Paparan: Inti sel donor yang diisolasi tidak boleh terlalu lama berada di luar lingkungan sitoplasma yang protektif, karena dapat mengalami dehidrasi atau degradasi.
- Kompatibilitas Sitoplasma: Terkadang terjadi ketidakcocokan antara inti donor dan mitokondria (yang berasal dari sitoplasma sel telur resipien), yang dapat mempengaruhi metabolisme energi sel hasil kloning.
Keselarasan Siklus Sel Donor dan Resipien
Ini adalah salah satu faktor penentu paling halus. Bayangkan mencocokkan dua mesin yang berdetak pada ritme berbeda. Jika inti sel somatik donor (dalam fase G1, dengan DNA belum direplikasi) dimasukkan ke dalam sel telur yang sitoplasmanya sedang dalam kondisi metafase (dengan faktor yang mendorong pemecahan membran inti dan kondensasi kromosom), maka kromosom donor bisa rusak. Keselarasan yang tepat memastikan bahwa setelah fusi, siklus sel dapat berlanjut dengan mulus, memulai pembelahan mitosis pertama yang sangat kritis untuk perkembangan embrio lebih lanjut.
Faktor Epigenetik dan Reprogramming Gen
Inilah tantangan biologis terdalam. Sel somatik dewasa memiliki pola “penanda epigenetik”—seperti metilasi DNA dan modifikasi histon—yang berfungsi sebagai bookmark, memberitahu sel gen mana yang harus aktif (seperti gen untuk sel kulit) dan mana yang harus diam (seperti gen untuk sel hati atau neuron). Dalam SCNT, sel telur harus menghapus dan menata ulang bookmark ini secara dramatis agar inti donor dapat mengekspresikan seluruh genomnya kembali, seperti zigot.
Seringkali, reprogramming ini tidak lengkap atau terjadi kesalahan. Inilah yang diduga menyebabkan banyak kegagalan perkembangan embrio kloning, seperti ukuran placenta yang abnormal atau kematian dini. Penelitian terkini fokus pada bagaimana meningkatkan efisiensi reprogramming epigenetik ini.
Aplikasi dan Implikasi dalam Bidang Ilmiah
Melampaui kontroversi seputar kloning reproduktif, teknologi kloning sel somatik membuka pintu bagi revolusi dalam ilmu biomedis. Kemampuannya untuk menciptakan sel punca yang secara genetik cocok dengan seorang individu adalah kunci untuk memahami dan suatu hari nanti mengobati berbagai penyakit.
Potensi Aplikasi dalam Medis dan Regeneratif
Salah satu contoh konkret yang paling menjanjikan adalah dalam terapi penyakit Parkinson. Bayangkan seorang pasien Parkinson menyumbang sepotong kecil kulit. Sel kulit (fibroblas) ini dikloning menggunakan SCNT untuk menghasilkan blastosis, dari mana sel punca embrionik (ESC) yang secara genetik identik dengan pasien dapat diambil. Sel punca ini kemudian dapat dibimbing untuk berdiferensiasi menjadi neuron dopaminergik—jenis sel yang rusak pada Parkinson.
Karena berasal dari pasien sendiri, sel-sel neuron baru ini memiliki kemungkinan penolakan imun yang jauh lebih rendah jika ditransplantasikan kembali ke otaknya, dibandingkan dengan sel dari donor lain.
Kelebihan dan Keterbatasan untuk Penelitian vs Terapi Langsung
Source: slidesharecdn.com
Meski potensinya besar, penting untuk membedakan antara penggunaan kloning sel somatik sebagai alat penelitian yang tak ternilai dan sebagai modalitas terapi langsung yang siap pakai.
| Aspect | Untuk Penelitian Penyakit | Untuk Terapi Langsung |
|---|---|---|
| Kelebihan | Menghasilkan garis sel punca dan jaringan yang secara genetik cocok dengan pasien, memungkinkan pemodelan penyakit in vitro, pengujian obat yang dipersonalisasi, dan studi mekanisme penyakit tanpa bias genetik antar individu. | Potensi untuk menyediakan sel, jaringan, atau organ untuk transplantasi autolog (dari diri sendiri) yang secara ideal tidak akan ditolak oleh sistem imun penerima. |
| Keterbatasan | Prosesnya masih mahal, memakan waktu, dan secara teknis menantang. Masih ada pertanyaan etis terkait pembuatan dan penghancuran embrio untuk penelitian. | Risiko tinggi ketidakefisienan dan anomali perkembangan (seperti yang terlihat pada hewan kloning). Proses dari pengambilan sel hingga transplantasi memakan waktu terlalu lama untuk kondisi akut. Regulasi dan keamanan jangka panjang masih dalam penyelidikan mendalam. |
Kontribusi Pemahaman Mitosis terhadap Bioteknologi
Setiap peningkatan dalam efisiensi kloning pada dasarnya adalah peningkatan dalam kemampuan kita mengontrol dan meniru mitosis dalam cawan petri. Dengan memahami secara mendetail bagaimana kromosom sejajar, bagaimana spindle apparatus terbentuk, dan bagaimana sitokinesis diatur, ilmuwan dapat mengoptimalkan kondisi aktivasi dan kultur embrio pasca-SCNT. Pengetahuan tentang titik pemeriksaan (checkpoints) mitosis membantu mengidentifikasi mengapa banyak embrio kloning berhenti berkembang pada tahap awal, dan merancang intervensi untuk melewati hambatan tersebut.
Dengan kata lain, menguasai mitosis alami adalah kunci untuk menyempurnakan mitosis “rekayasa” dalam kloning.
Visualisasi dan Analogi Proses
Kadang, konsep biologi seluler yang kompleks menjadi lebih jelas jika kita menarik analogi dengan dunia yang lebih familiar. Mari kita coba gambarkan proses ajaib ini dengan cara yang lebih mudah dicerna.
Analogi “Restart Komputer”
Bayangkan sebuah sel somatik yang terdiferensiasi, seperti sel kulit, sebagai sebuah komputer yang hanya menjalankan satu program spesifik, misalnya “Program Editor Teks”. Hard drive-nya (inti sel/nukleus) berisi semua program yang ada (genom lengkap), tetapi hanya satu yang dijalankan. Kloning melalui SCNT ibarat mengambil hard drive dari komputer “Editor Teks” itu dan memasukkannya ke dalam sebuah komputer baru yang sangat khusus: sebuah komputer dengan motherboard dan power supply super (sitoplasma sel telur), tetapi tanpa hard drive sendiri (karena telah di-enukleasi).
Saat dihidupkan (diaktivasi), faktor dalam “motherboard” khusus ini melakukan factory reset pada hard drive donor, menghapus pengaturan program tunggalnya, dan menginstal ulang sistem operasi dasar yang memungkinkan semua program (gen) dapat diakses kembali. Pembelahan mitosis berikutnya adalah proses duplikasi dan pembagian hard drive yang telah di- reset ini ke setiap komputer (sel) baru yang terbentuk.
Ilustrasi Deskriptif Reprogramming Sel
Visualisasikan sebuah sel kulit yang kecil dan pipih, penuh dengan serat protein keratin, melekat erat pada sel kulit di sekitarnya. Intinya penuh dengan bookmark epigenetik yang menandai hanya gen-gen terkait kulit yang aktif. Dalam laboratorium, sel ini dilepaskan dari jaringannya, ditempatkan dalam cairan nutrisi, dan dibiarkan membelah. Kemudian, intinya yang padat berisi bookmark tersebut disedot keluar dengan jarum halus. Inti ini, yang masih membawa “memori” menjadi kulit, kemudian disuntikkan ke dalam sebuah bola besar berisi cairan (sel telur) yang penuh dengan bahan kimia kehidupan—enzim, protein pembentuk struktur, dan paket energi.
Bahan kimia dalam bola besar ini mulai bekerja, secara bertahap melarutkan bookmark pada inti donor. Satu per satu, gen yang sebelumnya terkunci mulai terbebas. Struktur internal inti berubah, dan sel hibrida ini, yang kini dipandu oleh genom sel kulit tetapi dikelilingi oleh lingkungan sel telur, mulai berdenyut dan membelah, tidak lagi seperti kulit, tetapi seperti awal dari segala kemungkinan.
Perbandingan Pembelahan Alami dan yang Diinduksi
Dalam tubuh kita, mitosis terjadi dalam lingkungan yang sangat terkontrol dan terlindungi. Sel induk menerima sinyal yang tepat dari jaringan di sekitarnya, memiliki akses penuh pada nutrisi, dan membelah dengan orientasi yang ditentukan untuk membentuk struktur. Sebaliknya, pembelahan sel yang diinduksi dalam kultur kloning terjadi dalam dunia yang asing: di dalam cawan plastik, dikelilingi oleh cairan buatan, dan dipicu oleh kejutan listrik atau kimia.
Mesin mitosis itu sendiri—spindle, kromosom, sentriol—bekerja dengan prinsip yang sama persis. Namun, “konteks” pembelahannya sangat berbeda. Tidak ada jaringan di sekitarnya yang memberi arahan, sehingga pembelahan seringkali tidak terpolarisasi dan perkembangan harus mengandalkan instruksi yang tertanam dalam genom yang telah direprogram, tanpa isyarat eksternal yang biasa. Ini seperti membandingkan seorang tukang kayu yang membangun rumah di lokasi dengan tim dan rencana lengkap, versus seorang tukang kayu yang harus merakit rumah yang sama di dalam ruangan kosong, hanya berbekal daftar bahan dan perkakas dasarnya.
Penutupan Akhir
Jadi gitu, sob. Mitosis itu emang bintang utamanya. Dari yang awalnya cuma sel kulit biasa, lewat sentuhan teknologi dan peran krusial mitosis, bisa diajak balik ke masa depan jadi sel serba bisa. Penelitian ini nggak cuma buat bikin kloning aja, tapi juga buka jalan buat obat regeneratif dan ngerti penyakit lebih dalem. Kesimpulannya, paham mitosis sama aja kita punya kunci utama buat ngoprek potensi besar bioteknologi masa depan.
Kumpulan Pertanyaan Umum
Apakah kloning sel somatik bisa bikin manusia utuh?
Secara teknis, iya, itu yang disebut kloning reproduktif. Tapi secara etika dan hukum, hampir semua negara melarangnya untuk manusia. Aplikasi yang lebih banyak diteliti saat ini adalah untuk terapi, seperti membuat sel punca yang cocok dengan pasien.
Kenapa sering gagal? Apa hubungannya dengan mitosis?
Kegagalan sering terjadi karena inti sel somatik yang ditransfer sulit “di-reset” atau direprogram oleh sel telur. Meski mitosis menyiapkan materi genetik yang utuh, jika reprogramming epigenetiknya tidak sempurna, embrio hasil kloning tidak bisa berkembang normal.
Bisakah sel somatik yang sudah tua/tua banget dikloning?
Bisa, tapi lebih sulit dan tingkat keberhasilannya lebih rendah. Sel dari donor yang lebih tua mungkin sudah mengalami lebih banyak kerusakan DNA dan perubahan epigenetik, sehingga lebih sulit untuk diprogram ulang menjadi sel embrio yang sehat.
Apa bedanya kloning sel somatik dengan bayi tabung (IVF)?
Kalau IVF, pembuahan terjadi antara sel telur dan sperma, jadi anak punya gen dari dua orang tua. Kloning sel somatik nggak butuh sperma, karena semua gen datang dari satu donor (dari inti sel somatiknya), jadi hasilnya secara genetik hampir identik dengan donor.