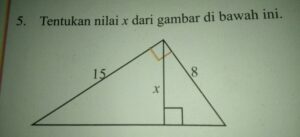
Reaksi Pengendapan PbI₂ dari Campuran NaCl dan Pb(NO₃)₂ bukan sekadar pertunjukan warna menawan di laboratorium, melainkan pintu masuk untuk memahami drama pertukaran ion dalam dunia kimia. Bayangkan, dua larutan bening bertemu dan tiba-tiba memunculkan kuning keemasan yang mengendap, sebuah transformasi visual yang langsung menangkap rasa ingin tahu. Demonstrasi klasik ini sering menjadi pengalaman pertama yang tak terlupakan bagi banyak siswa dalam mempelajari konsep reaksi pengendapan yang fundamental.
Pada dasarnya, reaksi ini melibatkan pertukaran pasangan ion antara natrium klorida (NaCl) dan timbal(II) nitrat (Pb(NO₃)₂). Ketika dicampur, ion timbal (Pb²⁺) dan ion iodida (I⁻) bergabung membentuk timbal(II) iodida (PbI₂), sebuah senyawa yang memiliki kelarutan sangat rendah dalam air sehingga memisah sebagai endapan padat. Sementara itu, ion natrium dan nitrat tetap larut, hanya menjadi penonton dalam proses kimia yang elegan ini.
Kesederhanaan dan visualnya yang jelas menjadikannya alat pedagogis yang sangat efektif.
Pendahuluan Reaksi Pengendapan PbI₂
Dalam dunia kimia anorganik, reaksi pengendapan adalah suatu peristiwa yang sekaligus dramatis dan fundamental. Reaksi ini terjadi ketika pencampuran dua larutan elektrolit menghasilkan suatu senyawa padat yang tidak larut, yang kita sebut endapan. Fenomena ini bukan hanya sekadar pertunjukan visual yang menarik, tetapi juga merupakan dasar dari banyak teknik analisis dan proses industri.
Salah satu reaksi pengendapan yang paling ikonik dan sering didemonstrasikan adalah reaksi antara natrium klorida (NaCl) dan timbal(II) nitrat (Pb(NO₃)₂) untuk menghasilkan timbal(II) iodida (PbI₂). Meskipun namanya menyebut NaCl, perlu koreksi bahwa reagen yang tepat adalah natrium iodida (NaI). Reaksi antara NaI dan Pb(NO₃)₂ ini menghasilkan endapan berwarna kuning cerah yang sangat khas. Demonstrasi ini populer karena visualnya yang jelas, perubahan yang cepat, serta menjadi contoh sempurna untuk mempelajari konsep stoikiometri, kelarutan, dan identifikasi ion.
Prinsip Dasar dan Persamaan Reaksi
Inti dari percobaan ini terletak pada pertukaran ion antara dua senyawa yang larut dalam air. Ketika NaI dan Pb(NO₃)₂ dilarutkan, mereka terdisosiasi sempurna menjadi ion-ion penyusunnya. Pertemuan antara ion timbal(II) (Pb²⁺) dan ion iodida (I⁻) menghasilkan senyawa PbI₂ yang memiliki kelarutan sangat rendah dalam air, sehingga langsung mengkristal dan terlihat sebagai endapan.
Persamaan Reaksi dan Ion Spektator
Reaksi ini dapat diungkapkan dalam tiga bentuk persamaan yang memberikan tingkat informasi berbeda. Persamaan molekuler menggambarkan reaktan dan produk dalam bentuk senyawa netral. Sementara itu, persamaan ionik lengkap mengungkap semua ion yang ada dalam larutan, dan persamaan ionik bersih menyaring hanya ion-ion yang benar-benar terlibat dalam perubahan kimia.
Persamaan Molekuler: 2NaI(aq) + Pb(NO₃)₂(aq) → PbI₂(s) + 2NaNO₃(aq)
Persamaan Ionik Lengkap: 2Na⁺(aq) + 2I⁻(aq) + Pb²⁺(aq) + 2NO₃⁻(aq) → PbI₂(s) + 2Na⁺(aq) + 2NO₃⁻(aq)
Persamaan Ionik Bersih: Pb²⁺(aq) + 2I⁻(aq) → PbI₂(s)
Dari persamaan ionik lengkap, terlihat bahwa ion Na⁺ dan NO₃⁻ hadir di kedua sisi persamaan. Ion-ion ini tidak mengalami perubahan kimia dan disebut ion spektator. Mereka hanya “menonton” proses pengendapan terjadi. Aturan kelarutan menjelaskan bahwa sebagian besar garam nitrat dan garam natrium sangat larut, sedangkan garam timbal(II) dengan halida (kecuali fluorida) umumnya memiliki kelarutan terbatas, dengan PbI₂ yang khususnya sangat sedikit larut dalam air dingin.
Prosedur Percobaan dan Pengamatan
Melakukan percobaan ini memerlukan perencanaan yang cermat untuk memastikan keamanan dan keberhasilan pengamatan. Prosedur yang dirancang harus memungkinkan pembentukan endapan yang optimal sambil meminimalkan risiko paparan bahan kimia. Pengamatan visual adalah kunci, mulai dari kejernihan larutan awal hingga kemunculan warna kuning yang menandai terbentuknya produk.
Langkah Percobaan dan Catatan Keamanan
Berikut adalah tabel prosedur yang disusun untuk memandu percobaan di lingkungan laboratorium yang terkontrol. Setiap langkah dilengkapi dengan pengamatan yang diharapkan dan catatan keamanan yang kritis untuk diperhatikan.
| No | Langkah Prosedur | Pengamatan yang Diharapkan | Catatan Keamanan |
|---|---|---|---|
| 1 | Siapkan larutan NaI 0.1 M dan Pb(NO₃)₂ 0.1 M masing-masing sebanyak 50 mL dalam gelas kimia terpisah. | Larutan jernih dan tidak berwarna. | Gunakan jas lab, sarung tangan nitril, dan pelindung mata. Hindari kontak kulit dengan Pb(NO₃)₂. |
| 2 | Dengan menggunakan gelas ukur, tuang 25 mL larutan NaI ke dalam gelas kimia 100 mL. | Larutan NaI tetap jernih. | Pastikan area kerja bersih dan tertata rapi. |
| 3 | Tambahkan 25 mL larutan Pb(NO₃)₂ ke dalam gelas kimia yang berisi NaI secara perlahan sambil diaduk. | Segera terbentuk endapan berwarna kuning cerah yang menyebar di seluruh larutan. Larutan di atas endapan mungkin tetap bening. | Lakukan penambahan dengan hati-hati untuk menghindari percikan. Aduk dengan batang pengaduk kaca. |
| 4 | Biarkan campuran selama beberapa menit hingga endapan mengendap di dasar gelas. | Endapan kuning terkumpul di dasar, membentuk lapisan padat, sementara supernatant (cairan di atas) menjadi jernih. | Jangan meninggalkan sampel tanpa pengawasan. Beri label yang jelas pada gelas kimia. |
Analisis Faktor yang Mempengaruhi Pembentukan Endapan
Hasil percobaan pembentukan PbI₂ tidak selalu identik; ia sangat dipengaruhi oleh kondisi operasi. Dua faktor utama yang berperan adalah konsentrasi reaktan dan suhu larutan. Memahami pengaruh ini memungkinkan kita untuk mengontrol reaksi, baik untuk tujuan demonstrasi yang dramatis maupun untuk keperluan analisis yang presisi.
Pengaruh Konsentrasi dan Suhu
Meningkatkan konsentrasi larutan NaI dan Pb(NO₃)₂ akan mempercepat laju pembentukan endapan dan meningkatkan jumlah massa endapan yang dihasilkan. Prinsip Le Chatelier menjelaskan bahwa dengan menambah jumlah ion Pb²⁺ dan I⁻, kesetimbangan kelarutan PbI₂ akan bergeser ke arah pembentukan endapan. Namun, ada batasan praktis terkait dengan volume dan kejenuhan.
Suhu memainkan peran paradoks. Pemanasan larutan justru meningkatkan kelarutan PbI₂ secara signifikan. Endapan kuning yang terbentuk pada suhu ruang dapat larut kembali seluruhnya jika campuran dipanaskan, membentuk larutan jernih berwarna kuning pucat. Ketika larutan ini didinginkan, endapan mengkristal kembali seringkali dalam bentuk kepingan atau kristal berkilau, sebuah fenomena yang menarik untuk diamati.
Prediksi Stoikiometri Massa Endapan
Stoikiometri memberikan alat untuk memprediksi hasil percobaan secara kuantitatif. Dari persamaan reaksi, diketahui bahwa 2 mol NaI bereaksi dengan 1 mol Pb(NO₃)₂ menghasilkan 1 mol PbI₂. Sebagai contoh, jika kita menggunakan 0.1 L larutan NaI 0.1 M (0.01 mol) dan 0.1 L larutan Pb(NO₃)₂ 0.1 M (0.01 mol), maka NaI bertindak sebagai pereaksi pembatas. Massa PbI₂ teoritis yang dihasilkan dapat dihitung: 0.005 mol PbI₂ x 461.01 g/mol = sekitar 2.3 gram.
Massa aktual akan sedikit lebih kecil karena kehilangan selama penyaringan dan kelarutan yang sangat kecil yang tersisa.
Karakterisasi Endapan PbI₂
Endapan timbal(II) iodida bukan hanya sekadar zat berwarna kuning. Ia memiliki serangkaian sifat fisika dan kimia yang unik, yang membedakannya dari senyawa timbal halida lainnya. Karakterisasi ini penting untuk identifikasi material dan memahami perilakunya dalam berbagai kondisi.
Sifat Fisika, Kimia, dan Morfologi, Reaksi Pengendapan PbI₂ dari Campuran NaCl dan Pb(NO₃)₂
PbI₂ memiliki warna kuning yang intens, berbeda dengan PbCl₂ yang putih dan PbBr₂ yang berwarna putih kekuningan pucat. Senyawa ini sangat sensitif terhadap cahaya, perlahan-lahan dapat terurai menjadi unsur timbal dan iodin jika terpapar cahaya terang dalam waktu lama (fotosensitif). Dari segi kelarutan, PbI₂ hampir tidak larut dalam air dingin, tetapi kelarutannya meningkat drastis dengan suhu dan juga larut dalam larutan KI berlebih membentuk ion kompleks [PbI₄]²⁻.
Ketika diamati di bawah mikroskop, morfologi endapan PbI₂ sangat bergantung pada kondisi pembentukannya. Jika diendapkan cepat dari larutan dingin, ia cenderung membentuk partikel koloid halus berwarna kuning cerah yang sulit disaring. Namun, jika dikristalisasi perlahan dari larutan panas yang didinginkan, PbI₂ dapat membentuk kepingan heksagonal berlapis (seperti struktur berlapis grafena) yang berkilauan dan berukuran lebih besar. Kristal ini memiliki struktur kristal ortorombik atau heksagonal, tergantung metode sintesisnya.
Aplikasi dan Relevansi dalam Konteks Ilmiah: Reaksi Pengendapan PbI₂ Dari Campuran NaCl Dan Pb(NO₃)₂
Reaksi pengendapan sederhana seperti pembentukan PbI₂ adalah gerbang menuju konsep-konsep kimia yang lebih kompleks dan aplikasi yang sangat nyata. Ia menghubungkan dunia praktikum sekolah dengan penelitian mutakhir dan teknologi industri.
Relevansi dalam Analisis dan Konsep Kelarutan
Dalam analisis kualitatif, reaksi pengendapan adalah alat utama untuk mengidentifikasi kation dan anion tertentu. Terbentuknya endapan kuning saat suatu larutan ditambahkan larutan iodida merupakan uji konfirmasi untuk ion Pb²⁺. Percobaan ini juga merupakan pengantar visual yang sempurna untuk konsep Hasil Kali Kelarutan (Ksp), yaitu konstanta kesetimbangan untuk larutan jenuh suatu elektrolit yang sukar larut. Untuk PbI₂, Ksp dinyatakan sebagai [Pb²⁺][I⁻]², yang nilainya konstan pada suhu tertentu.
Prinsip pengendapan memiliki aplikasi praktis yang luas, antara lain:
- Pengolahan Air Limbah: Pengendapan logam berat seperti timbal, merkuri, dan kromium dari air limbah industri sebelum dibuang ke lingkungan.
- Industi Fotografi Tradisional: Beberapa senyawa perak halida yang peka cahaya, mirip dengan PbI₂ yang fotosensitif, digunakan dalam emulsi film.
- Sintesis Material: PbI₂ sendiri adalah prekursor penting dalam pembuatan sel surya perovskit, sebuah teknologi energi terbarukan yang sangat menjanjikan.
- Analisis Gravimetri: Metode analisis kuantitatif dengan menimbang massa endapan murni yang dihasilkan dari suatu reaksi.
Pertimbangan Keamanan dan Penanganan Limbah
Percobaan kimia selalu harus diimbangi dengan kesadaran keamanan yang tinggi, terutama ketika melibatkan senyawa logam berat seperti timbal. Timbal(II) nitrat dan senyawa timbal lainnya bersifat toksik, dapat menyebabkan keracunan sistemik jika tertelan atau terhirup, serta berbahaya bagi lingkungan. Natrium iodida relatif lebih aman, tetapi penanganan yang tepat tetap diperlukan.
Tindakan Pencegahan dan Prosedur Pembuangan
Selain menggunakan Alat Pelindung Diri (APD) standar laboratorium, penting untuk bekerja di dalam lemari asam atau area dengan ventilasi yang baik untuk menghindari inhalasi debu atau aerosol. Jangan pernah membuang sisa larutan atau endapan langsung ke wastafel atau saluran pembuangan umum.
Limbah percobaan yang mengandung timbal harus dikumpulkan dalam wadah limbah kimia khusus yang berlabel “Limbah Timbal”. Endapan PbI₂ yang telah disaring dan padatan sisa lainnya juga harus dimasukkan ke dalam wadah yang sama. Institusi atau laboratorium biasanya memiliki prosedur pembuangan limbah B3 (Bahan Berbahaya dan Beracun) yang bekerja sama dengan penyedia jasa limbah berlisensi.
Panduan dari badan keselamatan seperti OSHA (Occupational Safety and Health Administration) merekomendasikan batas paparan rata-rata tertimbang waktu (PEL) untuk debu dan kabut timbal anorganik adalah 0.05 mg/m³. Paparan akut dapat menyebabkan gejala seperti kelelahan, sakit kepala, dan nyeri perut, sementara paparan kronis berdampak serius pada sistem saraf, ginjal, dan perkembangan kognitif, terutama pada anak-anak.
Kesadaran akan risiko dan komitmen untuk menangani bahan serta limbah dengan benar adalah bagian integral dari praktik ilmiah yang bertanggung jawab. Demonstrasi yang menarik tidak boleh mengabaikan aspek keselamatan dan lingkungan ini.
Penutupan
Dari serangkaian eksplorasi ini, terlihat jelas bahwa Reaksi Pengendapan PbI₂ dari Campuran NaCl dan Pb(NO₃)₂ jauh lebih dari sekadar perubahan warna. Reaksi ini adalah contoh konkret dan elegan dari prinsip-prinsip kimia dasar yang bekerja, mulai dari aturan kelarutan hingga perhitungan stoikiometri. Endapan kuning keemasan itu bukanlah akhir cerita, melainkan awal untuk memahami mekanisme analisis kualitatif hingga teknologi pemurnian di industri.
Dengan demikian, setiap tetes reaksi ini mengajarkan sebuah cerita besar tentang interaksi materi di sekitar kita.
Kumpulan FAQ
Apakah reaksi ini bisa digunakan untuk membuktikan keberadaan ion timbal (Pb²⁺) dalam suatu sampel?
Ya, reaksi pembentukan endapan kuning PbI₂ dapat menjadi uji kualitatif awal untuk ion timbal(II). Namun, uji ini tidak spesifik hanya untuk timbal karena ion lain seperti merkuri(I) juga bisa memberikan endapan berwarna. Konfirmasi lebih lanjut dengan uji spesifik lainnya tetap diperlukan.
Mengapa digunakan NaCl dan Pb(NO₃)₂, bukan langsung mencampurkan Pb²⁺ dan I⁻ dari sumber lain?
NaCl dan Pb(NO₃)₂ adalah senyawa yang relatif stabil, mudah didapat, dan larut dengan baik dalam air, sehingga memudahkan pencampuran dan pengamatan. Sumber ion I⁻ yang lain seperti KI tentu bisa digunakan, tetapi penggunaan NaCl dalam konteks pembelajaran sering kali untuk menunjukkan bahwa tidak semua kombinasi kation dan anion akan menghasilkan endapan, dan hanya pasangan Pb²⁺ dan I⁻ yang mengendap dari campuran tersebut.
Bagaimana cara membedakan endapan PbI₂ secara visual dari endapan kuning lainnya, seperti kromat timbal (PbCrO₄)?
Endapan PbI₂ memiliki karakteristik warna kuning yang cenderung lebih “keemasan” atau kuning cerah, serta sering terbentuk sebagai partikel halus yang tersuspensi sebelum mengendap. Perbedaan yang lebih pasti memerlukan uji kimia lanjutan, misalnya kelarutannya dalam air panas atau reaksi dengan reagen spesifik lainnya.
Apakah endapan PbI₂ yang terbentuk bisa larut kembali jika ditambahkan air berlebih?
Tidak, penambahan air berlebih hanya akan mengencerkan campuran tetapi tidak melarutkan endapan PbI₂ yang telah terbentuk. Kelarutan PbI₂ sangat rendah, sehingga endapannya tetap stabil. Namun, pemanasan dapat meningkatkan kelarutannya secara signifikan, yang merupakan sifat menarik yang bisa diamati.