Bantuan Soal Kimia Kelas X dengan Penjelasan Lengkap hadir sebagai solusi tepat bagi siswa yang sedang bergulat dengan materi kimia di awal jenjang SMA. Topik seperti struktur atom, ikatan kimia, hingga stoikiometri seringkali terasa seperti teka-teki yang rumit, padahal pemahaman mendasar pada konsep-konsep ini justru menjadi kunci kesuksesan di tingkat pembelajaran selanjutnya. Artikel ini dirancang untuk membongkar kompleksitas tersebut, mengubah tantangan menjadi peluang penguasaan materi yang lebih solid.
Melalui pembahasan yang sistematis, mulai dari konsep dasar hingga strategi penyelesaian soal, panduan ini tidak hanya sekadar memberikan kunci jawaban. Setiap penjelasan dikemas dengan pendekatan bertahap yang memudahkan pemahaman, dilengkapi dengan contoh soal beserta langkah-langkah penyelesaiannya yang detail. Dengan demikian, siswa tidak hanya mampu menjawab soal, tetapi juga mengerti alur berpikir dan logika kimia di balik setiap permasalahan.
Pendahuluan dan Konsep Dasar Kimia Kelas X
Memasuki jenjang SMA, mata pelajaran Kimia kerap menjadi salah satu tantangan baru. Materi Kimia kelas X dirancang sebagai fondasi yang kokoh, membuka gerbang untuk memahami dunia materi di sekitar kita. Ruang lingkupnya meliputi pengenalan hakikat ilmu kimia, struktur atom, sistem periodik unsur, ikatan kimia, tata nama senyawa, hukum dasar kimia, stoikiometri, larutan, serta reaksi redoks. Pemahaman mendalam pada setiap bab ini bukan sekadar untuk nilai ulangan, tetapi untuk membangun logika ilmiah yang sistematis.
Menguasai konsep dasar di kelas X ibarat memiliki peta yang lengkap sebelum menjelajah hutan belantara kimia di kelas XI dan XII. Tanpa pemahaman yang kuat tentang struktur atom, misalnya, akan sangat sulit untuk memahami ikatan kimia. Tanpa mengerti stoikiometri, perhitungan dalam termokimia atau kesetimbangan kimia akan terasa mustahil. Fondasi yang rapuh di awal akan berisiko membuat bangunan pengetahuan di tingkat selanjutnya mudah runtuh.
Tantangan Umum dan Strategi Mengatasinya
Banyak siswa mengeluhkan bahwa kimia terasa abstrak dan penuh dengan hafalan rumus. Tantangan utama seringkali terletak pada peralihan cara berpikir dari yang konkret ke abstrak, serta kesulitan dalam menghubungkan satu konsep dengan konsep lainnya. Untuk mengatasinya, pendekatan belajar perlu diubah. Konsep abstrak seperti orbital elektron bisa divisualisasikan dengan bantuan video atau simulasi interaktif. Hafalan rumus dan nama senyawa akan lebih mudah jika dipahami polanya, bukan dihafal mentah-mentah.
Latihan soal secara konsisten dan bertahap adalah kunci untuk mengubah pemahaman konseptual menjadi keterampilan penyelesaian masalah.
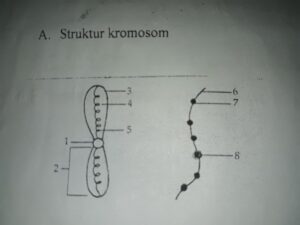
Struktur Atom dan Sistem Periodik Unsur
Konsep atom telah berevolusi jauh dari gagasan filosofis menjadi model ilmiah yang canggih. Perjalanan pemikiran ini dimulai dari John Dalton yang memandang atom sebagai partikel pejal tak terbagi, dilanjutkan oleh J.J. Thomson dengan model “roti kismis”-nya, lalu Ernest Rutherford yang membuktikan adanya inti atom yang sangat padat melalui eksperimen penghamburan sinar alfa. Model Bohr memperkenalkan orbit elektron yang diskrit, sebelum akhirnya mekanika kuantum modern menggambarkan elektron dalam bentuk awan probabilitas atau orbital.
Pemahaman tentang partikel penyusun atom mutlak diperlukan. Tabel berikut merangkum perbandingan ketiga partikel subatom fundamental.
| Partikel | Lokasi | Muatan | Massa Relatif |
|---|---|---|---|
| Proton | Inti Atom | +1 | ~1 sma |
| Neutron | Inti Atom | 0 (netral) | ~1 sma |
| Elektron | Orbital di sekitar inti | -1 | ~1/1840 sma |
Konfigurasi Elektron dan Posisi dalam Sistem Periodik
Konfigurasi elektron adalah cara untuk memetakan penyebaran elektron dalam orbital suatu atom. Aturan Aufbau, larangan Pauli, dan aturan Hund menjadi panduannya. Konfigurasi ini memiliki hubungan langsung dengan letak unsur dalam tabel periodik. Jumlah kulit elektron menunjukkan periode (baris), sedangkan jumlah elektron valensi (elektron pada kulit terluar) menentukan golongan (kolom). Sebagai contoh, unsur dengan konfigurasi elektron akhir ...3s² 3p⁵ menempati periode 3 karena memiliki 3 kulit, dan golongan VIIA (17) karena memiliki 7 elektron valensi.
Contoh Perhitungan Partikel dalam Isotop
Isotop adalah atom dari unsur yang sama (nomor atom sama) tetapi memiliki nomor massa berbeda. Notasi isotop ditulis sebagai AZ X, di mana A adalah nomor massa dan Z adalah nomor atom. Misalkan kita diminta menentukan jumlah proton, neutron, dan elektron dari 3517 Cl – (ion klorida).
- Nomor atom (Z) = 17. Jumlah proton = 17.
- Nomor massa (A) = 35. Jumlah neutron = A – Z = 35 – 17 = 18.
- Atom Cl netral memiliki elektron sebanyak proton, yaitu 17. Namun, karena ia membentuk ion Cl– (muatan -1), berarti telah menerima 1 elektron tambahan. Jadi, jumlah elektron = 17 + 1 = 18.
Ikatan Kimia dan Tata Nama Senyawa
Atom-atom yang tidak stabil cenderung berikatan untuk mencapai konfigurasi elektron yang stabil seperti gas mulia. Proses ini melahirkan beragam jenis ikatan dengan karakteristik berbeda. Ikatan ionik terjadi akibat serah terima elektron antara logam (melepas elektron) dan nonlogam (menerima elektron), menghasilkan senyawa seperti NaCl (garam dapur). Ikatan kovalen terjadi karena pemakaian bersama pasangan elektron antara dua atom nonlogam, contohnya H 2O (air).
Sementara itu, ikatan logam adalah gaya tarik-menarik antara ion-ion logam positif dengan lautan elektron yang bebas bergerak, yang menjelaskan sifat konduktivitas dan malleability pada logam seperti besi atau tembaga.
Prosedur Penulisan Rumus Kimia
Menulis rumus kimia senyawa ionik mengikuti prinsip netralitas muatan. Misal, untuk senyawa kalsium (Ca 2+) dan klorin (Cl –), kita membutuhkan 2 ion Cl – untuk menetralkan 1 ion Ca 2+, sehingga rumusnya CaCl 2. Untuk senyawa kovalen biner, penulisan didasarkan pada jumlah atom penyusunnya, seperti CO 2 (1 atom C, 2 atom O) dan PCl 3 (1 atom P, 3 atom Cl).
Tata nama senyawa memiliki aturan sistematis. Tabel berikut memberikan contoh-contoh umum untuk dipelajari.
Bantuan soal Kimia kelas X dengan penjelasan lengkap memang kerap dibutuhkan untuk menguasai konsep dasar. Nah, prinsip perhitungan serupa juga berlaku di Fisika, misalnya saat menganalisis Usaha gaya 100 N pada sudut 60° menggerakkan benda sejauh 3 m yang melibatkan trigonometri. Pemahaman mendalam seperti ini sangat krusial untuk membangun logika ilmiah yang solid, yang kemudian dapat diterapkan kembali untuk menyelesaikan berbagai problematika kimiawi dengan lebih tepat dan komprehensif.
| Jenis Senyawa | Rumus | Nama |
|---|---|---|
| Senyawa Ionik Biner | NaCl | Natrium Klorida |
| Senyawa Ionik Biner | MgO | Magnesium Oksida |
| Senyawa Kovalen Biner | CO | Karbon Monoksida |
| Senyawa Kovalen Biner | N2O4 | Dinitrogen Tetroksida |
| Senyawa Poliatomik | CaCO3 | Kalsium Karbonat |
| Senyawa Poliatomik | NH4NO3 | Amonium Nitrat |
Aturan penting dalam tata nama senyawa anorganik: (1) Sebutkan nama kation (logam/ion positif) terlebih dahulu, diikuti nama anion (nonlogam/ion negatif). (2) Untuk senyawa kovalen biner dari dua nonlogam, gunakan awalan numerik (mono-, di-, tri-, tetra-, penta-, dst.) untuk menyatakan jumlah atom setiap unsur, dengan pengecualian awalan “mono-” pada unsur pertama biasanya dihilangkan. (3) Nama anion nonlogam tunggal diakhiri dengan “-ida”.
Hukum Dasar Kimia dan Perhitungan Stoikiometri
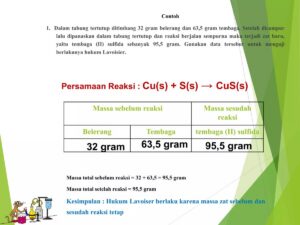
Stoikiometri, jantung dari perhitungan kimia, berdiri di atas hukum-hukum dasar yang telah dibuktikan secara eksperimental. Hukum Kekekalan Massa (Lavoisier) menyatakan massa zat sebelum dan sesudah reaksi adalah sama. Hukum Perbandingan Tetap (Proust) menjelaskan bahwa suatu senyawa selalu tersusun dari unsur-unsur dengan perbandingan massa yang tetap. Hukum Kelipatan Perbandingan (Dalton) berlaku ketika dua unsur dapat membentuk lebih dari satu senyawa. Hukum Perbandingan Volume (Gay-Lussac) menunjukkan hubungan volume gas-gas yang bereaksi dan hasil reaksi pada suhu dan tekanan yang sama.
Penyetaraan Persamaan Reaksi Kimia
Penyetaraan persamaan reaksi memastikan hukum kekekalan massa terpenuhi. Untuk reaksi kompleks, metode setengah reaksi atau metode perubahan bilangan oksidasi digunakan khusus untuk reaksi redoks. Namun, untuk reaksi non-redoks, metode inspeksi (coba-coba terarah) seringkali cukup. Prinsipnya adalah menyamakan jumlah atom setiap unsur di ruas kiri (pereaksi) dan kanan (hasil reaksi), dimulai dari unsur yang muncul dalam satu jenis senyawa saja.
Panduan Stoikiometri dengan Konsep Mol, Bantuan Soal Kimia Kelas X dengan Penjelasan Lengkap
Konsep mol adalah jembatan antara dunia mikroskopis (atom/molekul) dan dunia makroskopis (gram, liter). Satu mol didefinisikan sebagai jumlah zat yang mengandung partikel sebanyak atom dalam 12 gram karbon-12, yaitu sekitar 6.02 x 10 23 partikel (bilangan Avogadro). Langkah menyelesaikan soal stoikiometri meliputi: (1) Tulis dan setarakan persamaan reaksi. (2) Konversi semua data yang diketahui (massa, volume, jumlah partikel) menjadi satuan mol.
(3) Gunakan perbandingan koefisien dari persamaan reaksi setara sebagai perbandingan mol untuk mencari mol zat yang ditanya. (4) Konversi mol zat yang ditanya ke dalam satuan yang diminta soal (massa, volume, dll.).
Dalam larutan, konsentrasi dapat dinyatakan dalam beberapa cara. Perbandingannya dapat dilihat pada tabel berikut.
| Jenis Konsentrasi | Rumus | Satuan |
|---|---|---|
| Molaritas (M) | mol zat terlarut / liter larutan | mol/L atau M |
| Molalitas (m) | mol zat terlarut / kilogram pelarut | mol/kg |
| Fraksi Mol (X) | mol komponen / total mol semua komponen | Tidak bersatuan |
Larutan, Elektrolit, dan Reaksi Redoks
Berdasarkan kemampuan menghantarkan listrik, larutan dibedakan menjadi elektrolit dan nonelektrolit. Larutan elektrolit seperti larutan garam (NaCl) atau asam cuka (CH 3COOH) dapat menghantarkan arus listrik karena terurai menjadi ion-ion yang bergerak bebas. Larutan nonelektrolit seperti larutan gula (C 12H 22O 11) tidak menghantarkan listrik karena tidak terionisasi. Elektrolit sendiri dibagi lagi menjadi kuat (terionisasi sempurna, contoh: HCl) dan lemah (terionisasi sebagian, contoh: CH 3COOH).
Reaksi reduksi-oksidasi (redoks) adalah reaksi yang melibatkan transfer elektron. Ciri utamanya adalah perubahan bilangan oksidasi (biloks) atom-atom yang terlibat. Oksidasi ditandai dengan kenaikan biloks (kehilangan elektron), sedangkan reduksi ditandai dengan penurunan biloks (penerimaan elektron). Zat yang mengalami oksidasi disebut reduktor, sedangkan zat yang mengalami reduksi disebut oksidator.
Reaksi Redoks dalam Kehidupan Sehari-hari
Contoh paling nyata adalah proses perkaratan besi. Besi (Fe) mengalami oksidasi menjadi Fe 2+ atau Fe 3+, sementara oksigen (O 2) dari udara mengalami reduksi menjadi O 2-. Dalam baterai sel kering, seng (Zn) di anoda teroksidasi, sementara mangan dioksida (MnO 2) di katoda tereduksi, menghasilkan aliran elektron (arus listrik).
Penentuan Bilangan Oksidasi
Aturan dasar biloks perlu diingat: biloks unsur bebas = 0, biloks ion monoatomik = muatannya, biloks H umumnya +1 (kecuali dalam hidrida logam, -1), biloks O umumnya -2 (kecuali dalam peroksida, -1). Biloks total senyawa netral = 0, sedangkan biloks total suatu ion poliatomik = muatan ion tersebut. Misalnya, untuk menentukan biloks S dalam H 2SO 4: (2 x biloks H) + (biloks S) + (4 x biloks O) = 0 → (2×1) + S + (4x(-2)) = 0 → 2 + S – 8 = 0 → S = +6.
Strategi Penyelesaian Soal dan Sumber Belajar: Bantuan Soal Kimia Kelas X Dengan Penjelasan Lengkap
Menaklukkan soal kimia memerlukan strategi yang lebih dari sekadar menghafal. Pendekatan sistematis akan meningkatkan akurasi dan efisiensi. Strategi umumnya dimulai dengan membaca soal dengan cermat untuk mengidentifikasi konsep apa yang diuji, menuliskan semua data yang diketahui dan ditanyakan, kemudian memilih rumus atau hubungan stoikiometri yang tepat. Selalu perhatikan satuan dan konsistensinya selama perhitungan.
Tips Mengerjakan Soal Stoikiometri dan Konsep Mol
- Pastikan persamaan reaksi kimia sudah setara sebelum memulai perhitungan apa pun. Ini adalah langkah kritis yang sering terlewatkan.
- Gunakan “jalan mol” sebagai peta perhitungan. Konversi semua data ke mol terlebih dahulu, lalu gunakan perbandingan koefisien, baru konversi ke satuan akhir.
- Waspadalah terhadap zat yang disebut sebagai “pereaksi pembatas”. Hitung mol setiap pereaksi dan tentukan mana yang habis bereaksi terlebih dahulu.
- Untuk gas, ingat hubungan PV = nRT. Pada keadaan STP (0°C, 1 atm) atau RTP (kondisi kamar), gunakan volume molar (22.4 L/mol atau ~24 L/mol) untuk mempermudah.
Ilustrasi Percobaan Elektrolit Sederhana
Sebuah percobaan klasik dapat dilakukan dengan alat uji elektrolit sederhana: sebuah rangkaian listrik dengan sumber daya (baterai), lampu LED, dan dua elektroda. Siapkan tiga larutan dalam wadah terpisah: air aki (asam sulfat, H 2SO 4), larutan cuka dapur (asam asetat, CH 3COOH), dan larutan gula. Celupkan elektroda ke dalam air aki, lampu akan menyala terang (elektrolit kuat). Di larutan cuka, lampu menyala redup atau bahkan tidak menyala tetapi gelembung gas terlihat di elektroda (elektrolit lemah).
Di larutan gula, lampu padam dan tidak ada gelembung (nonelektrolit). Perbedaan ini menggambarkan derajat ionisasi masing-masing larutan.
Sumber Belajar Tambahan yang Direkomendasikan
Selain buku paket resmi, beberapa sumber dapat memperkaya pemahaman. Buku-buku seperti “Kimia untuk SMA Kelas X” karya Tim Depdiknas atau buku pendamping dari penerbit terkenal biasanya menyajikan latihan soal yang variatif. Platform online seperti Ruangguru, Pahamify, atau Khan Academy (dalam bahasa Inggris) menawarkan video penjelasan konsep yang menarik. Bergabung dalam komunitas belajar seperti grup diskusi di media sosial atau forum online juga membantu untuk bertanya dan berbagi strategi penyelesaian soal dengan teman sebaya.
Ringkasan Penutup
Menguasai kimia kelas X bukanlah tentang menghafal rumus semata, melainkan tentang membangun kerangka berpikir ilmiah yang kokoh. Materi yang dibahas dalam panduan ini, dari atom hingga reaksi redoks, merupakan fondasi yang akan terus digunakan dan dikembangkan di tingkat pendidikan lebih lanjut. Dengan pendekatan yang tepat dan latihan yang konsisten, kesulitan awal dalam mempelajari kimia dapat diatasi, membuka jalan bagi prestasi akademik yang lebih gemilang.
Mendalami konsep Kimia kelas X seperti stoikiometri memerlukan pola pikir yang terstruktur, mirip dengan prinsip 8 Penjuru Mata Angin dalam Bela Diri yang mengajarkan kesadaran ruang dan antisipasi. Dalam konteks akademis, pemahaman mendalam ini menjadi kunci untuk menganalisis reaksi kimia secara komprehensif, sehingga siswa dapat menyelesaikan soal-soal dengan penjelasan yang lengkap dan tepat.
Pertanyaan dan Jawaban
Apakah panduan ini cocok untuk siswa yang kesulitan dengan matematika dalam soal kimia?
Ya, sangat cocok. Panduan ini menyertakan strategi khusus dan tips untuk menyelesaikan soal hitungan stoikiometri dan konsep mol dengan langkah-langkah yang jelas, mengurangi kesalahan umum yang sering terjadi karena ketidaktelitian perhitungan.
Bagaimana cara memanfaatkan panduan ini jika saya baru mulai belajar dari nol?
Bantuan Soal Kimia Kelas X dengan penjelasan lengkap tak hanya mengurai konsep stoikiometri atau hukum dasar, tetapi juga melatih logika analitis yang berguna untuk memecahkan berbagai soal, termasuk saat Menentukan nilai x pada gambar dengan pilihan jawaban dalam konteks geometri atau data. Kemampuan berpikir sistematis ini fundamental, sehingga penguasaan materi kimia secara komprehensif menjadi kunci sukses menjawab tantangan akademik yang beragam.
Mulailah dari bagian Pendahuluan dan Konsep Dasar, kemudian ikuti urutan bab secara berurutan. Setiap bagian dirancang berjenjang, sehingga pemahaman dari bab sebelumnya akan mendukung bab selanjutnya. Manfaatkan juga contoh soal yang disertai penjelasan langkah demi langkah.
Apakah ada rekomendasi eksperimen atau percobaan sederhana di rumah untuk memahami materi?
Ya, pada bagian strategi belajar, dijelaskan ilustrasi percobaan sederhana menggunakan alat dan bahan sehari-hari untuk membedakan larutan elektrolit kuat, lemah, dan nonelektrolit, yang membantu pemahaman konsep secara visual dan praktis.
Bagaimana jika saya sudah paham teori tapi masih sering salah mengerjakan soal pilihan ganda?
Panduan ini mencakup strategi analisis soal untuk berbagai tipe pertanyaan. Fokuslah pada bagian yang mengajarkan cara mengidentifikasi “jebakan” dalam soal, mengecek konsistensi satuan, dan menerapkan konsep yang tepat sesuai pertanyaan.