Perhitungan Gram Belerang dan Tembaga dalam Reaksi Tembaga Sulfida bukan sekadar angka-angka di buku kimia, melainkan kunci untuk memahami bagaimana alam bekerja dalam skala yang tak terlihat. Setiap gram tembaga yang bereaksi dengan belerang mengikuti aturan main yang ketat, sebuah tarian partikel yang diatur oleh prinsip stoikiometri. Konsep ini adalah fondasi dari segala proses kimia, dari laboratorium sekolah hingga pabrik pengolahan mineral skala industri, yang menentukan efisiensi dan keberhasilan suatu reaksi.
Mari kita telusuri bagaimana hukum kekekalan massa dan konsep mol menjadi panduan utama dalam menghitung proporsi yang tepat antara kedua unsur ini. Dengan memahami dasar perhitungan massa reaktan dan produk, kita dapat memprediksi berapa gram belerang yang dibutuhkan untuk bereaksi sempurna dengan sejumlah tembaga, atau sebaliknya, serta menganalisis pembentukan senyawa yang berbeda seperti CuS dan Cu₂S. Pengetahuan ini membuka pintu untuk aplikasi praktis yang luas dan relevan dalam dunia nyata.
Konsep Dasar Reaksi dan Stoikiometri
Reaksi kimia antara tembaga dan belerang merupakan contoh klasik dari sintesis senyawa anorganik. Ketika tembaga (Cu) yang berwarna kemerahan dipanaskan bersama belerang (S) yang berwarna kuning, akan terbentuk senyawa baru berwarna hitam keabu-abuan yang disebut tembaga sulfida. Senyawa ini dapat memiliki dua bentuk umum, yaitu tembaga(I) sulfida dengan rumus Cu₂S dan tembaga(II) sulfida dengan rumus CuS, bergantung pada kondisi reaksi dan perbandingan jumlah atom yang terlibat.Memahami stoikiometri dalam reaksi ini bukan sekadar teori, melainkan keterampilan praktis yang mendasar.
Stoikiometri adalah ilmu yang mempelajari hubungan kuantitatif antara reaktan dan produk dalam suatu reaksi kimia. Dengan menguasainya, kita dapat menjawab pertanyaan-pertanyaan krusial seperti: berapa gram belerang yang diperlukan untuk mengubah 10 gram tembaga menjadi tembaga sulfida secara sempurna, tanpa ada sisa? Atau, dari 50 gram tembaga sulfida, berapa massa tembaga murni yang dapat diperoleh kembali? Prinsip ini juga berlaku luas untuk reaksi pembentukan sulfida logam lain, misalnya dalam pembentukan besi sulfida (FeS) dari serbuk besi dan belerang, atau pembentukan seng sulfida (ZnS) yang memiliki aplikasi dalam industri.
Dasar Teori Perhitungan Massa
Setiap perhitungan stoikiometri berlandaskan pada hukum kekekalan massa yang dicetuskan oleh Antoine Lavoisier. Hukum ini menyatakan bahwa massa zat sebelum dan sesudah reaksi kimia adalah tetap. Artinya, atom-atom tidak dapat diciptakan atau dimusnahkan, hanya diatur ulang. Jika 16 gram tembaga bereaksi dengan belerang, maka massa tembaga sulfida yang dihasilkan ditambah dengan sisa reaktan yang tidak terpakai (jika ada) harus tetap 16 gram plus massa belerang yang bereaksi.Untuk menghitung dalam skala makroskopik (gram) yang dapat kita timbang, kita membutuhkan jembatan menuju dunia mikroskopik (atom).
Perhitungan gram belerang dan tembaga dalam reaksi tembaga sulfida, selain penting dalam stoikiometri, juga mengingatkan kita pada dinamika unsur di alam. Siklus kimiawi ini mirip dengan perjalanan Air yang tersimpan dalam tanah selanjutnya menjadi sumber vital bagi ekosistem. Kembali ke lab, presisi perhitungan massa reaktan ini menjadi kunci utama dalam sintesis senyawa anorganik dan analisis kuantitatif.
Di sinilah konsep mol berperan. Satu mol didefinisikan sebagai jumlah zat yang mengandung partikel elementer (atom, molekul, ion) sebanyak atom yang terdapat dalam 12 gram karbon-12. Jumlah partikel dalam satu mol ini adalah konstanta Avogadro, yaitu 6.022 x 10²³. Massa molar adalah massa dari satu mol suatu zat, yang nilainya sama dengan massa atom relatif (Ar) atau massa molekul relatif (Mr) yang dinyatakan dalam gram per mol (g/mol).
Konsep ini adalah kunci untuk mengkonversi antara massa dan jumlah partikel.
| Unsur/Senyawa | Massa Atom Relatif (Ar) | Massa Molar (g/mol) | Wujud Standar |
|---|---|---|---|
| Tembaga (Cu) | 63.55 | 63.55 g/mol | Padatan logam, merah kecoklatan |
| Belerang (S) | 32.07 | 32.07 g/mol | Padatan non-logam, kuning |
| Tembaga(II) Sulfida (CuS) | Mr = 63.55 + 32.07 = 95.62 | 95.62 g/mol | Padatan kristalin, hitam |
| Tembaga(I) Sulfida (Cu₂S) | Mr = (2×63.55) + 32.07 = 159.17 | 159.17 g/mol | Padatan kristalin, hitam keabu-abuan |
Prosedur Perhitungan Gram Belerang dan Tembaga
Perhitungan stoikiometri mengikuti alur logis yang sistematis. Misalkan kita ingin menghitung massa belerang yang diperlukan untuk bereaksi sempurna dengan 31.775 gram tembaga membentuk CuS. Pertama, pastikan persamaan reaksi sudah setara: Cu + S → CuS. Kedua, konversi massa tembaga yang diketahui menjadi mol menggunakan massa molarnya. Ketiga, gunakan perbandingan koefisien dari persamaan reaksi yang setara untuk menemukan mol belerang yang diperlukan.
Keempat, konversi mol belerang tersebut kembali ke dalam satuan gram.
Rumus inti: Mol = Massa (g) / Massa Molar (g/mol)Perbandingan mol = Perbandingan koefisien reaksi.
Untuk kasus sebaliknya, menghitung massa tembaga yang diperlukan untuk membuat sejumlah gram tembaga sulfida, langkahnya serupa tetapi dimulai dari massa produk. Konversi massa CuS ke mol, tentukan mol Cu berdasarkan perbandingan koefisien (1:1 untuk CuS), lalu konversi mol Cu menjadi gram. Prosedur ini dapat divisualisasikan dalam bagan alur sederhana.
- Mulai dengan data yang diketahui (massa reaktan atau produk).
- Konversi data massa tersebut menjadi mol menggunakan massa molar zat tersebut.
- Gunakan perbandingan koefisien dari persamaan reaksi setara sebagai rasio mol untuk menghitung mol zat yang ditanyakan.
- Konversi mol zat yang ditanyakan menjadi massa menggunakan massa molarnya.
- Verifikasi satuan dan logika hasil perhitungan.
Analisis Variasi Senyawa Tembaga Sulfida
Perbedaan rumus kimia antara CuS dan Cu₂S membawa implikasi stoikiometri yang signifikan. Dalam CuS, satu atom tembaga berikatan dengan satu atom belerang, sedangkan dalam Cu₂S, dua atom tembaga berikatan dengan satu atom belerang. Hal ini menyebabkan perbandingan massa dan komposisi persen massa tembaga dalam senyawa menjadi berbeda. Perhitungan yang tidak mempertimbangkan jenis senyawa sulfida yang terbentuk akan menghasilkan jawaban yang keliru.
| Senyawa | Rumus Molekul | Massa Molar (g/mol) | Komposisi % Massa Tembaga |
|---|---|---|---|
| Tembaga(II) Sulfida | CuS | 95.62 | (63.55 / 95.62) × 100% = 66.46% |
| Tembaga(I) Sulfida | Cu₂S | 159.17 | (127.10 / 159.17) × 100% = 79.85% |
Pembentukan senyawa sulfida tertentu ditentukan oleh beberapa faktor, terutama kondisi reaksi seperti suhu dan ketersediaan oksigen. Tembaga(I) sulfida (Cu₂S) lebih stabil pada suhu tinggi dan sering ditemukan dalam mineral seperti kalkosit. Sementara itu, tembaga(II) sulfida (CuS) ditemukan dalam mineral kovelit. Dalam sintesis laboratorium, perbandingan awal massa tembaga dan belerang serta kontrol terhadap atmosfer reaksi (inert atau tidak) sangat menentukan produk akhir.
Contoh Soal dan Penyelesaian Terperinci
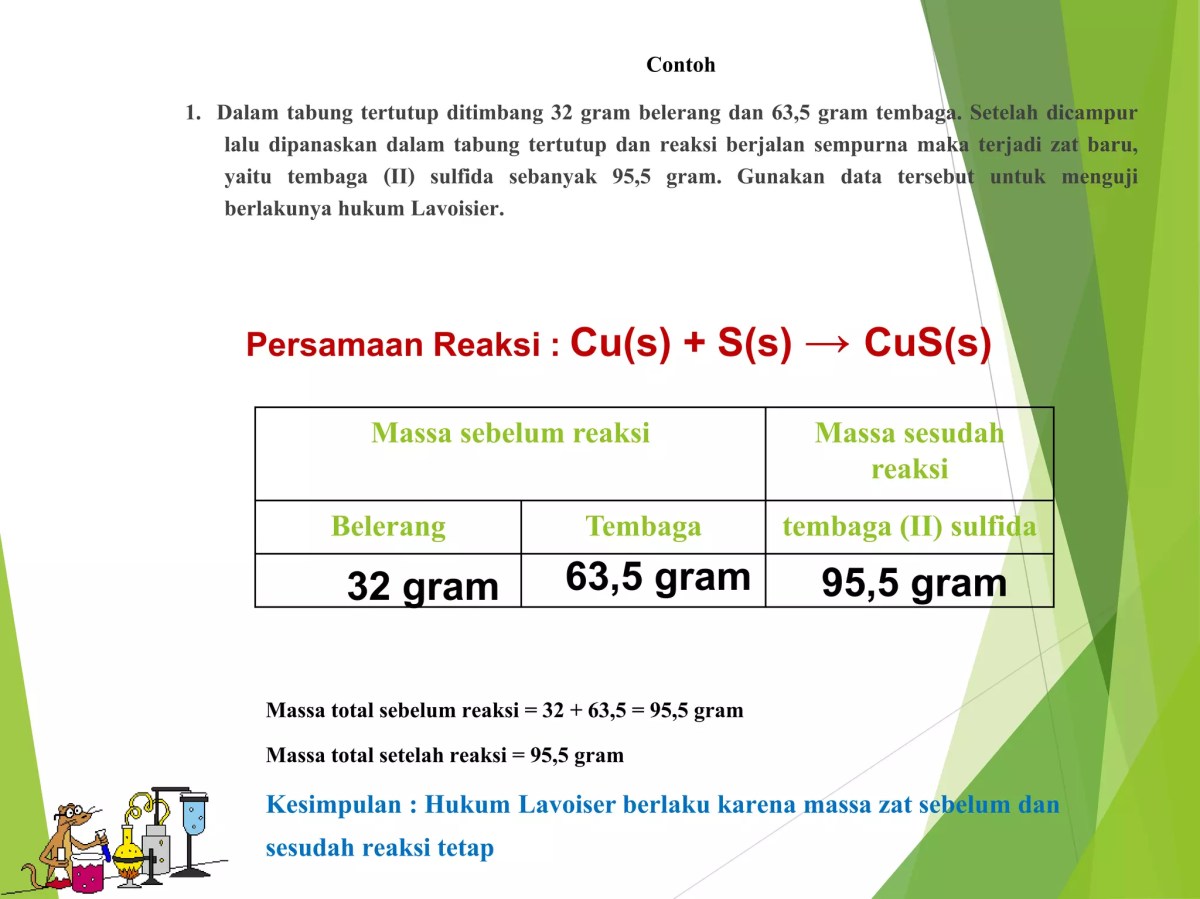
Source: slidesharecdn.com
Sebuah contoh soal dapat memperjelas penerapan langkah-langkah yang telah diuraikan. Perhatikan soal berikut: Berapa gram belerang yang dibutuhkan untuk mengubah 50.0 gram tembaga menjadi tembaga(I) sulfida (Cu₂S), dan berapa massa Cu₂S yang dihasilkan? Asumsikan reaksi berlangsung sempurna.Pertama, kita tuliskan dan setarakan persamaan reaksi untuk pembentukan Cu₂S: 2Cu + S → Cu₂S. Data yang diketahui adalah massa Cu = 50.0 gram.
Massa molar Cu = 63.55 g/mol, S = 32.07 g/mol, dan Cu₂S = 159.17 g/mol.
Langkah 1: Mol Cu = Massa Cu / Massa Molar Cu = 50.0 g / 63.55 g/mol ≈ 0.7868 mol.
Berdasarkan persamaan reaksi, perbandingan koefisien Cu : S adalah 2 : 1. Oleh karena itu, mol S yang dibutuhkan adalah setengah dari mol Cu.
Langkah 2: Mol S = (1/2) × mol Cu = (1/2) × 0.7868 mol ≈ 0.3934 mol.Langkah 3: Massa S = Mol S × Massa Molar S = 0.3934 mol × 32.07 g/mol ≈ 12.6 gram.
Perhitungan massa belerang dan tembaga dalam reaksi tembaga sulfida memerlukan ketelitian stoikiometri yang presisi, serupa dengan cara kita menganalisis dimensi ruang dalam Bidang Diagonal Balok Berbentuk. Pemahaman geometri ruang itu membantu visualisasi struktur molekul, yang pada akhirnya kembali menjadi fondasi untuk menentukan komposisi gram setiap unsur dalam senyawa tersebut secara akurat dan otoritatif.
Untuk menghitung massa Cu₂S, kita gunakan perbandingan koefisien Cu : Cu₂S = 2 : 1. Jadi, mol Cu₂S yang terbentuk adalah setengah dari mol Cu.
Langkah 4: Mol Cu₂S = (1/2) × mol Cu = 0.3934 mol.Langkah 5: Massa Cu₂S = Mol Cu₂S × Massa Molar Cu₂S = 0.3934 mol × 159.17 g/mol ≈ 62.6 gram.
Sebagai latihan, coba kerjakan soal ini: Jika 20.0 gram belerang direaksikan dengan tembaga berlebih untuk membentuk CuS, berapa massa tembaga yang bereaksi dan massa CuS yang dihasilkan?
- Mulai dengan massa S, konversi ke mol S.
- Gunakan perbandingan koefisian 1 S : 1 Cu : 1 CuS dari persamaan Cu + S → CuS.
- Tentukan mol Cu yang bereaksi dan mol CuS yang terbentuk (sama dengan mol S).
- Konversi mol Cu dan mol CuS menjadi massa menggunakan massa molar masing-masing.
Aplikasi dan Relevansi dalam Konteks Nyata
Reaksi pembentukan tembaga sulfida bukan hanya eksperimen laboratorium sekolah. Dalam industri pengolahan mineral tembaga, bijih yang mengandung tembaga sering kali dalam bentuk sulfida seperti kalkopirit (CuFeS₂). Proses pemanggangan (roasting) bijih ini melibatkan reaksi terkontrol dengan oksigen untuk mengubah sulfida menjadi oksida dan sulfur dioksida, yang kemudian tembaga dimurnikan lebih lanjut. Perhitungan stoikiometri yang tepat pada setiap tahap ini sangat penting untuk memprediksi hasil, mengoptimalkan penggunaan bahan bakar dan reagen, serta mengendalikan emisi gas SO₂ yang berdampak lingkungan.Di laboratorium analitik, prinsip stoikiometri digunakan dalam metode gravimetri untuk menentukan kemurnian sampel.
Misalnya, untuk menganalisis kadar tembaga dalam suatu larutan, tembaga dapat diendapkan sebagai tembaga sulfida. Massa endapan CuS yang diperoleh ditimbang dengan teliti, kemudian melalui perhitungan stoikiometri yang mirip dengan contoh soal, massa tembaga murni dalam sampel awal dapat ditentukan. Ketepatan perhitungan ini langsung memengaruhi penilaian kualitas bahan baku atau produk di industri farmasi, metalurgi, dan manufaktur.
Visualisasi Konseptual dan Ilustrasi: Perhitungan Gram Belerang Dan Tembaga Dalam Reaksi Tembaga Sulfida
Pada tingkat partikel, reaksi sempurna antara tembaga dan belerang dapat divisualisasikan. Sebelum reaksi, terdapat sejumlah atom tembaga (bola berwarna coklat kemerahan) dan atom belerang (bola berwarna kuning) yang terpisah. Untuk membentuk CuS, setiap atom tembaga berikatan dengan satu atom belerang. Jika kita memiliki 6 atom Cu dan 6 atom S, setelah reaksi akan terbentuk 6 molekul CuS. Untuk membentuk Cu₂S, setiap dua atom tembaga berikatan dengan satu atom belerang.
Dengan 6 atom Cu dan 3 atom S, akan terbentuk 3 molekul Cu₂S. Ilustrasi ini menegaskan hukum kekekalan massa dan perbandingan atom yang tetap.Dalam bentuk grafik, hubungan massa reaktan dan produk dapat digambarkan sebagai garis lurus yang memenuhi persamaan stoikiometri. Sumbu X mewakili massa tembaga, sumbu Y massa belerang atau massa CuS. Titik-titik pada garis tersebut menunjukkan pasangan massa yang bereaksi sempurna tanpa sisa.
Titik di atas garis menunjukkan kelebihan belerang, sedangkan titik di bawah garis menunjukkan kelebihan tembaga.Representasi skala perbandingan massa dapat dibuat sederhana dengan teks. Untuk reaksi CuS, bayangkan sebuah timbangan: di sisi kiri, satu kotak mewakili 63.55 satuan massa tembaga. Di sisi kanan, satu kotak yang sedikit lebih kecil mewakili 32.07 satuan massa belerang. Ketika digabung, mereka membentuk satu kotak besar dengan massa 95.62 satuan, yaitu CuS.
Perbandingan visual ini membantu menginternalisasi bahwa massa bukan tentang volume, tetapi tentang jumlah partikel dalam suatu zat.
Akhir Kata
Jadi, menguasai Perhitungan Gram Belerang dan Tembaga dalam Reaksi Tembaga Sulfida lebih dari sekadar menyelesaikan soal; ini adalah tentang menginternalisasi logika dasar kimia. Keterampilan ini melatih ketelitian dan berpikir sistematis, yang dapat diterjemahkan ke dalam berbagai bidang kehidupan. Dengan prinsip stoikiometri yang solid, kita tidak hanya menjadi pengamat pasif, tetapi mampu merancang, memprediksi, dan mengoptimalkan proses kimia, baik di bangku kuliah, di laboratorium riset, maupun di tengah dinamika industri pertambangan dan manufaktur.
Pertanyaan Umum yang Sering Muncul
Apakah hasil perhitungan gram akan selalu sama persis dengan hasil eksperimen di lab?
Tidak selalu. Perhitungan teoritis mengasumsikan reaksi berlangsung sempurna dan bahan 100% murni. Dalam praktiknya, faktor seperti efisiensi reaksi, kemurnian sampel, dan kehilangan material selama proses dapat menyebabkan sedikit perbedaan antara hasil hitung dan hasil ukur.
Bagaimana jika jumlah gram tembaga dan belerang yang dicampur tidak sesuai perhitungan stoikiometri?
Maka akan ada reaktan yang tersisa (bereaksi berlebih). Reaksi hanya akan menggunakan salah satu reaktan hingga habis, sementara reaktan lain yang berlebih tidak akan bereaksi dan tetap sebagai sisa. Reaktan yang habis terlebih dahulu disebut pereaksi pembatas.
Perhitungan stoikiometri dalam reaksi tembaga sulfida, yang menentukan gram belerang dan tembaga, mengingatkan kita pada presisi harmoni alam. Seperti halnya dalam arsitektur suci, misalnya pada Stupa, Lambang Nirwana Bagi Para Dewa , setiap proporsi memiliki makna mendalam yang tertata sempurna. Kembali ke laboratorium, ketepatan hitungan massa unsur-unsur ini menjadi fondasi utama dalam menganalisis senyawa anorganik, layaknya fondasi spiritual yang kokoh.
Apakah perhitungan ini hanya berlaku untuk tembaga dan belerang padat?
Tidak. Prinsip stoikiometri bersifat universal. Namun, jika wujud zat berbeda (misalnya, gas atau larutan), perhitungan mungkin melibatkan volume atau molaritas, bukan hanya massa gram. Inti perhitungan berdasarkan perbandingan mol tetap sama.
Mengapa penting membedakan antara CuS dan Cu₂S dalam perhitungan?
Karena kedua senyawa itu berbeda secara kimiawi dengan massa molar dan komposisi persen massa yang berbeda. Menggunakan rumus yang salah akan menghasilkan perhitungan gram reaktan yang salah pula, yang berujung pada ketidakefisienan atau kegagalan reaksi yang diinginkan.


