Konversi 30,1×10²³ partikel Kalium ke mol bukan sekadar soal angka, melainkan pintu masuk untuk memahami bahasa universal kimia yang berbicara dalam satuan mol. Dalam dunia partikel yang tak terlihat, satuan ini menjadi jembatan penting yang menghubungkan skala mikroskopis atom dengan realitas makroskopis yang bisa kita ukur di laboratorium. Perhitungan ini mengungkap keteraturan alam melalui konstanta fundamental, Bilangan Avogadro, yang memungkinkan ilmuwan menimbang dan menghitung atom seolah-olah mereka butiran pasir.
Konversi 30,1×10²³ partikel Kalium menjadi 5 mol, analog dengan prinsip mencari konsensus dalam Arti dan Tujuan Musyawarah. Sama seperti musyawarah yang mengutamakan kebersamaan, perhitungan stoikiometri ini mengacu pada bilangan Avogadro (6,02×10²³) sebagai standar universal. Dengan demikian, baik dalam kimia maupun kehidupan sosial, fondasinya adalah kesepakatan terhadap suatu nilai dasar yang telah disepakati bersama.
Angka 30,1×10²³ sendiri bukanlah bilangan acak; ia memiliki hubungan yang sangat erat dengan 6,02×10²³, nilai Bilangan Avogadro. Proses konversinya melibatkan prinsip dasar stoikiometri yang menjadi fondasi bagi berbagai perhitungan kimia, mulai dari menyiapkan larutan hingga menganalisis hasil reaksi. Melalui contoh spesifik dengan unsur Kalium ini, konsep abstrak tentang jumlah zat menjadi sesuatu yang konkret dan dapat diaplikasikan langsung.
Konsep Mol dan Hubungannya dengan Jumlah Partikel
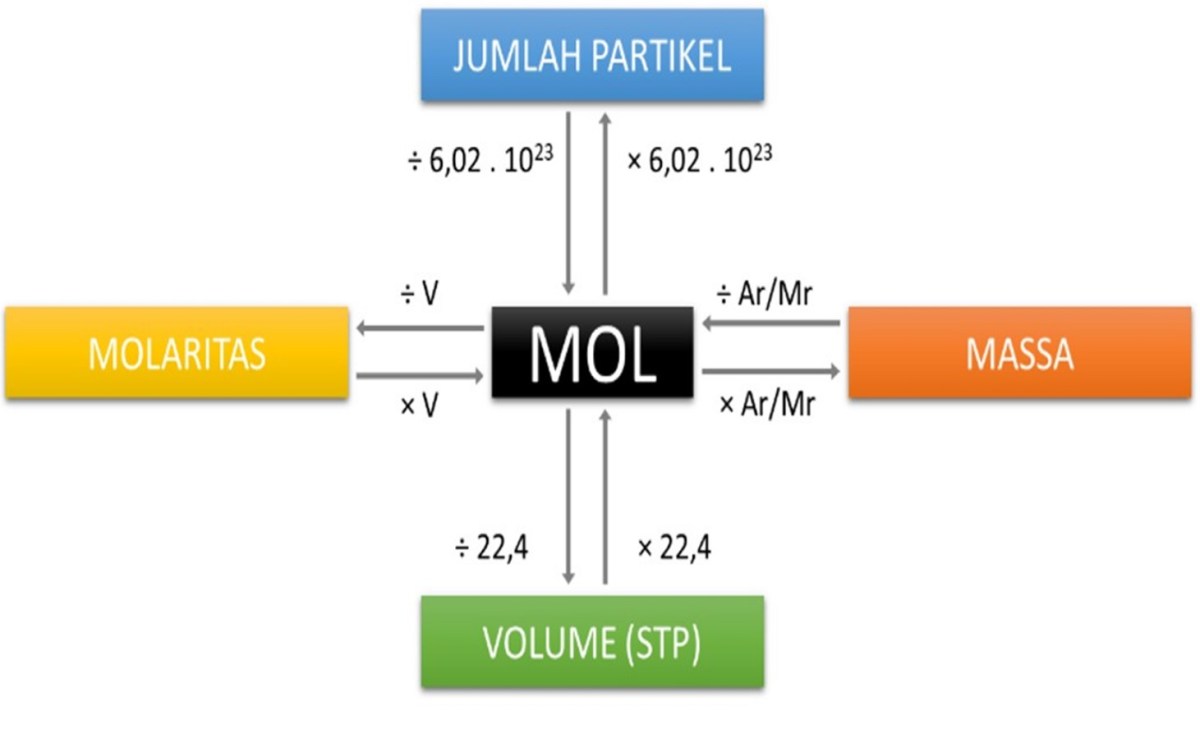
Dalam dunia kimia, kita sering kali harus berurusan dengan jumlah partikel yang sangat kecil, seperti atom dan molekul. Karena partikel-partikel ini luar biasa banyaknya, para ilmuwan membutuhkan satuan khusus untuk menghitungnya dengan praktis. Satuan itu disebut mol. Satu mol didefinisikan sebagai jumlah zat yang mengandung partikel elementer sebanyak atom yang terdapat dalam 12 gram karbon-12. Jumlah partikel dalam satu mol ini dikenal sebagai Bilangan Avogadro, dengan nilai yang sangat besar yaitu sekitar 6,02 x 10²³.
Hubungan antara mol (n), jumlah partikel (N), dan Bilangan Avogadro (L) adalah fondasi dalam perhitungan kimia. Ketiganya terikat dalam rumus sederhana: jumlah partikel sama dengan mol dikalikan Bilangan Avogadro. Dengan kata lain, untuk mengonversi jumlah partikel menjadi mol, kita membagi jumlah partikel tersebut dengan 6,02 x 10²³.
Menghitung konversi 30,1×10²³ partikel Kalium menjadi mol, yang setara dengan 5 mol, adalah fondasi dasar dalam stoikiometri. Pemahaman ini menjadi krusial ketika kita harus Setarakan Persamaan Reaksi C5H10 + O₂ dan Al + HCl untuk menentukan hubungan kuantitatif pereaksi dan produk. Dengan demikian, keakuratan konversi partikel ke mol tadi langsung teraplikasi dalam perhitungan kimia yang lebih kompleks dan presisi.
Contoh Konversi Partikel ke Mol untuk Unsur Lain
Untuk memperjelas pemahaman, berikut adalah beberapa contoh konversi jumlah partikel hipotetis menjadi mol untuk berbagai unsur. Perhitungan ini menunjukkan bagaimana rumus yang sama berlaku universal.
- Jika terdapat 12,04 x 10²³ atom besi (Fe), maka jumlah molnya adalah (12,04 x 10²³) / (6,02 x 10²³) = 2 mol Fe.
- Sebanyak 3,01 x 10²³ molekul air (H₂O) setara dengan (3,01 x 10²³) / (6,02 x 10²³) = 0,5 mol H₂O.
- Untuk 18,06 x 10²³ ion natrium (Na⁺), konversinya menghasilkan (18,06 x 10²³) / (6,02 x 10²³) = 3 mol Na⁺.
Perbandingan Jumlah Partikel, Mol, dan Massa Unsur Hipotetis
Tabel berikut membandingkan hubungan antara jumlah partikel, mol, dan massa untuk beberapa unsur dalam skenario hipotetis. Massa atom relatif (Ar) yang digunakan adalah nilai umum untuk mempermudah ilustrasi.
| Unsur (Simbol) | Jumlah Partikel | Jumlah Mol (n) | Massa (gram)* |
|---|---|---|---|
| Helium (He) | 6,02 x 10²³ | 1,00 | 4,00 |
| Karbon (C) | 3,01 x 10²³ | 0,50 | 6,00 |
| Oksigen (O) | 12,04 x 10²³ | 2,00 | 32,00 |
| Besi (Fe) | 1,505 x 10²³ | 0,25 | 14,00 |
*Massa dihitung dengan rumus: Massa = n x Ar. (Ar He=4, C=12, O=16, Fe=56).
Konversi 30,1×10²³ partikel Kalium ke mol adalah penerapan langsung bilangan Avogadro, menghasilkan nilai sekitar 5 mol. Prinsip perhitungan sistematis semacam ini juga berguna dalam berbagai konteks praktis, misalnya saat mempelajari Cara Membuatnya, Terima Kasih yang memerlukan presisi serupa. Dengan demikian, penguasaan konsep mol dan konversi partikel menjadi fondasi krusial dalam dunia kimia analitik.
Mengurai Konversi 30,1×10²³ Partikel Kalium
Mari kita fokus pada soal inti: mengonversi 30,1 x 10²³ partikel Kalium menjadi satuan mol. Angka ini bukanlah angka acak; ia memiliki hubungan yang sangat erat dengan Bilangan Avogadro. Dengan memahami hubungan ini, perhitungan menjadi jauh lebih sederhana dan intuitif.
Langkah-langkah Perhitungan Konversi
Proses konversi mengikuti rumus dasar: mol = jumlah partikel / Bilangan Avogadro. Nilai 30,1 x 10²³ dapat dilihat sebagai 5 kali lipat dari 6,02 x 10²³, karena 5 x 6,02 = 30,1. Ini membuat perhitungan menjadi sangat jelas. Berikut adalah jabaran langkah demi langkahnya.
Diketahui:
Jumlah partikel Kalium (N) = 30,1 × 10²³
Bilangan Avogadro (L) = 6,02 × 10²³ partikel/molRumus:
n = N / LSubstitusi nilai:
n = (30,1 × 10²³) / (6,02 × 10²³)Penyederhanaan:
n = 30,1 / 6,02
n = 5
Dari perhitungan terstruktur di atas, diperoleh hasil yang tepat. Nilai akhir konversi 30,1 x 10²³ partikel Kalium adalah 5 mol Kalium (5 mol K). Satuan “mol” harus selalu disertakan untuk menunjukkan besaran jumlah zat.
Hubungan Spesial dengan Bilangan Avogadro
Angka 30,1 x 10²³ memiliki hubungan spesial karena merupakan kelipatan bulat (lima kali) dari bilangan Avogadro (6,02 x 10²³). Dalam praktik soal kimia, sering kali angka yang diberikan dirancang agar mudah dibagi dengan 6,02, menghasilkan nilai mol yang bulat atau sederhana seperti 0,5; 2; 5; atau 10. Ini memudahkan proses belajar dan penghitungan manual sebelum beralih ke kasus dengan angka yang lebih kompleks.
Penerapan dalam Beragam Perhitungan Kimia
Penguasaan konversi partikel ke mol adalah gerbang untuk menyelesaikan berbagai perhitungan stoikiometri yang lebih advance, seperti mencari massa, volume gas, atau molaritas larutan. Kemampuan ini sangat krusial dalam merancang dan menganalisis percobaan di laboratorium.
Variasi Soal Latihan Konversi
Berikut tiga soal latihan dengan tingkat kesulitan berbeda untuk mengasah kemampuan. Soal-soal ini dirancang untuk mensimulasikan situasi nyata dalam perhitungan kimia.
- Tingkat Dasar: Hitung jumlah mol dari 9,03 x 10²³ molekul gula (C₁₂H₂₂O₁₁).
- Tingkat Menengah: Sebuah sampel mengandung 4,816 x 10²⁴ atom emas (Au). Tentukan massa sampel tersebut dalam gram.
- Tingkat Lanjut: Dalam suatu reaksi, dihasilkan 1,204 x 10²² unit formula garam dapur (NaCl). Berapakah massa NaCl yang dihasilkan, dan berapa jumlah ion klorida (Cl⁻) yang ada?
Penyelesaian Soal Latihan
Tabel berikut merangkum penyelesaian untuk ketiga soal latihan tersebut. Perhatikan bagaimana dari jumlah partikel, kita dapat melangkah ke besaran mol dan akhirnya ke massa dengan menggunakan massa molar (Mr).
| Soal | Jumlah Partikel | Jumlah Mol (n) | Massa Molar (Mr) & Hasil Massa |
|---|---|---|---|
| 1 (C₁₂H₂₂O₁₁) | 9,03 x 10²³ | 1,5 mol | Mr = 342 g/mol. Massa = 1,5 mol x 342 g/mol = 513 gram. |
| 2 (Au) | 4,816 x 10²⁴ | 8 mol | Ar Au = 197 g/mol. Massa = 8 mol x 197 g/mol = 1576 gram. |
| 3 (NaCl) | 1,204 x 10²² | 0,02 mol | Mr NaCl = 58,5 g/mol. Massa NaCl = 1,17 gram. Ion Cl⁻ = 1,204 x 10²² ion. |
Implikasi dalam Percobaan Laboratorium
Mengetahui jumlah mol suatu zat adalah kunci dalam laboratorium. Saat kita menimbang 5 mol Kalium (sekitar 195 gram, karena Ar K=39), kita sebenarnya sedang menyiapkan reaktan dengan jumlah partikel yang sangat spesifik, yaitu 30,1 x 10²³ atom. Presisi ini menentukan rasio pereaksi dalam reaksi, hasil teoritis produk, dan konsentrasi larutan yang dibuat. Kesalahan dalam konversi ini dapat menyebabkan reaksi tidak sempurna, limbah bahan, atau bahkan hasil eksperimen yang tidak valid.
Visualisasi dan Pemahaman Konseptual yang Mendalam: Konversi 30,1×10²³ Partikel Kalium Ke Mol
Memahami bilangan yang sangat besar seperti 6,02 x 10²³ membutuhkan analogi. Bayangkan satu mol butir pasir. Jika satu butir pasir adalah satu atom, maka satu mol butir pasir akan cukup untuk menutupi seluruh permukaan bumi dengan lapisan setebal beberapa meter. Itulah skala yang kita bicarakan ketika membahas mol.
Skala Perbandingan dengan Objek Sehari-hari
Source: ac.id
Untuk memberikan gambaran intuitif tentang 30,1 x 10²³ partikel (atau 5 mol), mari kita buat perbandingan. Jika satu butir beras memiliki massa sekitar 0,02 gram, maka 5 mol butir beras (3,01 x 10²⁴ butir) akan memiliki massa yang jauh lebih besar dari seluruh produksi beras dunia selama bertahun-tahun. Analogi ini menegaskan bahwa meski partikel atom sangat kecil, kumpulannya dalam skala mol menjadi besaran makroskopik yang dapat diukur dan ditimbang.
Posisi Kalium dalam Tabel Periodik, Konversi 30,1×10²³ partikel Kalium ke mol
Kalium (K) terletak pada Golongan 1 (Logam Alkali) dan Periode 4 dalam tabel periodik. Massa atom relatifnya (Ar) yang tercantum, sekitar 39,10, merupakan rata-rata tertimbang dari isotop-isotop alaminya. Nilai inilah yang digunakan sebagai faktor konversi krusial setelah kita mendapatkan jumlah mol. Dari 5 mol Kalium, kita dapat langsung menghitung massanya: Massa = 5 mol x 39,10 g/mol = 195,5 gram.
Poin-Poin Kunci Hubungan Partikel, Mol, dan Massa
Keseluruhan pembahasan dapat diringkas dalam tiga hubungan fundamental yang harus dikuasai dalam stoikiometri.
- Partikel ke Mol: Jumlah mol diperoleh dengan membagi jumlah partikel dengan Bilangan Avogadro (6,02 x 10²³).
- Mol ke Massa: Massa suatu zat (dalam gram) dihitung dengan mengalikan jumlah mol dengan massa molar (Ar atau Mr) zat tersebut.
- Mol sebagai Jembatan: Satuan mol berfungsi sebagai jembatan yang menghubungkan dunia mikroskopis (atom, molekul) dengan dunia makroskopis (gram, liter) yang dapat kita ukur di laboratorium.
Penutup
Dengan demikian, mengonversi 30,1×10²³ partikel Kalium menjadi tepat 5 mol bukanlah akhir perjalanan, melainkan awal dari eksplorasi yang lebih dalam. Penguasaan konsep ini membuka kemampuan untuk memprediksi massa zat, volume gas pada kondisi tertentu, dan konsentrasi larutan. Dalam setiap tetes reaksi kimia, dari yang terjadi di tubuh kita hingga di pabrik industri, pemahaman tentang mol dan Bilangan Avogadro tetap menjadi kunci penafsiran yang tak tergantikan, mengubah kerumitan dunia atom menjadi logika perhitungan yang elegan dan powerful.
Daftar Pertanyaan Populer
Apakah hasil konversi 30,1×10²³ partikel selalu berupa bilangan bulat?
Tidak selalu. Hasilnya berupa bilangan bulat (5 mol) dalam kasus ini karena angka 30,1×10²³ merupakan kelipatan persis dari Bilangan Avogadro. Jika jumlah partikelnya sembarang, seperti 12,7×10²³, hasilnya akan berupa bilangan desimal.
Mengapa harus dikonversi ke mol? Tidak bisa langsung dari partikel ke gram?
Mol adalah satuan yang menghubungkan jumlah partikel dengan massa yang dapat diukur. Tidak mungkin menimbang atom secara langsung. Massa atom relatif (Ar) dalam tabel periodik dinyatakan dalam satuan gram per mol, sehingga konversi ke mol terlebih dahulu adalah langkah wajib untuk mencari massa.
Bagaimana jika yang dikonversi adalah partikel senyawa, bukan unsur seperti Kalium?
Prinsipnya sama persis. Satu mol suatu senyawa mengandung 6,02×10²³ molekul senyawa tersebut. Perbedaan baru muncul saat menghitung massa, di mana massa molar senyawa adalah jumlah total massa atom semua unsur penyusunnya.
Apakah Bilangan Avogadro (6,02×10²³) nilainya selalu tetap dan pasti?
Ya, 6,02214076×10²³ per mol adalah konstanta fundamental yang nilainya telah ditetapkan secara internasional dan digunakan dalam sistem satuan SI. Nilai ini merupakan jumlah atom dalam tepat 12 gram karbon-12.