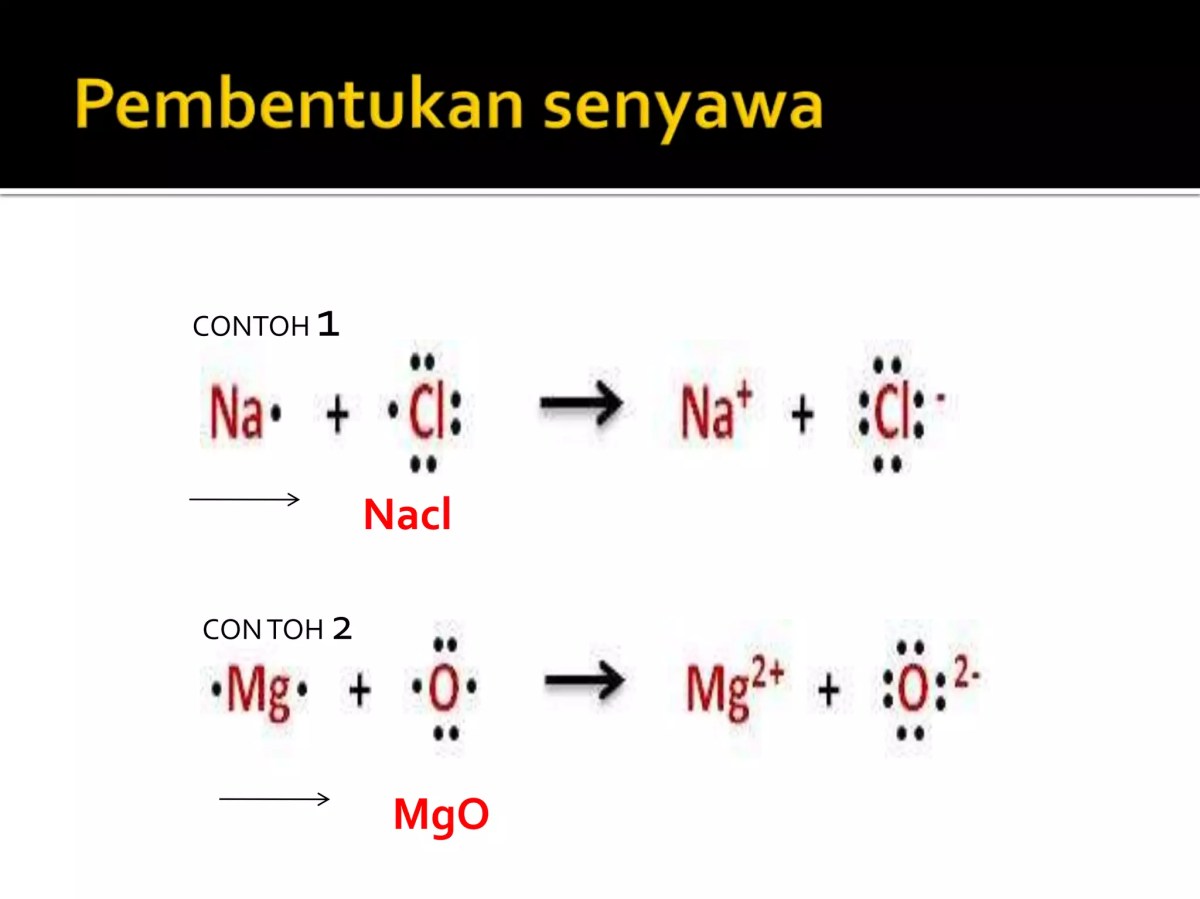
Struktur Lewis SiCl₂ dan H₃PO₄ membuka tabir keajaiban tatanan semesta pada tingkat molekuler. Setiap titik dan garis yang digambar bukan sekadar simbol, melainkan peta penuntun yang mengungkap cerita tentang bagaimana atom-atom saling merangkul, berbagi, dan membentuk realitas materi di sekitar kita. Memahami bahasa visual ini adalah langkah pertama untuk menyelami harmoni tersembunyi dalam setiap zat.
Dengan mempelajari struktur Lewis, kita dapat memprediksi sifat, bentuk, dan perilaku molekul. Dua contoh menarik, SiCl₂ dan H₃PO₄, mewakili kisah yang berbeda. Yang satu menantang aturan klasik, sementara yang lain menunjukkan kerumitan dan keanggunan ikatan koordinat. Melalui mereka, kita diajak untuk mengapresiasi logika mendalam yang mengatur interaksi kimia.
Pengantar dan Konsep Dasar Struktur Lewis
Dalam mempelajari ikatan kimia, kita butuh cara untuk menggambarkan bagaimana elektron-elektron valensi, yaitu elektron di kulit terluar, tersusun di antara atom-atom. Di sinilah struktur Lewis berperan. Secara sederhana, struktur Lewis adalah diagram yang menunjukkan ikatan antar atom dalam suatu molekul atau ion, serta keberadaan pasangan elektron bebas (lone pair). Tujuannya adalah untuk memberikan gambaran visual yang intuitif tentang distribusi elektron, yang pada akhirnya membantu kita memprediksi bentuk molekul, kepolaran, dan reaktivitas senyawa.
Aturan umum menggambar struktur Lewis berpusat pada konsep oktet, di mana atom-atom cenderung untuk dikelilingi oleh delapan elektron valensi agar stabil, meniru konfigurasi gas mulia. Langkah-langkahnya dimulai dengan menghitung total elektron valensi dari semua atom. Kemudian, susun atom-atom dengan atom yang kurang elektronegatif (seringkali) sebagai atom pusat. Hubungkan atom-atom dengan ikatan tunggal (setiap ikatan menggunakan 2 elektron), lalu distribusikan sisa elektron untuk memenuhi kaidah oktet setiap atom.
Atom hidrogen merupakan pengecualian, ia hanya membutuhkan 2 elektron (duplet) untuk stabil.
Contoh Penerapan pada Molekul Diatomik
Mari kita lihat contoh klasik molekul klorin, Cl₂. Setiap atom Cl memiliki 7 elektron valensi, sehingga total elektron valensi adalah
14. Kita tempatkan kedua atom Cl berdampingan dan hubungkan dengan satu ikatan tunggal (menggunakan 2 elektron). Sisa 12 elektron kemudian ditempatkan sebagai pasangan elektron bebas, 6 pasang, di sekitar masing-masing atom Cl. Setelah distribusi, setiap atom Cl kini dikelilingi oleh 8 elektron: 2 dari ikatan bersama dan 6 dari tiga pasangan elektron bebas.
Struktur ini memenuhi aturan oktet dan menggambarkan ikatan kovalen tunggal yang membentuk molekul Cl₂.
Analisis Senyawa SiCl₂: Struktur dan Karakteristik
Senyawa SiCl₂, atau diklorosilen, adalah contoh menarik di mana atom pusat tidak memenuhi aturan oktet penuh. Senyawa ini relatif reaktif dan cenderung berpolimerisasi atau bereaksi lebih lanjut karena ketidakstabilannya. Analisis struktur Lewis-nya memberikan penjelasan mendasar untuk sifat-sifat tersebut.
Silikon (Si) berada di golongan 14 dengan 4 elektron valensi, sedangkan setiap klorin (Cl, golongan 17) memiliki 7 elektron valensi. Total elektron valensi untuk SiCl₂ adalah 4 (dari Si) + (2 x 7) dari Cl = 18 elektron. Jika kita menggambar struktur dengan Si di tengah dan dua atom Cl terikat padanya melalui ikatan tunggal, kita telah menggunakan 4 elektron (2 ikatan x 2 elektron).
Sisa 14 elektron ditempatkan sebagai pasangan bebas pada atom Cl. Setelah setiap atom Cl mendapatkan tiga pasangan bebas (6 elektron) ditambah 2 elektron dari ikatan, mereka memenuhi oktet. Namun, atom Si hanya dikelilingi oleh 4 elektron (dua ikatan tunggal). Ini adalah contoh oktet yang tidak lengkap, di mana Si hanya memiliki elektron berjumlah 4 di sekitarnya.
Bentuk Molekul dan Hibridisasi SiCl₂, Struktur Lewis SiCl₂ dan H₃PO₄
Dengan hanya dua pasangan ikatan (dua ikatan Si-Cl) dan tidak ada pasangan elektron bebas pada atom pusat Si, bentuk molekul SiCl₂ adalah bengkok atau bentuk V. Hibridisasi atom silikon dapat diturunkan dari jumlah domain elektron di sekitarnya, yang dalam hal ini adalah dua. Dua domain elektron mengindikasikan hibridisasi sp. Sudut ikatan Cl-Si-Cl diperkirakan mendekati 120° jika hibridisasi murni sp, namun karena tolakan dari pasangan elektron bebas yang tidak terisi orbital hibrida (atau pengaruh ukuran atom), sudut aktualnya biasanya lebih kecil, sekitar 103°.
Perbandingan dengan Senyawa Silikon Klorida Lain
Perbedaan struktur Lewis antara SiCl₂ dan senyawa seperti SiCl₄ (silikon tetraklorida) menjelaskan perbedaan sifat yang signifikan. Berikut tabel perbandingannya.
| Senyawa | Struktur Lewis | Oktet Atom Pusat | Kestabilan & Reaktivitas |
|---|---|---|---|
| SiCl₂ | Si terikat dua Cl, oktet tidak lengkap (4 elektron). | Tidak terpenuhi | Sangat reaktif, mudah berpolimerisasi atau bereaksi dengan nukleofil. |
| SiCl₄ | Si terikat empat Cl, dikelilingi 8 elektron (4 ikatan tunggal). | Terpenuhi | Stabil, cairan tak berwarna yang mudah menguap, bereaksi dengan air (hidrolisis) tetapi stabil di udara kering. |
Analisis Senyawa H₃PO₄: Struktur, Ikatan, dan Keunikan
Source: slidesharecdn.com
Asam fosfat, H₃PO₄, adalah asam anorganik penting dengan struktur Lewis yang sedikit lebih kompleks karena melibatkan ikatan koordinat. Atom fosfor (P) sebagai atom pusat memiliki kemampuan untuk memperluas oktetnya karena berada di periode ketiga, memungkinkannya menampung lebih dari 8 elektron di kulit valensinya.
Mari kita hitung elektron valensinya: Fosfor (P, golongan 15) = 5 elektron, Oksigen (O, golongan 16) = 6 elektron (ada 4 atom O, total 24), Hidrogen (H) = 1 elektron (ada 3 atom H, total 3). Jumlah total elektron valensi adalah 5 + 24 + 3 = 32 elektron. Struktur Lewis yang akurat menunjukkan bahwa satu atom oksigen terikat ganda dengan fosfor (P=O), tiga atom oksigen lainnya masing-masing terikat tunggal dengan fosfor, dan dari ketiga atom oksigen yang terikat tunggal ini, tiga di antaranya juga mengikat atom hidrogen.
Untuk memenuhi oktet semua atom (kecuali H yang duplet), diperlukan satu ikatan koordinat (datif) dari P ke salah satu atom O yang terikat H.
Ikatan Koordinat dan Muatan Formal
Dalam struktur kanonik H₃PO₄, kita dapat menggambarkan fosfor membentuk ikatan tunggal dengan empat atom oksigen. Salah satu ikatan P-O ini adalah ikatan koordinat, di mana fosfor menyumbangkan kedua elektron untuk ikatan tersebut. Pemberian ini terjadi karena fosfor memiliki orbital d kosong yang dapat menerima kerapatan elektron balik. Analisis muatan formal menunjukkan bahwa atom fosfor memiliki muatan formal +1, atom oksigen yang menerima ikatan koordinat (dan terikat H) memiliki muatan formal -1, sedangkan atom oksigen yang berikatan ganda (P=O) memiliki muatan formal 0.
Struktur ini bersifat resonansi, menyebarkan muatan di seluruh anion fosfat.
Peran Atom Oksigen dalam Molekul H₃PO₄
Keberadaan atom oksigen dengan lingkungan ikatan yang berbeda inilah yang mendasari sifat asam dari H₃PO₄.
- Oksigen yang Terikat Hidrogen (P-OH): Terdapat tiga gugus seperti ini. Ikatan O-H inilah yang bersifat polar dan labil. Atom H dalam ikatan ini dapat dilepaskan sebagai ion H⁺ (proton), yang merupakan definisi langsung dari asam Brønsted-Lowry. Oksigen ini biasanya membawa muatan parsial negatif setelah pelepasan proton.
- Oksigen yang Tidak Terikat Hidrogen (P=O): Ikatan rangkap dua P=O ini sangat polar karena perbedaan keelektronegatifan. Oksigen ini menarik kerapatan elektron dengan kuat, mengakibatkan atom fosfor menjadi lebih positif. Hal ini secara tidak langsung memperlemah ikatan O-H pada gugus P-OH di sekitarnya, memfasilitasi pelepasan proton.
Perbandingan dan Kontras antara SiCl₂ dan H₃PO₄
Meskipun keduanya merupakan senyawa kovalen, SiCl₂ dan H₃PO₄ menunjukkan perbedaan mendasar yang dapat dilacak dari struktur Lewis mereka. Perbandingan ini menyoroti bagaimana konfigurasi elektron valensi memengaruhi segala hal, mulai dari kestabilan hingga sifat kimia.
| Aspek | SiCl₂ | H₃PO₄ |
|---|---|---|
| Total Elektron Valensi | 18 elektron | 32 elektron |
| Kepatuhan Aturan Oktet | Oktet tidak lengkap pada Si (4 elektron). | Oktet diperluas pada P (10 elektron di sekelilingnya). |
| Jenis Ikatan Dominan | Ikatan kovalen tunggal Si-Cl. | Campuran ikatan kovalen tunggal (P-O, O-H), satu ikatan rangkap (P=O), dan satu ikatan koordinat. |
| Geometri Molekul | Bentuk bengkok (V). | Geometri tetrahedral di sekitar atom P (jika menganggap empat ikatan P-O sebagai domain). |
Perbedaan Kepolaran Molekul
Kepolaran molekul ditentukan oleh bentuk dan perbedaan keelektronegatifan. SiCl₂ bersifat polar karena bentuknya yang bengkok. Momen dipol dari dua ikatan Si-Cl yang polar tidak saling meniadakan karena sudutnya kurang dari 180°. Di sisi lain, H₃PO₄ juga sangat polar, tetapi alasannya berbeda. Meskipun geometri di sekitar P mendekati tetrahedral yang bisa jadi nonpolar jika simetris, keberadaan atom H yang terikat pada O dan ikatan P=O yang sangat polar menciptakan distribusi muatan yang sangat tidak simetris.
Perbedaan keelektronegatifan P-O dan terutama O-H jauh lebih besar daripada Si-Cl, sehingga H₃PO₄ memiliki kepolaran yang lebih tinggi, yang berkontribusi pada kemampuannya berinteraksi dengan air dan melepas proton.
H₃PO₄ bersifat asam karena struktur Lewis-nya memiliki atom hidrogen yang terikat pada oksigen (gugus O-H) dengan ikatan yang sangat polar akibat tarikan elektron dari atom fosfor yang positif dan ikatan P=O. Polaritas tinggi ini memudahkan ikatan O-H untuk terputus dan mendonorkan proton (H⁺). Sebaliknya, SiCl₂ tidak memiliki atom H yang terikat pada atom yang elektronegatif seperti O atau N; ikatan Si-Cl meskipun polar, tidak melibatkan H yang mudah dilepas, sehingga senyawa ini tidak bersifat asam Brønsted-Lowry, melainkan lebih cenderung mengalami hidrolisis.
Visualisasi dan Penulisan Struktur yang Benar
Menggambar struktur Lewis dengan langkah sistematis membantu menghindari kesalahan dan memastikan keakuratan. Berikut adalah panduan untuk kedua molekul ini, dimulai dari penempatan atom.
Langkah Menggambar Struktur Lewis SiCl₂
- Tentukan Atom Pusat: Silikon (Si) kurang elektronegatif daripada klorin, jadi letakkan Si di tengah.
- Hitung Elektron Valensi: Total 18 elektron (Si:4, Cl:7 masing-masing).
- Buat Rangka Ikatan: Hubungkan Si dengan dua atom Cl menggunakan ikatan tunggal. Ini menggunakan 4 elektron.
- Distribusikan Elektron ke Atom Luar: Berikan 6 elektron (3 pasangan) pada setiap atom Cl untuk memenuhi oktet mereka. Ini menggunakan 12 elektron.
- Sisa Elektron pada Atom Pusat: Semua 18 elektron telah terpakai. Atom Si kini hanya memiliki 4 elektron (2 ikatan tunggal). Struktur final menunjukkan Si dengan dua ikatan, dikelilingi 4 elektron, dan setiap Cl dengan satu ikatan plus tiga pasangan bebas.
Visual struktur ruang SiCl₂ menyerupai molekul air (H₂O) tetapi tanpa pasangan bebas pada pusat. Bayangkan atom Si di tengah dengan dua atom Cl membentuk sudut. Molekul ini tidak planar sempurna; ia berbentuk bengkok seperti huruf V dengan sudut ikatan Cl-Si-Cl sekitar 103 derajat.
Langkah Menggambar Struktur Lewis H₃PO₄
- Tentukan Atom Pusat dan Susun: Fosfor (P) sebagai pusat. Keempat atom O mengelilingi P. Tiga atom H akan ditempatkan nanti, masing-masing pada satu atom O.
- Hitung Elektron Valensi: Total 32 elektron (P:5, O:6×4=24, H:1×3=3).
- Buat Rangka dan Penuhi Oktet: Hubungkan P ke keempat O dengan ikatan tunggal (gunakan 8 elektron). Berikan tiga pasangan bebas pada setiap O (gunakan 24 elektron). Pasangkan tiga atom H pada tiga atom O yang berbeda (ikatannya sudah termasuk dalam langkah rangka). Total elektron terpakai kini 32.
- Periksa Muatan Formal dan Optimasi: Pada struktur ini, P memiliki muatan formal +1 dan keempat O memiliki muatan formal -1. Untuk menstabilkan, ubah satu ikatan tunggal P-O (pada O yang tidak terikat H) menjadi ikatan rangkap dua. P menyumbangkan elektron tambahan, sehingga ikatan ini menjadi ikatan koordinat dalam representasi lainnya. Setelah perubahan, P kini memiliki muatan formal +1, O yang berikatan rangkap muatan 0, dua O yang terikat H muatan 0, dan satu O yang terikat H (penerima ikatan koordinat) muatan -1.
Visual struktur ruang H₃PO₄ berbentuk seperti tetrahedron yang sedikit terdistorsi. Atom P berada di pusat tetrahedron, dengan empat atom O menempati keempat sudutnya. Dari empat sudut ini, tiga di antaranya memiliki atom H yang terikat, menjorok keluar. Ikatan P=O sedikit lebih pendek daripada ikatan P-O lainnya. Sudut ikatan O-P-O mendekati sudut tetrahedral ideal, yaitu sekitar 109.5 derajat.
Aplikasi dan Relevansi dalam Konteks Kimia: Struktur Lewis SiCl₂ Dan H₃PO₄
Struktur Lewis bukan sekadar gambar statis; ia adalah peta jalan yang menjelaskan perilaku dinamis molekul dalam reaksi kimia. Analisis pada SiCl₂ dan H₃PO₄ memberikan contoh nyata tentang hal ini.
Kestabilan dan Reaktivitas SiCl₂
Kestabilan relatif SiCl₂ sangat rendah karena oktetnya yang tidak lengkap. Atom silikon dengan hanya empat elektron di sekelilingnya bersifat sangat elektrofilik (kekurangan elektron). Ini membuat SiCl₂ sangat reaktif. Ia cenderung berpolimerisasi dengan molekul SiCl₂ lainnya untuk mencapai oktet, atau bereaksi dengan nukleofil (spesies kaya elektron) seperti air, amonia, atau bahkan dengan dirinya sendiri untuk membentuk senyawa yang lebih stabil seperti SiCl₄ atau polimer seperti (SiCl₂)_n.
Dalam industri, senyawa seperti SiCl₂ sering muncul sebagai intermediat reaktif dalam sintesis senyawa silikon organik dan anorganik.
Struktur Lewis dan Sifat Asam H₃PO₄
Kemampuan H₃PO₄ mendonorkan proton secara langsung terlihat dari struktur Lewis-nya. Setelah melepas satu proton (H⁺) dari salah satu gugus O-H, anion yang tersisa, H₂PO₄⁻, mengalami delokalisasi muatan negatif. Muatan negatif tidak tetap berada pada satu atom oksigen tertentu, tetapi tersebar di antara atom-atom oksigen melalui resonansi. Delokalisasi muatan ini menstabilkan anion, yang menurut prinsip Le Châtelier, mendorong kesetimbangan disosiasi asam ke arah kanan.
Dengan kata lain, struktur Lewis yang menunjukkan kemungkinan resonansi setelah pelepasan proton menjelaskan mengapa H₃PO₄ adalah asam yang cukup kuat (meskipun triprotik dan hanya terdisosiasi sebagian pada tahap pertama).
Contoh Reaksi yang Menyoroti Struktur
Reaksi hidrolisis SiCl₂ dengan air menggambarkan reaktivitas ikatan Si-Cl yang polar dan kekurangan elektron pada Si: SiCl₂ + 2H₂O → SiO₂ + 4HCl. Atom Si yang kekurangan elektron diserang oleh pasangan elektron bebas dari atom oksigen air, memutus ikatan Si-Cl dan membentuk ikatan Si-O.
Sementara itu, reaksi netralisasi klasik H₃PO₄ dengan basa seperti NaOH menyoroti peran gugus O-H asamnya: H₃PO₄ + NaOH → NaH₂PO₄ + H₂O. Dalam reaksi ini, proton dari salah satu gugus O-H yang polar dalam struktur Lewis H₃PO₄ dipindahkan ke ion hidroksida (OH⁻) dari NaOH, menghasilkan air dan garam fosfat dihidrogen.
Kesimpulan Akhir
Maka, perjalanan memahami Struktur Lewis SiCl₂ dan H₃PO₄ mengajarkan lebih dari sekadar aturan menggambar. Ini adalah perenungan tentang keseimbangan: antara kepatuhan pada aturan oktet dan keberanian untuk berbeda, antara kesederhanaan ikatan tunggal dan kompleksitas ikatan datif. Setiap struktur adalah bukti bahwa dalam keragaman bentuk dan ikatan, terdapat suatu tatanan yang dapat dipahami, yang pada akhirnya menghubungkan kita dengan hukum fundamental alam semesta.
Detail FAQ
Apakah SiCl₂ stabil ditemukan dalam kondisi normal?
Tidak, SiCl₂ sangat reaktif dan tidak stabil dalam kondisi ambient. Senyawa ini cenderung mudah berpolimerisasi atau bereaksi lebih lanjut untuk mencapai konfigurasi yang lebih stabil, seperti membentuk SiCl₄.
Mengapa dalam H₃PO₄ atom fosfor (P) bisa dikelilingi lebih dari 8 elektron?
Karena atom fosfor berada di periode ketiga, sehingga memiliki orbital d yang dapat digunakan untuk menampung elektron tambahan, memungkinkannya memperluas oktet melebihi 8 elektron.
Bagaimana struktur Lewis mempengaruhi titik didih H₃PO₄?
Struktur Lewis H₃PO₄ menunjukkan adanya atom O yang terikat pada H. Hal ini memungkinkan terbentuknya ikatan hidrogen yang kuat antar molekul H₃PO₄, sehingga meningkatkan titik didihnya secara signifikan dibanding senyawa dengan massa molekul serupa tanpa ikatan hidrogen.
Apakah SiCl₂ bersifat polar atau nonpolar?
SiCl₂ bersifat polar. Meski bentuknya mungkin linear atau bengkok tergantung hibridisasi, adanya pasangan elektron bebas pada Si dan perbedaan keelektronegatifan Si dan Cl menciptakan momen dipol yang tidak saling meniadakan.